名校
解题方法
1 . 为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(气密性良好)。
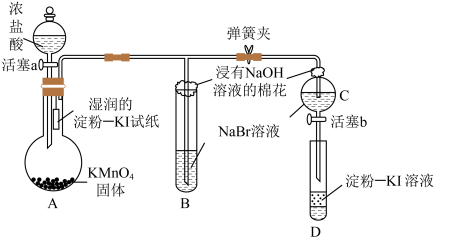
已知:浓盐酸与 固体混合会产生
固体混合会产生 。
。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.……
下列说法错误的是

已知:浓盐酸与
 固体混合会产生
固体混合会产生 。
。实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.……
下列说法错误的是
| A.A中湿润的淀粉-KI试纸变蓝,证明氯气的氧化性强于碘单质 |
| B.B中溶液变黄色,证明氯气的氧化性强于溴单质 |
C.B中发生反应的离子方程式为 |
| D.实验过程Ⅲ为关闭活塞a,打开活塞b,滴加溶液后充分振荡试管D,观察到D中溶液变蓝,即证明了溴单质的氧化性强于碘单质 |
您最近一年使用:0次
2023-02-04更新
|
984次组卷
|
6卷引用:重庆市缙云教育联盟2023-2024学年高一上学期1月期末化学试题
重庆市缙云教育联盟2023-2024学年高一上学期1月期末化学试题陕西省汉中市多校2022-2023学年高一上学期期末校际联考化学试题(已下线)寒假作业09 原子结构与元素周期表-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)浙江省杭州第四中学2023-2024学年高一上学期期末考试化学试题河南省名校联盟2023-2024学年高一下学期3月月考化学试题河南省信阳高级中学2023-2024学年高一下学期3月月考化学试题
2 . 草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。下列说法不正确的是
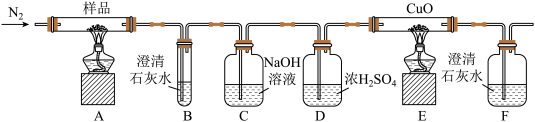
| A.装置D的作用只是除去混合气中的水蒸气,由于草酸亚铁的热分解产物没有水,不用除去水蒸气,所以装置D可以省略 |
| B.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO |
| C.实验开始时,应先通入N2,再点燃装置A、E的酒精灯 |
| D.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3 |
您最近一年使用:0次
2023-03-21更新
|
293次组卷
|
3卷引用:重庆市育才中学2022-2023学年高三上学期开学考试化学试题
解题方法
3 . 某化学兴趣小组设计如下两个实验证明:①氧化性Fe3+>I2,②反应2Fe3++2I-⇌2Fe2++I2为可逆反应。下列说法中错误的是
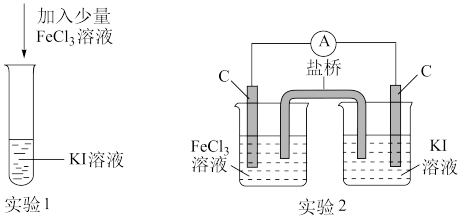

| A.实验1试管中加入淀粉后溶液变蓝,证明该条件下氧化性:Fe3+>I2 |
| B.实验2中的盐桥可用浸透KNO3溶液的脱脂棉填充 |
| C.实验1反应结束后,向试管中加入K3[Fe(CN)6]能判断该反应是否为可逆反应 |
| D.实验2电流表指针不再偏转时,向右侧烧杯中加入碘水电流表指针重新发生偏转,可判断该反应是可逆反应 |
您最近一年使用:0次
4 . 实验室制取乙烯并进行性质实验,装置如图,下列说法错误的是
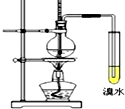
| A.乙醇发生消去反应生成乙烯 |
| B.实验中溴水褪色即可证明产生了乙烯 |
| C.制取乙烯反应中浓硫酸的主要作用为催化剂和脱水剂 |
| D.控制该反应温度在170℃左右,有利于减少副反应发生 |
您最近一年使用:0次
5 . 某学习小组在实验室制取 气体的过程中,不慎用到了浓盐酸,导致制得的
气体的过程中,不慎用到了浓盐酸,导致制得的 气体中混有
气体中混有 气体,他们设计了如下除去氯化氢气体并探究
气体,他们设计了如下除去氯化氢气体并探究 与过氧化钠
与过氧化钠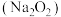 反应的实验,同时还可收集到
反应的实验,同时还可收集到 。已知
。已知 中试剂过量,请回答下列问题:
中试剂过量,请回答下列问题:
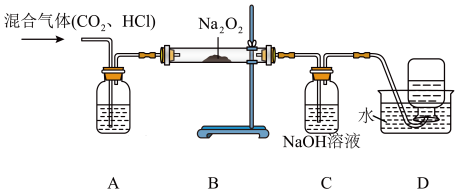
(1)装置A中盛装的试剂为_______ (填化学式);
(2)写出 中
中 与
与 发生反应的化学方程式为
发生反应的化学方程式为_______ ,该反应中,若消耗2个 ,则转移
,则转移_______ 个电子;
(3)装置 的作用是
的作用是_______ ,写出 中发生反应的离子方程式
中发生反应的离子方程式_______ ;
(4)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量反应后 中的固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含
中的固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含_______ ,该小组同学继续进行探究。
(提出问题)反应后硬质玻璃管中固体的成分是什么?
(做出猜想)猜想一: ,猜想二:
,猜想二: 和
和 。
。
(5)(实验验证)小组同学取少量溶液 于试管中,向其中加入过量的
于试管中,向其中加入过量的_______ 溶液。
A.氯化钡 B.氢氧化钠 C.氢氧化钡
若产生白色沉淀,过滤,向滤液中滴加几滴酚䣭试液,溶液变红,则证明猜想二成立。根据此猜想,写出产生白色沉淀的离子反应方程式:_______ 。
 气体的过程中,不慎用到了浓盐酸,导致制得的
气体的过程中,不慎用到了浓盐酸,导致制得的 气体中混有
气体中混有 气体,他们设计了如下除去氯化氢气体并探究
气体,他们设计了如下除去氯化氢气体并探究 与过氧化钠
与过氧化钠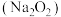 反应的实验,同时还可收集到
反应的实验,同时还可收集到 。已知
。已知 中试剂过量,请回答下列问题:
中试剂过量,请回答下列问题:
(1)装置A中盛装的试剂为
(2)写出
 中
中 与
与 发生反应的化学方程式为
发生反应的化学方程式为 ,则转移
,则转移(3)装置
 的作用是
的作用是 中发生反应的离子方程式
中发生反应的离子方程式(4)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量反应后
 中的固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含
中的固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含(提出问题)反应后硬质玻璃管中固体的成分是什么?
(做出猜想)猜想一:
 ,猜想二:
,猜想二: 和
和 。
。(5)(实验验证)小组同学取少量溶液
 于试管中,向其中加入过量的
于试管中,向其中加入过量的A.氯化钡 B.氢氧化钠 C.氢氧化钡
若产生白色沉淀,过滤,向滤液中滴加几滴酚䣭试液,溶液变红,则证明猜想二成立。根据此猜想,写出产生白色沉淀的离子反应方程式:
您最近一年使用:0次
名校
解题方法
6 . 为了达到实验目的,下列实验方案可行的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明 Cl₂ 与 H2O 的反应存在限度 | 向盛有 AgNO3溶液和淀粉-KI 溶液的试管中分别滴加新制氯水 |
| B | 比 较 酸 性 CH₃COOH>HClO | 用 pH 计分别测相同浓度的 CH3COONa 和NaClO 溶液的 pH |
| C | NaCl的结晶 | 将盛有 NaCl溶液的烧杯置于酒精灯上蒸发浓缩 |
| D | 检验菠菜中存在 Fe2+ | 将菠菜榨汁,过滤后将滤液煮沸,自然冷却后滴加铁氰化钾溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
7 . 下列有关实验的叙述正确的是


| A.甲装置可以用于制备乙酸乙酯 |
| B.乙装置可证明苯与溴发生的是取代反应 |
C.丙装置可用于探究 、 、 、苯酚的酸性强弱 、苯酚的酸性强弱 |
| D.丁装置可以用于制硝基苯 |
您最近一年使用:0次
名校
解题方法
8 . 请完成以下问题:
Ⅰ.某化学学习小组欲探究钠及其化合物的性质。
(1)钠长期置于空气中,最后形成的物质是_______ (填化学式),该物质与氯化钙溶液混合后,发生反应的离子方程式为_______ 。
(2)某同学向过氧化钠与水反应后的溶液中滴入几滴酚酞溶液,发现溶液变红,原因为_______ (用离子方程式及必要的文字说明)。将带火星的木条伸入试管中,木条未复燃,向试管中加入少许黑色 粉末,试管内剧烈反应产生大量气泡,该气体能使带火星的木条复燃,证明原试管中存在中间产物
粉末,试管内剧烈反应产生大量气泡,该气体能使带火星的木条复燃,证明原试管中存在中间产物_______ 。
(3)欲进一步探究钠能否与 反应,设计如下图所示装置,实验操作及现象见下表。
反应,设计如下图所示装置,实验操作及现象见下表。
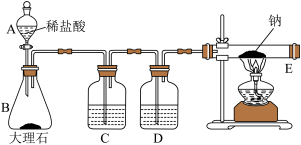
①B中反应一段时间,待E中充满 后,再点燃E处酒精灯,其目的是
后,再点燃E处酒精灯,其目的是_______ 。
②请根据以上现象写出E中发生反应的化学方程式_______ 。
Ⅱ.向200mL某浓度的NaOH溶液中缓慢通入一定量的 ,充分反应后,得到
,充分反应后,得到 和
和 的混合溶液。向上述所得溶液中,逐滴滴加
的混合溶液。向上述所得溶液中,逐滴滴加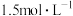 的盐酸(忽略溶液体积的变化),所得气体的体积与所加盐酸的体积关系如图所示:
的盐酸(忽略溶液体积的变化),所得气体的体积与所加盐酸的体积关系如图所示:
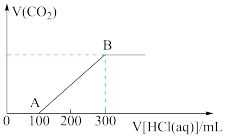
(4)B点时,反应所得溶液中溶质的物质的量浓度是_______  。
。
Ⅰ.某化学学习小组欲探究钠及其化合物的性质。
(1)钠长期置于空气中,最后形成的物质是
(2)某同学向过氧化钠与水反应后的溶液中滴入几滴酚酞溶液,发现溶液变红,原因为
 粉末,试管内剧烈反应产生大量气泡,该气体能使带火星的木条复燃,证明原试管中存在中间产物
粉末,试管内剧烈反应产生大量气泡,该气体能使带火星的木条复燃,证明原试管中存在中间产物(3)欲进一步探究钠能否与
 反应,设计如下图所示装置,实验操作及现象见下表。
反应,设计如下图所示装置,实验操作及现象见下表。
| 实验Ⅰ | 实验Ⅱ | |
| 操作 | 先取一块纯净的钠放入干燥的E管中,然后打开A的活塞,反应一段时间后,点燃E处酒精灯。 | 将实验Ⅰ的E管冷却后用水冲洗内壁,过滤,取黑色滤渣灼烧;取滤液滴加氯化钡溶液。 |
| 现象 | ①钠剧烈燃烧,火焰呈黄色 ②产生大量白烟,同时有黑色物质生成,冷却后有白色固体附着在管壁上。 | ①黑色滤渣可燃 ②滴加氯化钡溶液有白色沉淀生成 |
 后,再点燃E处酒精灯,其目的是
后,再点燃E处酒精灯,其目的是②请根据以上现象写出E中发生反应的化学方程式
Ⅱ.向200mL某浓度的NaOH溶液中缓慢通入一定量的
 ,充分反应后,得到
,充分反应后,得到 和
和 的混合溶液。向上述所得溶液中,逐滴滴加
的混合溶液。向上述所得溶液中,逐滴滴加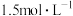 的盐酸(忽略溶液体积的变化),所得气体的体积与所加盐酸的体积关系如图所示:
的盐酸(忽略溶液体积的变化),所得气体的体积与所加盐酸的体积关系如图所示:
(4)B点时,反应所得溶液中溶质的物质的量浓度是
 。
。
您最近一年使用:0次
9 . 学习小组在实验室中利用下图所示装置制备SO2并进行相关性质的探究。回答下列问题:
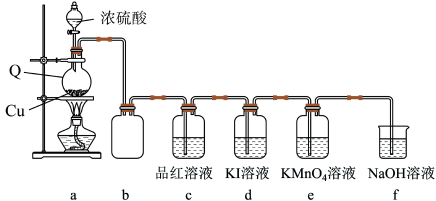
(1)仪器Q的名称为_______ ;装置c中品红溶液褪色,可证明SO2具有_______ 性,装置b的作用是_______ 。
(2)向分液漏斗中滴加浓硫酸之前,需先通入一段时间N2,此操作的目的是_______ 。
(3)装置a中反应的化学方程式为_______ 。
(4)探究:探究SO2在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:SO2+4I-+4H+=S↓+2I2+2H2O。但有同学提出上述反应生成的I2可与SO2发生反应:SO2+I2+2H2O= +2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
+2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
Ⅰ.取适量装置d中浊液,向其中滴加几滴_______ 溶液(填试剂名称),振荡,无明显变化,浊液中无I2。
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,_______ ,出现白色沉淀,产物溶液中存在 。
。
综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为_______ 。

(1)仪器Q的名称为
(2)向分液漏斗中滴加浓硫酸之前,需先通入一段时间N2,此操作的目的是
(3)装置a中反应的化学方程式为
(4)探究:探究SO2在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:SO2+4I-+4H+=S↓+2I2+2H2O。但有同学提出上述反应生成的I2可与SO2发生反应:SO2+I2+2H2O=
 +2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
+2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。Ⅰ.取适量装置d中浊液,向其中滴加几滴
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,
 。
。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
您最近一年使用:0次
2023-01-19更新
|
877次组卷
|
4卷引用:重庆市第八中学校2021-2022学年高一下学期期中考试化学试题
名校
10 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为_______ 。
②除杂装置B中盛装的试剂为_______ 。
③C中有多个反应发生,其中生成高铁酸钾的的反应方程式,并用单线桥表示其电子转移情况_____ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有_______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能有_______ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是_______ 。
②根据K2FeO4的制备实验得出:氧化性Cl2_____  (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
③资料表明,酸性溶液中的氧化性 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为
②除杂装置B中盛装的试剂为
③C中有多个反应发生,其中生成高铁酸钾的的反应方程式,并用单线桥表示其电子转移情况
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。 |
Ⅰ.由方案Ⅰ中溶液变红可知a中含有
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次



