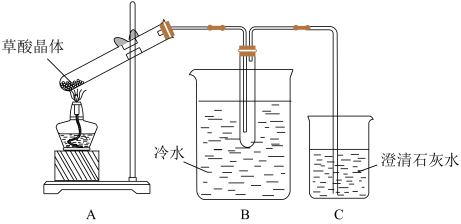
1 . 草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是_________ ,由此可知草酸晶体分解的产物中有_______ 。装置B的主要作用是________ 。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
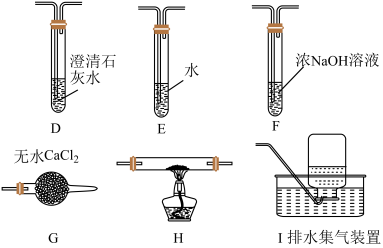
①乙组同学的实验装置中,依次连接的合理顺序为A、B、______ 。装置H反应管中盛有的物质是_______ 。
②能证明草酸晶体分解产物中有CO的现象是_______ 。
(3)设计实验证明:
①草酸的酸性比碳酸的强______ 。
②草酸为二元酸______ 。
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是

(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为A、B、
②能证明草酸晶体分解产物中有CO的现象是
(3)设计实验证明:
①草酸的酸性比碳酸的强
②草酸为二元酸
您最近一年使用:0次
2019-01-30更新
|
5649次组卷
|
9卷引用:重庆市垫江县2018届高三上学期模底考试理综化学试题
重庆市垫江县2018届高三上学期模底考试理综化学试题2015年全国普通高等学校招生统一考试化学(新课标I卷)2016届山东省淄博市第七中学高三上学期第一次月考化学试卷2016届安徽省六安一中高三下学期综合训练(一)理综化学试卷2016届江苏省清江中学高三下冲刺模拟三化学试卷(已下线)考点20 化学实验-2020年【衔接教材·暑假作业】新高三一轮复习化学(已下线)专题讲座(十)化学实验设计与探究(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)题型65 草酸和草酸盐、硼及其化合物的性质和用途(已下线)03 物质成分或反应产物探究类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
2 . 下列实验方案中,不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 鉴别溴蒸气和NO2 | 分别通入硝酸银溶液中,产生淡黄色沉淀的是溴蒸汽 |
| B | 证明氧化性: H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| C | 证明浓硫酸具有氧化性、脱水性 | 在蔗糖中滴加浓硫酸,其变黑并产生有刺激性气味的气体 |
| D | 证明醋酸的电离吸热 | 测定稀醋酸和稀NaOH 的中和热数据,数值小于57.3kJ/mol |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-12-12更新
|
287次组卷
|
2卷引用:重庆市第一中学2018届高三11月月考理科综合化学试题
名校
解题方法
3 . 高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。

(1)写出高氯酸铵分解的化学方程式__________ 。
(2) 高氯酸铵分解选择的装置是__________ (填字母)。
(3)按气流从左到右,装置的连接顺序是: 分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________ ,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________ 。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________ 。
(7) 某实验室存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________ 。


(1)写出高氯酸铵分解的化学方程式
(2) 高氯酸铵分解选择的装置是
(3)按气流从左到右,装置的连接顺序是: 分解装置→_____→_____→_____→_____→_____。
(4)C中所放的试剂是
(5)能证明有Cl2产生的现象是
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是
(7) 某实验室存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为

您最近一年使用:0次
2018-04-17更新
|
324次组卷
|
4卷引用:重庆2018年普通高等学校招生全国统一考试4月调研测试(理综)化学部
解题方法
4 . 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是SO2,而乙同学认为除SO2外,还可能产生H2.为验证结果,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去).试回答:
(1)上述反应中生成SO2的化学方程式为_____________ .
(2)乙同学认为还可能产生H2的理由是_____________ .
(3)A中加入的试剂是____ ,作用是_______ ;B中加入的试剂是_____ ,作用是______ ;E中加入的试剂是____ ,作用是_________
(4)可以证明气体X中含有氢气的实验现象是:C中:______ ,D中:_______ .
该小组同学将收集的SO2气体通入0.1mol•L﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的硝酸根离子,假设二:溶液中溶解的O2
(5)该小组设计实验验证了假设一,请在下表空白处填写相关实验现象
为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图,实验1中溶液pH变小的原因是__________________________________ ;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)__________________ .
(6)丁同学以实验1为参照,补充设计了实验3来验证假设二,请完善他的设计
(7)若假设二成立,请预测:在相同条件下,分别加入足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者_______ (填“>”或“<”)后者,理由是_________________________________ 。
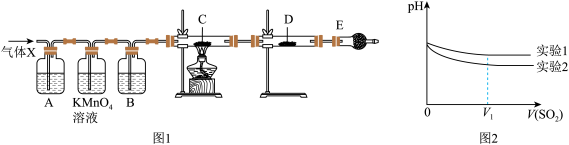
(1)上述反应中生成SO2的化学方程式为
(2)乙同学认为还可能产生H2的理由是
(3)A中加入的试剂是
(4)可以证明气体X中含有氢气的实验现象是:C中:
该小组同学将收集的SO2气体通入0.1mol•L﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的硝酸根离子,假设二:溶液中溶解的O2
(5)该小组设计实验验证了假设一,请在下表空白处填写相关实验现象
实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(6)丁同学以实验1为参照,补充设计了实验3来验证假设二,请完善他的设计
实验步骤 | 实验现象 | 结论 |
| 实验3: | 有白色沉淀产生 | 假设二成立 |
(7)若假设二成立,请预测:在相同条件下,分别加入足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者
您最近一年使用:0次
名校
5 . 某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
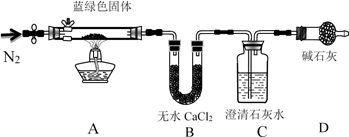
步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
(1)假设2中的沉淀为________________ 。
(2)假设1中沉淀为Cu(OH)2的理论依据是____________________________________ 。
(3)无水乙醇洗涤的目的_________________________ 。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设__ (填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用____________ 试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_________________ 。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为____________________ 。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。

步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
(1)假设2中的沉淀为
(2)假设1中沉淀为Cu(OH)2的理论依据是
(3)无水乙醇洗涤的目的
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设
(5)乙同学认为只要将上图中B装置的试剂改用
(6)乙同学更换B试剂后验证假设3成立的实验现象是
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为
您最近一年使用:0次
2016-12-09更新
|
232次组卷
|
7卷引用:重庆市铜梁县第一中学2018届高三11月月考化学试题
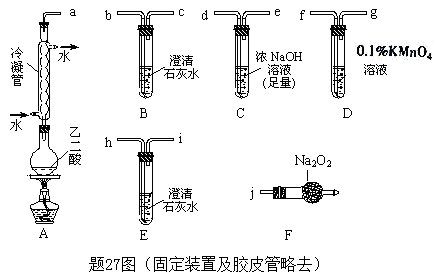
6 . 两个学习小组用题27图装置探究乙二酸(HOOC—COOH)受热分解的部分产物。
(1)甲组:
①按接口顺序:a—b—c—d—e—f—g—h连接装置进行实验。B中溶液变浑浊,证明分解产物有___________ ;装置C的作用是_________ ;E中溶液变浑浊,D中的现象是_________ ,证明分解产物有_________ 。
②乙二酸受热分解的化学方程式为______________________________________________ 。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为________________________________________ 。
②从A~F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。最简单的装置接口连接顺序是________________ ;实验后用F中的固体进行验证的方法是_________________________________ (可另选试剂)。

(1)甲组:
①按接口顺序:a—b—c—d—e—f—g—h连接装置进行实验。B中溶液变浑浊,证明分解产物有
②乙二酸受热分解的化学方程式为
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为
②从A~F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。最简单的装置接口连接顺序是
您最近一年使用:0次
2016-12-09更新
|
49次组卷
|
5卷引用:2009年普通高等学校招生统一考试理综试题化学部分(重庆卷)
名校
7 . 某些物质的有关数据如下表,回答以下问题:
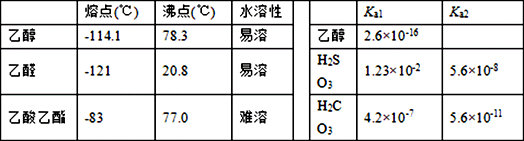
实验一 乙醇在铜的催化下转化为乙醛
将一束质量为w的铜丝灼烧变黑后,迅速插入装有乙醇的试管a中。
(1)铜丝上可观察到的现象是________________________ ,解释该现象的化学反应方程式为_________________________________________ ;
(2)若要证明铜丝起催化作用,还需要进行的操作是________________________________ ;
实验二 乙醛的提纯
上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。

已知: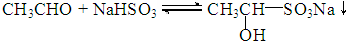 (α-羟基乙磺酸钠)
(α-羟基乙磺酸钠)
(3)操作A的名称是_____________________ ;
(4)写出Na2CO3溶液参与反应的化学方程式:______________________________ ;
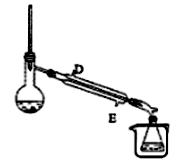
(5)某同学设计操作B的装置(夹持和加热装置已略去)如图所示。
①冷凝管中的液体应从________ 口进。(填“D”或“E”)
②下列有关操作与装置的分析,正确的是_________ 。(填字母)
a. 烧杯中应装冰水
b. 冷凝管应通温水
c. 图示装置可用于除去乙酸乙酯中混有的乙醇
实验三 乙醛溶液浓度的测定
室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH可以测定“实验一”中试管a内乙醛溶液浓度,操作如下:
取试管a中溶液4mL,加入1mL饱和Na2SO3溶液(过量),再加入5mL水,充分振荡后用pH计测定溶液pH;另取试管b,加入4mL乙醇做空白试验,实验结果如右表:
(6)试管a中乙醛溶液的物质的量浓度为______________ mol·L-1。(列出计算式即可)

实验一 乙醇在铜的催化下转化为乙醛
将一束质量为w的铜丝灼烧变黑后,迅速插入装有乙醇的试管a中。
(1)铜丝上可观察到的现象是
(2)若要证明铜丝起催化作用,还需要进行的操作是
实验二 乙醛的提纯
上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。

已知:
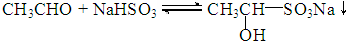 (α-羟基乙磺酸钠)
(α-羟基乙磺酸钠)(3)操作A的名称是
(4)写出Na2CO3溶液参与反应的化学方程式:
(5)某同学设计操作B的装置(夹持和加热装置已略去)如图所示。
①冷凝管中的液体应从
②下列有关操作与装置的分析,正确的是
a. 烧杯中应装冰水
b. 冷凝管应通温水
c. 图示装置可用于除去乙酸乙酯中混有的乙醇
实验三 乙醛溶液浓度的测定
室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH可以测定“实验一”中试管a内乙醛溶液浓度,操作如下:
取试管a中溶液4mL,加入1mL饱和Na2SO3溶液(过量),再加入5mL水,充分振荡后用pH计测定溶液pH;另取试管b,加入4mL乙醇做空白试验,实验结果如右表:
| 实验 试管 | pH | ||
| 第1次 | 第2次 | 第3次 | |
| a | 12.42 | 12.40 | 12.38 |
| b | 10.43 | 10.43 | 10.40 |
您最近一年使用:0次
名校
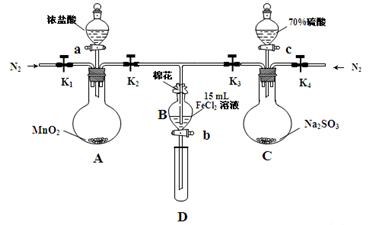
8 . I. 为比较Cl2、Fe3+、SO2的氧化性,用下图所示装置进行实验,其过程如下:
①.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
②.打开活塞a,滴加一定量的浓盐酸,给A加热。
③.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2。
④.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
⑤.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
⑥.更新试管D,重复过程④,检验B溶液中的离子。
(1)棉花中浸润的溶液为__________ 。
(2)当A中足量固体加入36.5%密度为1.2g/mL盐酸100mL时,其反应转移的电子数目为______ 。
(3)过程⑥中检验B溶液中是否含有硫酸根离子的操作是___________ 。
(4)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性的是____ 同学,其氧化性顺序为____________ 。
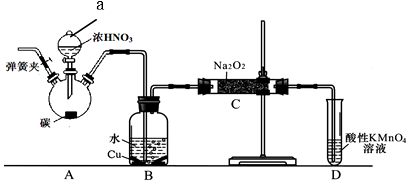
II. NaNO2是重要的防腐剂,+3价的氮易发生氧化反应且在酸性环境中不稳定。其5mol/L水溶液pH为9。某化学兴趣小组设计如下图所示装置制备亚硝酸钠。其操作是①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;②一段时间后停止加热。回答下列问题:
(1)B中观察的主要现象是__________ ,D装置的作用是____________ 。
(2)检验C中产物有亚硝酸钠的操作是_______ ,相应反应方程式为___________ 。
(3)经检验C中产物亚硝酸钠含量较少。a. 甲同学认为C中产物不仅有亚硝酸钠,还有其他杂质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂是_______ (写名称)。b. 乙同学认为除上述干扰因素外,还会有氧气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是___ 。
(4)由题给条件计算HNO2的Ka数值为______________ 。
①.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
②.打开活塞a,滴加一定量的浓盐酸,给A加热。
③.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2。
④.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
⑤.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
⑥.更新试管D,重复过程④,检验B溶液中的离子。
(1)棉花中浸润的溶液为
(2)当A中足量固体加入36.5%密度为1.2g/mL盐酸100mL时,其反应转移的电子数目为
(3)过程⑥中检验B溶液中是否含有硫酸根离子的操作是
(4)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性的是
| 过程④ B溶液中含有的离子 | 过程⑥ B溶液 中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
II. NaNO2是重要的防腐剂,+3价的氮易发生氧化反应且在酸性环境中不稳定。其5mol/L水溶液pH为9。某化学兴趣小组设计如下图所示装置制备亚硝酸钠。其操作是①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;②一段时间后停止加热。回答下列问题:
(1)B中观察的主要现象是
(2)检验C中产物有亚硝酸钠的操作是
(3)经检验C中产物亚硝酸钠含量较少。a. 甲同学认为C中产物不仅有亚硝酸钠,还有其他杂质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂是
(4)由题给条件计算HNO2的Ka数值为
您最近一年使用:0次
名校
解题方法
9 . 某学校化学兴趣小组对 的化学性质进行如图的探究。下列说法错误的是
的化学性质进行如图的探究。下列说法错误的是
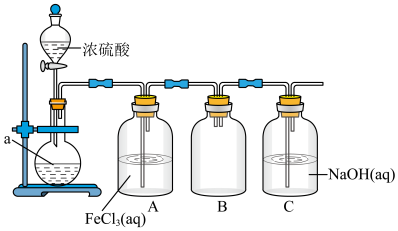
 的化学性质进行如图的探究。下列说法错误的是
的化学性质进行如图的探究。下列说法错误的是
A.烧瓶中放入的药品a为 |
B.A瓶中发生的反应为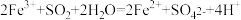 |
| C.B瓶的作用为防倒吸 |
D.C瓶用于吸收未反应的 |
您最近一年使用:0次
10 . 将1.95gNa2O2加入水中,反应后配成50mL溶液A,进行如下实验。下列说法错误的是
| 编号 | ① | ② | ③ | ④ |
| 操作 | 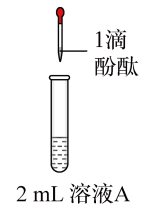 | 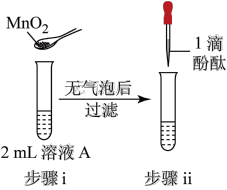 | 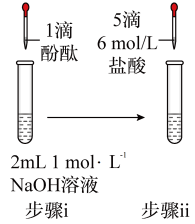 | 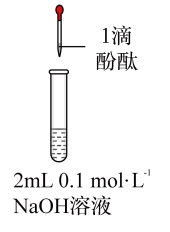 |
| 现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量使带火星的木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.溶液变红色 | 溶液变红色,2小时后无明显变化 |
| A.由实验可知,Na2O2与水反应有H2O2生成 |
B.②、③溶液褪色与 浓度较大有关 浓度较大有关 |
C.若向①褪色后的溶液中滴加5滴 盐酸,溶液将变红 盐酸,溶液将变红 |
D.若向④中继续滴加 盐酸或 盐酸或 溶液,溶液均可能褪色 溶液,溶液均可能褪色 |
您最近一年使用:0次
2023-07-07更新
|
1099次组卷
|
6卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题



