解题方法
1 . 某小组为探究 溶解于
溶解于 溶液的反应机理,提出下列两种观点:
溶液的反应机理,提出下列两种观点:
观点一: 的水解导致
的水解导致 溶液呈酸性,
溶液呈酸性, 与
与 反应,从而促进了
反应,从而促进了 的沉淀溶解平衡
的沉淀溶解平衡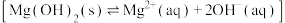 ]向溶解方向移动。
]向溶解方向移动。
观点二: 直接结合了
直接结合了 电离产生
电离产生 ,从而使得
,从而使得 的沉淀溶解平衡向溶解方向移动。
的沉淀溶解平衡向溶解方向移动。
资料:① 溶液呈中性;②
溶液呈中性;② 对该反应几乎无影响。
对该反应几乎无影响。
实验过程:各取 固体
固体 ,分别加入选取的实验试剂中。
,分别加入选取的实验试剂中。
(1)经检验,实验2中刺激性气味气体为 ,其具体方案为
,其具体方案为___________ 。
(2)甲同学对比实验1、2,认为实验2固体能溶解的原因是 溶液中
溶液中 ,能与
,能与 反应。用化学用语解释
反应。用化学用语解释 溶液显酸性的原因
溶液显酸性的原因___________ 。
(3)乙同学通过实验3证明甲同学的说法不合理。
①X是___________ (填写溶质的化学式)。
②由实验3获取的证据为___________ 。
(4)为进一步探究实验2固体能溶解的原因,进行实验4.
乙依据上述实验,可以得出 能与
能与 直接反应。丙同学认为该方案不严谨,需要补充的实验方案是
直接反应。丙同学认为该方案不严谨,需要补充的实验方案是___________ 。
(5)由以上实验可以得出的结论是___________ 。
(6)为进一步分析 溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验:
溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验:
分析上述实验数据从平衡移动的角度解释上述现象___________ 。
 溶解于
溶解于 溶液的反应机理,提出下列两种观点:
溶液的反应机理,提出下列两种观点:观点一:
 的水解导致
的水解导致 溶液呈酸性,
溶液呈酸性, 与
与 反应,从而促进了
反应,从而促进了 的沉淀溶解平衡
的沉淀溶解平衡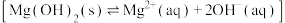 ]向溶解方向移动。
]向溶解方向移动。观点二:
 直接结合了
直接结合了 电离产生
电离产生 ,从而使得
,从而使得 的沉淀溶解平衡向溶解方向移动。
的沉淀溶解平衡向溶解方向移动。资料:①
 溶液呈中性;②
溶液呈中性;② 对该反应几乎无影响。
对该反应几乎无影响。实验过程:各取
 固体
固体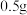 ,分别加入选取的实验试剂中。
,分别加入选取的实验试剂中。| 实验 | 实验试剂 | 实验现象 |
| 1 |  蒸馏水 蒸馏水 | 白色固体不溶解 |
| 2 | 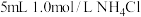 溶液 溶液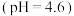 | 在微热下,产生刺激性气味气体且白色固体溶解 |
 ,其具体方案为
,其具体方案为(2)甲同学对比实验1、2,认为实验2固体能溶解的原因是
 溶液中
溶液中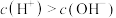 ,能与
,能与 反应。用化学用语解释
反应。用化学用语解释 溶液显酸性的原因
溶液显酸性的原因(3)乙同学通过实验3证明甲同学的说法不合理。
| 实验 | 实验试剂 | 实验现象 |
| 3 | 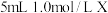 溶液 溶液 |
②由实验3获取的证据为
(4)为进一步探究实验2固体能溶解的原因,进行实验4.
| 实验 | 实验试剂 | 实验现象 |
| 4 | 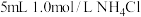 乙醇溶液 乙醇溶液 | 在微热下,白色固体溶解 |
 能与
能与 直接反应。丙同学认为该方案不严谨,需要补充的实验方案是
直接反应。丙同学认为该方案不严谨,需要补充的实验方案是(5)由以上实验可以得出的结论是
(6)为进一步分析
 溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验:
溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验: 溶液的浓度 溶液的浓度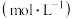 | 现象 |
| 0.05 | 白色浑浊, 后仍有部分不溶解 后仍有部分不溶解 |
| 0.07 | 少量白色浑浊, 左右完全溶解 左右完全溶解 |
| 0.10 | 振荡 后完全溶解 后完全溶解 |
| 0.15 | 振荡 后完全溶解 后完全溶解 |
| 0.20 | 振荡后迅速溶解 |
| 0.30 | 振荡后迅速溶解 |
您最近一年使用:0次
2 . 过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行如图所示实验,实验①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列说法不正确的是
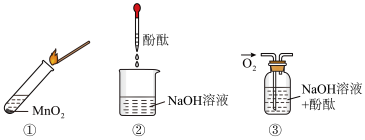
A.过氧化钠与水反应产生的气体为 |
B.过氧化钠与水反应需要 作催化剂 作催化剂 |
| C.实验②、③证明使酚酞褪色的不是氢氧化钠和氧气 |
D.过氧化钠与水反应生成了具有漂白性的 |
您最近一年使用:0次
2023-12-21更新
|
157次组卷
|
2卷引用:山西省大同市2023-2024学年高一上学期12月月考化学试题
3 . 进行乙醇的催化氧化及产物检验的实验装置如图所示,下列有关说法错误的是


A.乙醇能发生反应: |
| B.Ⅰ中左侧固体颜色按“红色→黑色→红色”变化 |
C.本实验可证明 能挥发 能挥发 |
| D.Ⅱ中很快有银镜生成 |
您最近一年使用:0次
2023-04-11更新
|
558次组卷
|
2卷引用:山西省太原师范学院附属中学、太原市师苑中学校2022-2023学年高一下学期5月月考化学试题
名校
解题方法
4 . 某同学用下列装置进行有关Cl2的实验,下列说法不正确的是( )
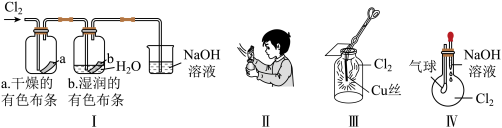

| A.图I中:实验现象证明氯气无漂白作用,氯水有漂白作用 |
| B.图II中:闻Cl2的气味 |
| C.图III中:生成蓝色的烟 |
| D.图IV中:若气球变大,证明Cl2可与NaOH反应 |
您最近一年使用:0次
2020-12-05更新
|
284次组卷
|
3卷引用:山西省太原市行知宏实验中学校2020-2021学年高一上学期期末考试化学试题
名校
5 . 探究硫酰氯(SO2Cl2,易水解液体)在催化剂作用下加热分解的产物,实验装置如图所示。下列说法错误的是
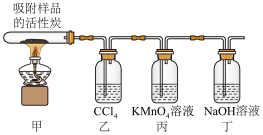

| A.装置甲中出现黄绿色证明分解产物中有 Cl2 |
| B.装置乙可除去 Cl2 |
| C.装置丙可证明分解产物含有 SO2 |
| D.SO2Cl2水解时生成 SO2 和 HCl |
您最近一年使用:0次
2020-09-28更新
|
531次组卷
|
5卷引用:山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题
山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题福建省泉州市2021届高三质量监测(一) 化学试题(已下线)易错19 实验装置类选择题-备战2021年高考化学一轮复习易错题广东省深圳市新安中学2021-2022学年高三下学期开学测试化学试题(已下线)专题七实验装置图(讲)
名校
解题方法
6 . “化学多米诺实验”是只需控制第一个反应,就能使若干化学实验依次发生,如图所示。已知:①Cu2++4NH3•H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2的催化剂);②已知装置A、C中所用硫酸的浓度相同,装置B、D中所用金属锌的质量完全相同

下列说法错误的是( )

下列说法错误的是( )
| A.该实验成功的关键条件是整套装置的气密性良好 |
| B.因为形成原电池,所以装置D中生成氢气的反应速率一定大于B |
| C.导管a的作用是平衡A和B内气压 |
| D.装置H中出现浅黄色浑浊,可证明非金属性:O>S |
您最近一年使用:0次
2020-06-16更新
|
703次组卷
|
4卷引用:山西省太原市2020届高三模拟试题(二)理科综合化学试题
山西省太原市2020届高三模拟试题(二)理科综合化学试题(已下线)第26讲 化学实验基本操作及实验安全-2021年高考化学一轮复习名师精讲练安徽省淮北市第一中学 2021-2022学年高二上学期第一次月考化学试题湖南省临澧县第一中学2021-2022学年高一下学期第三次阶段性考试化学试题
名校
解题方法
7 . 常温下氯化铁为棕黑色固体,易升华。实验室欲证明H2能在加热的条件下还原FeCl3,设计如下实验。下列说法错误的是
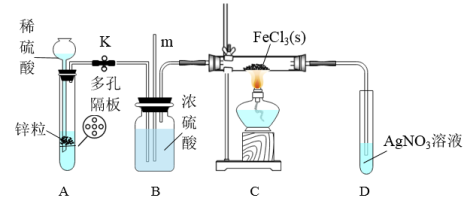

| A.装置A的优点是随开随用,随关随停 |
| B.导管m的作用是平衡压强,观察是否堵塞 |
| C.装置D中产生白色沉淀即可证明H2能还原FeCl3 |
| D.实验结束后,应先熄灭C处酒精灯,待硬质玻璃管冷却后关闭K |
您最近一年使用:0次
2020-01-17更新
|
523次组卷
|
4卷引用:第三章 实验活动2 铁及其化合物的性质 期末备考复习 2023-2024学年高一上学期化学人教版(2019)必修第一册
8 . 草酸(H2C2O4)是一种还原性的二元弱酸(常温下,草酸的电离常数K1=5.4x10-2,K2=5.4x10-5 ),主要存在于菠菜等植物中。
(1)常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,图中c点所示溶液中: 2c( )+2c(
)+2c( )+2c(H2C2O4)=c(Na+)
)+2c(H2C2O4)=c(Na+)

则a点所示溶液中各离子的浓度由大到小的顺序为___________ 。
(2) 中碳元素的化合价是+3价,推测其有还原性。为了验证
中碳元素的化合价是+3价,推测其有还原性。为了验证 与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体,Fe3++3 =[Fe(C2O4)3]3- K=1.6×1020
=[Fe(C2O4)3]3- K=1.6×1020
①该小组同学学并未检出反应后的溶液中有Fe2+,从反应原理的角度解释 和Fe3+ 未发生氧化还原反应的可能的原因是
和Fe3+ 未发生氧化还原反应的可能的原因是___________ 。
② 经进一步研究分析,同学们改进了实验方案。设计了如图所示的装置,验证了 的还原性强于Fe2+。
的还原性强于Fe2+。

i.闭合K,电流计指针偏转,一段时间后,取少许左侧溶液,滴加_______ 溶液(填化学式),生成蓝色沉淀,证明左池有Fe2+生成。
ii.写出右池电极反应式:___________ 。
iii.该装置的优点是___________ 。
(1)常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,图中c点所示溶液中: 2c(
 )+2c(
)+2c( )+2c(H2C2O4)=c(Na+)
)+2c(H2C2O4)=c(Na+)
则a点所示溶液中各离子的浓度由大到小的顺序为
(2)
 中碳元素的化合价是+3价,推测其有还原性。为了验证
中碳元素的化合价是+3价,推测其有还原性。为了验证 与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体,Fe3++3
 =[Fe(C2O4)3]3- K=1.6×1020
=[Fe(C2O4)3]3- K=1.6×1020①该小组同学学并未检出反应后的溶液中有Fe2+,从反应原理的角度解释
 和Fe3+ 未发生氧化还原反应的可能的原因是
和Fe3+ 未发生氧化还原反应的可能的原因是② 经进一步研究分析,同学们改进了实验方案。设计了如图所示的装置,验证了
 的还原性强于Fe2+。
的还原性强于Fe2+。
i.闭合K,电流计指针偏转,一段时间后,取少许左侧溶液,滴加
ii.写出右池电极反应式:
iii.该装置的优点是
您最近一年使用:0次
9 . 某化学兴趣小组用下图装置(部分夹持装置已略去)制取氨气并探究其性质。___________ 。(填化学式)
(2)气体通过C、D装置时,试纸颜色发生变化的是___________ (填字母),原因是氨水呈___________ 性。
(3)当E装置中集满 时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到E中的现象是
时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到E中的现象是___________ 。
(4)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。___________ ,证明氨气具有___________ (填“氧化性”或“还原性”)。
(5)NH3易溶于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为___________ mol∙L-1。
(6)已知加热条件下,氨气可以与铝发生置换反应生成AlN;AlN加热时可溶于浓碱溶液并产生氨气,写出浓碱中发生反应的化学方程式:___________ 。

(2)气体通过C、D装置时,试纸颜色发生变化的是
(3)当E装置中集满
 时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到E中的现象是
时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到E中的现象是(4)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。

(5)NH3易溶于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为
(6)已知加热条件下,氨气可以与铝发生置换反应生成AlN;AlN加热时可溶于浓碱溶液并产生氨气,写出浓碱中发生反应的化学方程式:
您最近一年使用:0次
名校
解题方法
10 . 实验室用浓硫酸与铜丝加热生成的 制备少量
制备少量 并检验性质。
并检验性质。 并检验性质
并检验性质
操作及现象:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,试管ⅲ中溶液变红,一段时间后,将铜丝抽离硫酸并停止加热。
(1)ⅰ中发生反应的化学反应方程式为______ 。
(2)ⅱ中现象说明 具有
具有______ 作用。
(3)若将试管ⅲ与试管ⅱ位置互换,石蕊溶液变为红色能否作为 是酸性氧化物的证据?说明理由:
是酸性氧化物的证据?说明理由:______ 。
Ⅱ.制备 并检验性质
并检验性质
(4)ⅳ中反应的离子方程式为______ 。
(5)进行实验:

①A中溶液褪色,说明 具有
具有______ 性。
②B中产生淡黄色沉淀的离子方程式为______ 。
③C中无明显现象,甲同学通过检测 的生成证明
的生成证明 和
和 发生反应:取1mL C中溶液于试管中,
发生反应:取1mL C中溶液于试管中,______ (填试剂、操作和现象)。
乙同学认为甲同学的实验没有排除 的影响,设计对比实验:
的影响,设计对比实验:______ 。
综合甲、乙同学的实验可知, 能将
能将 氧化。
氧化。
 制备少量
制备少量 并检验性质。
并检验性质。
 并检验性质
并检验性质操作及现象:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,试管ⅲ中溶液变红,一段时间后,将铜丝抽离硫酸并停止加热。
(1)ⅰ中发生反应的化学反应方程式为
(2)ⅱ中现象说明
 具有
具有(3)若将试管ⅲ与试管ⅱ位置互换,石蕊溶液变为红色能否作为
 是酸性氧化物的证据?说明理由:
是酸性氧化物的证据?说明理由:Ⅱ.制备
 并检验性质
并检验性质(4)ⅳ中反应的离子方程式为
(5)进行实验:

①A中溶液褪色,说明
 具有
具有②B中产生淡黄色沉淀的离子方程式为
③C中无明显现象,甲同学通过检测
 的生成证明
的生成证明 和
和 发生反应:取1mL C中溶液于试管中,
发生反应:取1mL C中溶液于试管中,乙同学认为甲同学的实验没有排除
 的影响,设计对比实验:
的影响,设计对比实验:综合甲、乙同学的实验可知,
 能将
能将 氧化。
氧化。
您最近一年使用:0次
2024-04-03更新
|
86次组卷
|
2卷引用:山西省大同市第一中学校2023-2024学年高一下学期4月期中考试化学试题



