解题方法
1 . 氯化亚铜(CuCl) 为白色粉末,其露置于空气中易被氧化为绿色的碱式氯化铜Cu2(OH)3Cl]。某兴趣小组高温加热分解氯化铜晶体(CuCl2·xH 2O)制备CuCl,其装置如下(加热仪器、夹持仪器省略)

回答下列问题:
(1)装有无水硫酸铜的仪器名称为______ ,装置 D 的作用是______ 。
(2)通入 HCl 气体的主要作用是______ 。
(3)实验过程中,装置C 中的现象为______ 。
(4)硬质玻璃管A 中发生主要反应的化学方程式为__________ 。
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=______ (精确到 0.1)。
②若加热时有固体溅出坩埚,则测得x 值______ 填“偏大”“不变”或“偏小”)。

回答下列问题:
(1)装有无水硫酸铜的仪器名称为
(2)通入 HCl 气体的主要作用是
(3)实验过程中,装置C 中的现象为
(4)硬质玻璃管A 中发生主要反应的化学方程式为
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=
②若加热时有固体溅出坩埚,则测得x 值
您最近一年使用:0次
2020-05-25更新
|
132次组卷
|
3卷引用:贵州省黔西南州兴义市义龙新区2021-2022高三上学期期末考试化学试题
解题方法
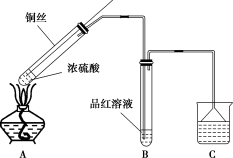
2 . 某同学用如图装置(夹持装置略)探究铜丝与过量浓硫酸的反应。
回答下列问题:
(1)铜与浓硫酸反应的化学方程式为___ 。
(2)B中观察到的现象为___ 。
(3)C中应加入的试剂为___ ,倒置漏斗的作用是___ 。
(4)与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是___ 。

回答下列问题:
(1)铜与浓硫酸反应的化学方程式为
(2)B中观察到的现象为
(3)C中应加入的试剂为
(4)与向浓硫酸中直接加入铜片相比,该装置用可上下移动的铜丝,优点是
您最近一年使用:0次
2021-05-26更新
|
264次组卷
|
4卷引用:贵州省黔西南州同源中学2021-2022学年高一下学期第一次月考化学试题
3 . 某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________ (填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
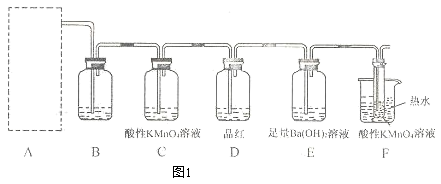
试回答下列问题:
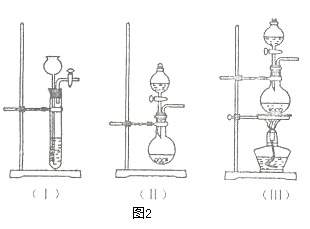
①图1的A中最好选用下列装置_________ (填编号);
②图1的 B装置所装试剂是_________ ;D装置中试剂的作用是_________ ;E装置中发生的现象是_________ ;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________ ,后体积膨胀的化学方程式为:_________ ;
④某学生按图进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________ ,其反应的离子方程式是_________ 。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置

②图1的 B装置所装试剂是
③图1的A装置中使蔗糖先变黑的化学反应方程式为
④某学生按图进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因
您最近一年使用:0次
2018-06-29更新
|
547次组卷
|
30卷引用:贵州省黔西南布依族苗族自治州册亨县第三中学2019-2020学年高二上学期期末考试化学试题
贵州省黔西南布依族苗族自治州册亨县第三中学2019-2020学年高二上学期期末考试化学试题云南省建水县民中2017-2018学年高二下学期6月份考试化学试题云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题贵州省毕节纳雍县一中2018-2019学年高二下学期期末考试化学试题云南省玉溪市通海县第三中学2019-2020学年高二上学期12月月考化学试题云南省红河哈尼族彝族自治州绿春县一中2019-2020学年高二上学期12月月考化学试题云南省大姚县一中2019-2020学年高二12月月考化学试题云南省永德县第一中学2019-2020学年高二12月月考化学试题贵州省麻江县第一中学2019-2020学年高二上学期期末考试化学试题云南省玉溪市江川区二中2019-2020学年高二上学期期末考试化学试题云南省陇川县民族中学2019-2020学年高二上学期期末考试化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题云南省普洱市景东县第二中学2019-2020学年高二上学期期末考试化学试题云南省巧家县第三中学2019-2020学年高二上学期期末考试化学试题云南省盐津县第三中学2019-2020学年高二上学期期末考试化学试题云南省昭通市水富县第二中学2019-2020学年高二上学期期末考试化学试题云南省丽江市永胜县第二中学2019—2020学年高二上学期期末考试化学试题云南省绥江县第三中学2019-2020学年高二上学期期末考试化学试题云南省昭通市巧家县第四中学2019-2020学年高二上学期期末考试化学试题云南省玉溪市元江民族中学2019-2020学年高二12月月考化学试题贵州省铜仁市沿河县第二高级中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市马龙区第二中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市沾益县第二中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市富源县第三中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市陆良县第十中学2019-2020学年高二上学期期末考试化学试题广西来宾市象州县中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区崇左市扶绥县第二中学2019-2020学年高二上学期期末考试化学试题广西来宾市忻城县高级中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区来宾市金秀县民族中学2019-2020学年高二上学期期末考试化学试题云南省施甸县第三中学2019-2020学年高二12月月考化学试题
4 . 某课外活动小组在实验室用下图所示的装置进行实验,验证氨的某些性质并收集少量纯净氮气。试回答:

(1)实验前先将仪器按图连接好,然后___________ ,再开始实验。
(2)实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成______ 色,盛无水CuSO4的干燥管内出现__________ 色,并在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,硬质试管中的反应方程式为____________ ,这个反应说明氨气具有___________ 性。
(3)洗气瓶中浓硫酸的主要作用是_______________ 。
(4)在最后出气管口收集干燥、纯净的氮气,收集方法是__________ (填编号)
A.向上排空气法 B.向下排空气法
C.排水法 D.用塑料袋或球胆收集

(1)实验前先将仪器按图连接好,然后
(2)实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成
(3)洗气瓶中浓硫酸的主要作用是
(4)在最后出气管口收集干燥、纯净的氮气,收集方法是
A.向上排空气法 B.向下排空气法
C.排水法 D.用塑料袋或球胆收集
您最近一年使用:0次
5 .  与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
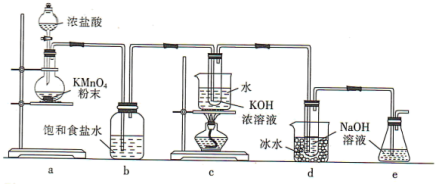
回答下列问题:
(1)a装置所用玻璃仪器的名称为______ (任意写一种);发生反应的离子方程式为____________ 。
(2)b装置的作用是____________ ;e装置的作用是____________ 。
(3)已知:c装置中得到的是 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。
①由此判断氯气与碱反应时,影响产物的因素有____________ 。
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时, 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为____________ 。
(4)取少量c、d装置中生成的 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显_______ 色。由此可推知,在碱性条件下, 的氧化能力
的氧化能力______ (填“>”或“<”)NaClO的氧化能力。
(5)该兴趣小组在40℃条件下,将一定量的 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为______ mol。
 与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
回答下列问题:
(1)a装置所用玻璃仪器的名称为
(2)b装置的作用是
(3)已知:c装置中得到的是
 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。①由此判断氯气与碱反应时,影响产物的因素有
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时,
 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为(4)取少量c、d装置中生成的
 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显 的氧化能力
的氧化能力(5)该兴趣小组在40℃条件下,将一定量的
 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为
您最近一年使用:0次
2022-07-12更新
|
113次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州2021-2022学年高二下学期期末质量检测化学试题



