1 . 某同学在实验室中设计两个关于NO的探究实验。
Ⅰ.工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,探究NO和NH3能否反应。
(1)氨气的制备
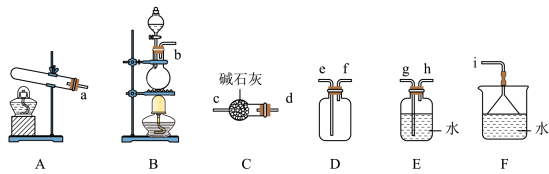
氨气的发生装置可以选择上图中的___________ 装置(填字母),实验室制备氨气反应的化学方程式为___________ 。
(2)将上述收集到的NH3加入少量催化剂,充入NO充分混合,冷却到室温,观察到管中有少量水珠,说明NO和NH3能反应,则氧化剂和还原剂的物质的量之比为___________ 。
Ⅱ.探究NO能否被Na2O2完全吸收,设计了如下实验。装置如图(加热装置省略):
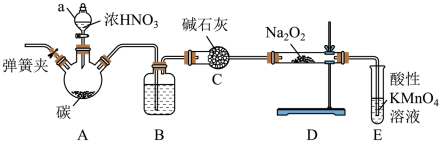
查阅资料知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成 。回答下列问题:
。回答下列问题:
(3)装有碱石灰的仪器名称:___________ 。
(4)B瓶内装的物质是___________ 。
(5)若NO能被Na2O2完全吸收,E装置中的现象为___________ 。
(6)三颈烧瓶A中反应的化学方程式为___________ 。
(7)C装置的作用是___________ 。
Ⅰ.工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,探究NO和NH3能否反应。
(1)氨气的制备

氨气的发生装置可以选择上图中的
(2)将上述收集到的NH3加入少量催化剂,充入NO充分混合,冷却到室温,观察到管中有少量水珠,说明NO和NH3能反应,则氧化剂和还原剂的物质的量之比为
Ⅱ.探究NO能否被Na2O2完全吸收,设计了如下实验。装置如图(加热装置省略):

查阅资料知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成
 。回答下列问题:
。回答下列问题:(3)装有碱石灰的仪器名称:
(4)B瓶内装的物质是
(5)若NO能被Na2O2完全吸收,E装置中的现象为
(6)三颈烧瓶A中反应的化学方程式为
(7)C装置的作用是
您最近一年使用:0次
2 . 铜仁一中某化学兴趣小组为了探究铜与浓硫酸的反应以及产物的性质,设计了如图所示装置进行实验。回答下列问题:

(1)若要使装置A中反应发生还缺少的实验仪器是_________ ,写出装置 中发生反应的化学反应方程式
中发生反应的化学反应方程式_________ 。
(2)装置 中现象变化是
中现象变化是_____________________________________ 。
(3)装置 中发生反应的化学方程式是
中发生反应的化学方程式是_________________ 。
(4)装置 中酒精灯的作用是
中酒精灯的作用是_____________________________ 。
另一个实验小组的同学认为 和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的
和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的 和
和 按
按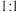 同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_____________________ 。
(5)尾气可采用_________ 溶液吸收。

(1)若要使装置A中反应发生还缺少的实验仪器是
 中发生反应的化学反应方程式
中发生反应的化学反应方程式(2)装置
 中现象变化是
中现象变化是(3)装置
 中发生反应的化学方程式是
中发生反应的化学方程式是(4)装置
 中酒精灯的作用是
中酒精灯的作用是另一个实验小组的同学认为
 和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的
和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的 和
和 按
按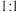 同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)(5)尾气可采用
您最近一年使用:0次
名校
解题方法
3 . 某同学根据Mg与 反应的原理推测Na也能在
反应的原理推测Na也能在 中燃烧,为了确定其产物,他设计了如图所示装置进行实验(已知
中燃烧,为了确定其产物,他设计了如图所示装置进行实验(已知 能被CO还原得到黑色的金属Pd)。
能被CO还原得到黑色的金属Pd)。
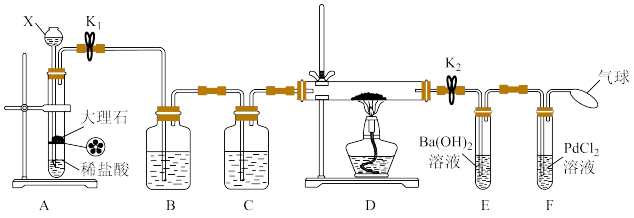
按如下顺序进行实验操作:
①打开 和
和 ,通入
,通入 待E中溶液变浑浊时,再点燃酒精灯;
待E中溶液变浑浊时,再点燃酒精灯;
②待金属钠完全燃烧后熄灭酒精灯,并冷却至室温;
③关闭 和
和 。
。
回答下列问题:
(1)仪器X的名称是___________ 。
(2)装置B中的试剂是___________ ,作用是___________ 。
(3)步骤①的目的是_______ ;若直接点燃酒精灯,反应中可能会生成一种淡黄色固体,写出这种固体与水反应的化学方程式:___________ 。
(4)点燃酒精灯后,观察到钠块表面变黑,熔融成金属小球,然后金属钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和白色固体(一种盐类物质)产生,一段时间后F中试管内壁也有黑色沉淀产生。
上述现象说明金属钠在 中燃烧的产物为
中燃烧的产物为___________ (填化学式);体现了金属钠的___________ (填物理性质)和___________ (填“氧化性”或“还原性”)。
 反应的原理推测Na也能在
反应的原理推测Na也能在 中燃烧,为了确定其产物,他设计了如图所示装置进行实验(已知
中燃烧,为了确定其产物,他设计了如图所示装置进行实验(已知 能被CO还原得到黑色的金属Pd)。
能被CO还原得到黑色的金属Pd)。
按如下顺序进行实验操作:
①打开
 和
和 ,通入
,通入 待E中溶液变浑浊时,再点燃酒精灯;
待E中溶液变浑浊时,再点燃酒精灯;②待金属钠完全燃烧后熄灭酒精灯,并冷却至室温;
③关闭
 和
和 。
。回答下列问题:
(1)仪器X的名称是
(2)装置B中的试剂是
(3)步骤①的目的是
(4)点燃酒精灯后,观察到钠块表面变黑,熔融成金属小球,然后金属钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和白色固体(一种盐类物质)产生,一段时间后F中试管内壁也有黑色沉淀产生。
上述现象说明金属钠在
 中燃烧的产物为
中燃烧的产物为
您最近一年使用:0次
解题方法
4 . 为探究铜与稀硝酸反应的气体产物及亚硝酸对其反应速率的影响,进行如下实验。
实验一 探究铜与稀硝酸反应的气体产物实验装置如图所示,气密性已检查。

已知: ,该反应较缓慢,待生成一定量
,该反应较缓慢,待生成一定量 时突显明显棕色。
时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是___________ 。
(2)若装置 A中有 NO2气体生成,则装置 B中的实验现象为___________ 。
(3)若装置A中铜与稀硝酸反应只生成 NO气体,写出该反应的离子方程式___________ ,装置B中的实验现象为___________ 。
实验二 实验一的过程中发现铜与稀硝酸反应比较慢,A中产生无色气体。查阅文献得知铜与浓 HNO3反应一旦发生就变快,是因为开始生成的 NO2溶于水形成 HNO2(弱酸,不稳定),使反应加快。为了探究 HNO2对铜与稀硝酸反应速率的影响,采用实验一的实验装置和操作,设计了如下实验。
(4)已知NO2与 H2O反应生成 HNO2和另一种常见的强酸,写出其反应的化学方程式___________ 。
(5)上述实验②中加入1.0g NaNO2固体的作用是___________ 。
(6)实验测得 t1>t2,可得出的结论是___________ 。
实验一 探究铜与稀硝酸反应的气体产物实验装置如图所示,气密性已检查。

已知:
 ,该反应较缓慢,待生成一定量
,该反应较缓慢,待生成一定量 时突显明显棕色。
时突显明显棕色。(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是
(2)若装置 A中有 NO2气体生成,则装置 B中的实验现象为
(3)若装置A中铜与稀硝酸反应只生成 NO气体,写出该反应的离子方程式
实验二 实验一的过程中发现铜与稀硝酸反应比较慢,A中产生无色气体。查阅文献得知铜与浓 HNO3反应一旦发生就变快,是因为开始生成的 NO2溶于水形成 HNO2(弱酸,不稳定),使反应加快。为了探究 HNO2对铜与稀硝酸反应速率的影响,采用实验一的实验装置和操作,设计了如下实验。
| 实验序号 | 温度(℃) | 6mol/L硝酸(mL) | 铜片(g) | NaNO2(g) | B中溶液变色的时间(s) |
| ① | 25 | 20 | 5 | 0 | t1 |
| ② | 25 | 20 | 5 | 1.0 | t2 |
(5)上述实验②中加入1.0g NaNO2固体的作用是
(6)实验测得 t1>t2,可得出的结论是
您最近一年使用:0次
2021-03-04更新
|
754次组卷
|
5卷引用:贵州省思南县梵净山中学2022-2023学年高三上学期11月月考化学试题
贵州省思南县梵净山中学2022-2023学年高三上学期11月月考化学试题广东省梅州市2021届高三一模化学试卷广东省梅州市2021届高三下学期3月总复习质检化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)
5 . 草酸亚铁晶体( FeC2O4·2H2O)是一种淡黄色粉末,可用作照相显影剂。某课外小组利用如下实验装置对草酸亚铁晶体分解产物进行探究,并设计实验测定草酸亚铁晶体样品纯度。
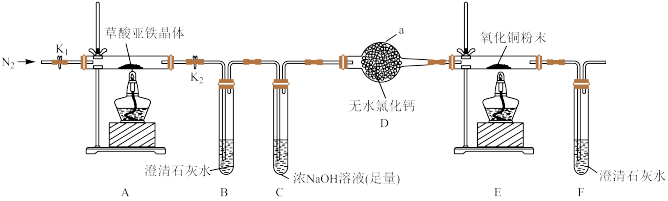
回答下列问题:
(1)仪器a的名称为_____ ;装置B中澄清石灰水变浑浊,说明气体分解产物中含有_____ ;
(2)实验前先通一段时间N2目的是________ ;装置C中浓NaOH溶液的作用是______ ;
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是______ ;
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是______ (填化学式);根据上述实验现象写出草酸亚铁晶体分解的化学方程式_______ ;
(5)所给实验装置存在明显的设计缺陷,该缺陷是______ ;
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为________ (已知该草酸亚铁晶体样品中不含其他与高锰酸钾反应的还原性杂质)。

回答下列问题:
(1)仪器a的名称为
(2)实验前先通一段时间N2目的是
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是
(5)所给实验装置存在明显的设计缺陷,该缺陷是
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为
您最近一年使用:0次
6 . 某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________ (填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
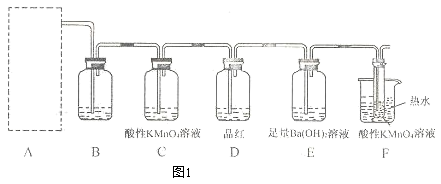
试回答下列问题:
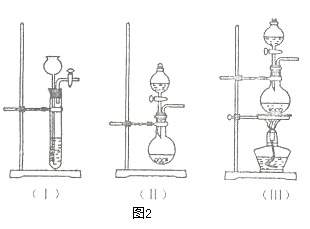
①图1的A中最好选用下列装置_________ (填编号);
②图1的 B装置所装试剂是_________ ;D装置中试剂的作用是_________ ;E装置中发生的现象是_________ ;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________ ,后体积膨胀的化学方程式为:_________ ;
④某学生按图进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________ ,其反应的离子方程式是_________ 。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置

②图1的 B装置所装试剂是
③图1的A装置中使蔗糖先变黑的化学反应方程式为
④某学生按图进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因
您最近一年使用:0次
2018-06-29更新
|
547次组卷
|
30卷引用:贵州省铜仁市沿河县第二高级中学2019-2020学年高二上学期期末考试化学试题
贵州省铜仁市沿河县第二高级中学2019-2020学年高二上学期期末考试化学试题云南省建水县民中2017-2018学年高二下学期6月份考试化学试题云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题贵州省毕节纳雍县一中2018-2019学年高二下学期期末考试化学试题云南省玉溪市通海县第三中学2019-2020学年高二上学期12月月考化学试题云南省红河哈尼族彝族自治州绿春县一中2019-2020学年高二上学期12月月考化学试题云南省大姚县一中2019-2020学年高二12月月考化学试题云南省永德县第一中学2019-2020学年高二12月月考化学试题贵州省麻江县第一中学2019-2020学年高二上学期期末考试化学试题云南省玉溪市江川区二中2019-2020学年高二上学期期末考试化学试题云南省陇川县民族中学2019-2020学年高二上学期期末考试化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题云南省普洱市景东县第二中学2019-2020学年高二上学期期末考试化学试题云南省巧家县第三中学2019-2020学年高二上学期期末考试化学试题云南省盐津县第三中学2019-2020学年高二上学期期末考试化学试题云南省昭通市水富县第二中学2019-2020学年高二上学期期末考试化学试题云南省丽江市永胜县第二中学2019—2020学年高二上学期期末考试化学试题云南省绥江县第三中学2019-2020学年高二上学期期末考试化学试题云南省昭通市巧家县第四中学2019-2020学年高二上学期期末考试化学试题云南省玉溪市元江民族中学2019-2020学年高二12月月考化学试题贵州省黔西南布依族苗族自治州册亨县第三中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市马龙区第二中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市沾益县第二中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市富源县第三中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市陆良县第十中学2019-2020学年高二上学期期末考试化学试题广西来宾市象州县中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区崇左市扶绥县第二中学2019-2020学年高二上学期期末考试化学试题广西来宾市忻城县高级中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区来宾市金秀县民族中学2019-2020学年高二上学期期末考试化学试题云南省施甸县第三中学2019-2020学年高二12月月考化学试题
7 . 某化学课外小组设计了如下图(铁架台均已略去)所示的实验装置,进行气体性质实验。图中用箭头表示气体流向,A表示一种纯净、干燥的气体,B表示另一种气体。反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。根据图中装置和反应现象请回答:

(1)丙中发生反应的化学方程式为________________________________ 。
(2)丁中的干燥剂应选_______ ,不选另一种干燥剂的理由是___________ 。
(3)甲中发生反应的化学方程式为______________________________________ 。
(4)戊中发生的主要反应的化学方程式为_________________________ ,此反应是(吸热、放热)_______ 反应,可能发生的什么现象可以证明你的判断________ 。

(1)丙中发生反应的化学方程式为
(2)丁中的干燥剂应选
(3)甲中发生反应的化学方程式为
(4)戊中发生的主要反应的化学方程式为
您最近一年使用:0次
8 . 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。制备装置如下图所示:(其中Ⅲ、Ⅳ、Ⅴ中都为浓硫酸)
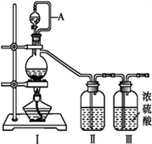
(1)用同一装置Ⅰ、Ⅱ、III分别制备纯净干燥的NO和Cl2,下表中缺少的药品是:
(2)A的作用____________________________ 。
(3)NOCl的电子式_________ 。
(4)利用制得的NO和Cl2制备NOCl,方程式:2NO + Cl2= 2NOCl;装置如上图所示:
①装置连接顺序为a→________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________ 。
③装置Ⅷ中吸收尾气时,Cl2发生反应的离子方程式为________________ 。
(5)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气,该反应的化学方程式为__________________ 。


(1)用同一装置Ⅰ、Ⅱ、III分别制备纯净干燥的NO和Cl2,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | 浓盐酸 | ① |
| 制备纯净NO | Cu | ② | 水 |
(3)NOCl的电子式
(4)利用制得的NO和Cl2制备NOCl,方程式:2NO + Cl2= 2NOCl;装置如上图所示:
①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③装置Ⅷ中吸收尾气时,Cl2发生反应的离子方程式为
(5)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
名校
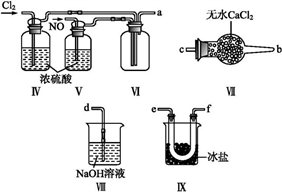
9 . Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
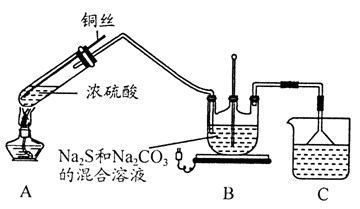
(1)A中发生的化学反应方程式为____________ 。
(2)C中所盛试剂可能是______ ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是_______ 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是___________ ;该生用如下实验进一步验证黑色物质的组成:
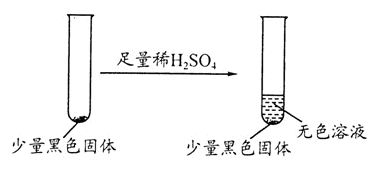
基于上述假设分析,黑色物质的组成为_____________ (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式______________ ;
②以淀粉为指示剂,则到达滴定终点的现象是_______________ ;
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为___ 。
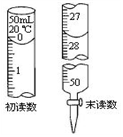
 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为
(2)C中所盛试剂可能是
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是

基于上述假设分析,黑色物质的组成为
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式
②以淀粉为指示剂,则到达滴定终点的现象是
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为

您最近一年使用:0次
2016-12-09更新
|
1246次组卷
|
3卷引用:贵州省思南中学2016-2017学年高二下学期期末考试化学试题



