1 . 某小组同学分别探究 溶液、
溶液、 溶液的性质。
溶液的性质。
Ⅰ.探究 溶液的性质。
溶液的性质。
(1)预测 具有氧化性,因此可以与Zn反应,此时Zn体现
具有氧化性,因此可以与Zn反应,此时Zn体现______ 性。
(2)预测 具有还原性,预测依据是
具有还原性,预测依据是______ ,因此可以与酸性 溶液反应。
溶液反应。
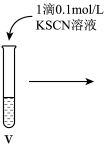
(3)进行如下实验操作:
①i中的现象是产生白色沉淀,变为灰绿色,最终为红褐色,用化学方程式表示产生该现象的原因: 、
、______ 。
②iii中的现象是______ 。
(4)某同学认为 中现象并不能证明
中现象并不能证明 具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中
具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中 确实被氧化,需要在反应后的溶液中加入试剂
确实被氧化,需要在反应后的溶液中加入试剂______ ,观察到现象______ 。
Ⅱ.探究 溶液的性质。
溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
(5)ⅳ中反应的离子方程式是______ 。
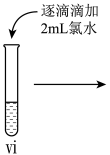
(6)vi中滴加氯水过程中,氯水反应的离子方程式是______ 。
Ⅲ.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被转化,b.被转化。
(7)进一步预测 可能被转化为
可能被转化为 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象______ 。
 溶液、
溶液、 溶液的性质。
溶液的性质。Ⅰ.探究
 溶液的性质。
溶液的性质。(1)预测
 具有氧化性,因此可以与Zn反应,此时Zn体现
具有氧化性,因此可以与Zn反应,此时Zn体现(2)预测
 具有还原性,预测依据是
具有还原性,预测依据是 溶液反应。
溶液反应。(3)进行如下实验操作:
 | 序号 | 操作 |
i | 滴加 | |
iii | 加入少量锌粉 | |
iii | 滴加酸性 |
 、
、②iii中的现象是
(4)某同学认为
 中现象并不能证明
中现象并不能证明 具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中
具有还原性,他的理由有二:①将酸性高锰酸钾稀释也可能产生该现象,②为证实该反应中 确实被氧化,需要在反应后的溶液中加入试剂
确实被氧化,需要在反应后的溶液中加入试剂Ⅱ.探究
 溶液的性质。
溶液的性质。小组同学进行如下实验操作并观察到对应现象:
操作 |
|
|
|
现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色,而后红色褪去 |
(5)ⅳ中反应的离子方程式是
(6)vi中滴加氯水过程中,氯水反应的离子方程式是
Ⅲ.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被转化,b.被转化。
(7)进一步预测
 可能被转化为
可能被转化为 ,通过实验验证了该预测,写出实验操作及现象
,通过实验验证了该预测,写出实验操作及现象
您最近一年使用:0次
2 . 室温下,下列关于铁化合物的实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向 和 和 的混合溶液中滴入酸化的 的混合溶液中滴入酸化的 溶液振荡,观察溶液颜色的变化 溶液振荡,观察溶液颜色的变化 | 比较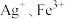 氧化性的强弱 氧化性的强弱 |
| B | 用 还原 还原 ,所得到的产物中加入稀盐酸,滴加 ,所得到的产物中加入稀盐酸,滴加 溶液,观察颜色变化 溶液,观察颜色变化 |  是否已全部被还原 是否已全部被还原 |
| C | 向 溶液中加入几滴氯水,振荡,再加 溶液中加入几滴氯水,振荡,再加 萃取,观察 萃取,观察 层颜色变化 层颜色变化 | 比较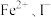 还原性的强弱 还原性的强弱 |
| D | 将铁锈溶于浓盐酸中再向溶液中滴入几滴 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 铁锈中是否含有二价铁 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 向10.00mL0.50mol•L-1NaHCO3溶液中滴加不同浓度的CaCl2溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法正确的是
| 实验 | 序号 | c(CaCl2)/(mol•L-1) | 滴加CaCl2溶液时的实验现象 | 加热浑浊液时的实验现象 |
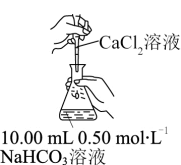 | ① | 0.05 | 至1.32mL时产生明显浑浊,但无气泡产生 | 有较多气泡生成 |
| ② | 0.005 | 至15.60 mL时产生明显浑浊,但无气泡产生 | 有少量气泡生成 | |
| ③ | 0.0005 | 至20mL未见浑浊 |
A.①中产生浑浊的原因是c(Ca2+)•c(CO )<Ksp(CaCO3) )<Ksp(CaCO3) |
B.未加热前①和②中发生了反应:2HCO +Ca2+=CaCO3↓+H2CO3 +Ca2+=CaCO3↓+H2CO3 |
| C.加热浑浊液产生气泡主要是因为CaCO3受热分解产生了更多的CO2 |
| D.向上述NaHCO3溶液中逐滴滴加0.5mol•L-1CaCl2溶液,一定会同时产生浑浊和气泡 |
您最近一年使用:0次
4 .  发生催化氧化反应生成
发生催化氧化反应生成 ,强碱条件下能被
,强碱条件下能被 氧化生成
氧化生成 ;
; 可被
可被 继续氧化生成
继续氧化生成 ,也可被
,也可被 氧化生成
氧化生成 ,
, 能与
能与 溶液反应产生银镜;
溶液反应产生银镜; 是一种弱酸,酸性与醋酸相当。下列有关含氮化合物的性质与制备说法正确的是
是一种弱酸,酸性与醋酸相当。下列有关含氮化合物的性质与制备说法正确的是
 发生催化氧化反应生成
发生催化氧化反应生成 ,强碱条件下能被
,强碱条件下能被 氧化生成
氧化生成 ;
; 可被
可被 继续氧化生成
继续氧化生成 ,也可被
,也可被 氧化生成
氧化生成 ,
, 能与
能与 溶液反应产生银镜;
溶液反应产生银镜; 是一种弱酸,酸性与醋酸相当。下列有关含氮化合物的性质与制备说法正确的是
是一种弱酸,酸性与醋酸相当。下列有关含氮化合物的性质与制备说法正确的是A.分析结构可推得, 难溶于水 难溶于水 |
B.分析结构可推得,相同条件下 还原性应强于 还原性应强于 |
C.制备 时应将 时应将 慢慢通入 慢慢通入 溶液中 溶液中 |
D.可向 溶液中通 溶液中通 来制备 来制备 |
您最近一年使用:0次
2022-08-04更新
|
703次组卷
|
3卷引用:江苏省泰州中学2022-2023学年高二5月检测化学试题
名校
5 . 为了探究溶有 的
的 溶液的性质,某实验小组设计了如下实验:
溶液的性质,某实验小组设计了如下实验:
下列推断正确的是
 的
的 溶液的性质,某实验小组设计了如下实验:
溶液的性质,某实验小组设计了如下实验:| 装置 | 实验 | 试剂W | 部分实验现象 |
 | ① |  溶液 溶液 | 溶液中产生白色沉淀 |
| ② | 烧碱溶液 | 溶液中产生白色沉淀 | |
| ③ | 含 的淀粉溶液 的淀粉溶液 | 蓝色溶液变为无色 | |
| ④ |  溶液 溶液 | 溶液变浑浊 |
A.实验①中仅发生反应: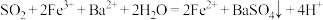 |
| B.实验②中产生的白色沉淀难溶于盐酸 |
C.由实验③可推知,还原性: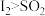 |
| D.实验④中因生成了S而使溶液变浑浊 |
您最近一年使用:0次
2022-03-22更新
|
480次组卷
|
3卷引用:江苏省泰州中学2021-2022学年高一下学期第一次月考检测化学试题
江苏省泰州中学2021-2022学年高一下学期第一次月考检测化学试题(已下线)2022年湖南卷高考真题变式题(11-14)江苏省南通市通州区金沙中学2022-2023学年高一下学期3月质量监测化学试题
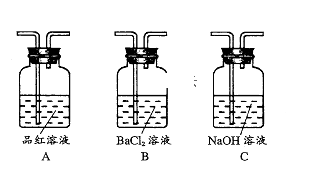
6 . 用如图所示装置进行Fe与水蒸气反应的实验(部分夹持装置已略去),下列有关说法不正确的是( )
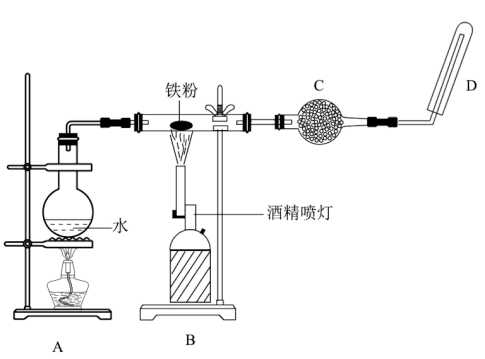

| A.装置A的作用是为实验提供持续不断的水蒸气 |
B.装置B中发生反应的化学方程式是 |
| C.装置C中加入的固体干燥剂可能是碱石灰 |
| D.点燃装置D处的气体前必须检验气体的纯度 |
您最近一年使用:0次
2020-09-23更新
|
2160次组卷
|
26卷引用:江苏省泰州中学2021-2022学年高一上学期第二次月度检测化学试题
江苏省泰州中学2021-2022学年高一上学期第二次月度检测化学试题【全国百强校】北京市第四中学2018-2019学年高一上学期期末考试化学试题北京市北京师范大学附属中学2019-2020学年高一上学期期末考试化学试题辽宁省本溪市2019-2020学年高一下学期寒假验收考试化学试题(已下线)3.1.1 铁的单质 铁的氧化物练习(2)——《高中新教材同步备课》(人教版 必修第一册)湖北省武汉外国语学校2019-2020学年高一上学期期末考试化学试题高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 教材帮广东省东莞市七校2020-2021学年高一上学期联考化学试题黑龙江省大兴安岭呼玛县高级中学2020-2021学年高一上学期第三次月考化学试题吉林省通化市职教中心高中部2020-2021学年高一12月月考化学试题甘肃省兰州市第一中学2020-2021学年高一上学期期末考试化学(文)试题浙江省温州新力量联盟2020-2021学年高一下学期期中联考化学试题(已下线)课时17 铁及其化合物-2022年高考化学一轮复习小题多维练(全国通用)内蒙古赤峰市2020-2021学年高一下学期期末联考化学试题(已下线)新人教必修1第3章第一节第1课时铁的单质(课中)北京市顺义区2021-2022学年高一上学期期末考试化学试题吉林省梅河口市第五中学2021-2022学年高一上学期期中考试化学试题吉林省长春市第二中学2021-2022学年高一上学期期末化学试题(已下线)3.1.1铁及其化合物-同步学习必备知识云南省玉溪市江川区第二中学2021-2022学年高一上学期12月考试化学试题(已下线)题型27 铁及其化合物的性质、用途及相关计算广东省江门开平市忠源纪念中学2021-2022学年高一下学期期中考试化学(合格性)试题河南省驻马店市新蔡县第一高级中学2022-2023学年高三上学期11月月考化学试题北京理工大学附属中学2023-2024学年高一上学期12月阶段练习化学试题云南省腾冲市第八中学2023-2024学年高一上学期第四次月考化学试卷
名校
解题方法
7 . 为探究Na2O2与H2O的反应,进行了如下实验:有关说法不正确 的是( )

| A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑ |
| B.实验ⅲ中MnO2做H2O2分解反应的催化剂 |
| C.综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成 |
| D.综合实验表明,实验ⅱ酚酞褪色的原因是溶液碱性变弱 |
您最近一年使用:0次
2020-09-10更新
|
1490次组卷
|
18卷引用:江苏省泰州中学2021-2022学年高一上学期期末考试化学试题
江苏省泰州中学2021-2022学年高一上学期期末考试化学试题北京市延庆区2021届高三上学期统测(9月)考试化学试题山东省德州市齐河县实验中学2021届高三第一次月考化学试题吉林省大安市第一中学校2021届高三上学期第二次月考化学试题北京市第十二中学2020-2021学年高一上学期期中考试化学试题黑龙江省鸡西市第一中学2020-2021学年高一上学期第一次月考化学试题北京市第二十中学2021-2022学年高一上学期期中考试化学试题北京市东直门中学2021-2022学年高一上学期期中考试化学试题广东省佛山市第一中学2021-2022学年高一上学期期中考试化学试题吉林省长春市十一高中2021-2022学年高一上学期第二学程考试化学试卷(已下线)2.1.2 钠的氧化物与焰色试验-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)河北省石家庄市第十五中学2022-2023学年高一上学期期中考试化学试题四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题广东省深圳市福田区红岭中学2022-2023学年高一上学期第二学段期末考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第二单元03巩固练江苏省前黄高级中学2022-2023学年高一下学期综合素质测试化学试题(已下线)专题05 金属钠及钠的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)(已下线)综合期末压轴85+18题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)
解题方法
8 . 某化学小组欲探究NO 的氧化性及其还原产物。
的氧化性及其还原产物。
(1)提出问题
甲同学认为只有溶液中同时存在H+时,NO 才有氧化性;
才有氧化性;
乙同学不赞成甲同学观点,他认为NO 自身就具有氧化性,依据是
自身就具有氧化性,依据是__________
(2)实验探究:小组同学为解决上述争论,设计并进行了以下实验
①实验I中反应的离子方程式为_________ 。
②实验Ⅱ滴加两滴蒸馏水的目的是__________ ,产生的无色气泡为___________
③实验Ⅲ反应后静置,取上层清液,滴加稀盐酸,先产生白色浑浊,后又消失。则实验Ⅲ中反应的离子方程式为__________ 。
(3)实验结论:由实验I、Ⅱ、Ⅲ可得出的结论是________ 。
 的氧化性及其还原产物。
的氧化性及其还原产物。(1)提出问题
甲同学认为只有溶液中同时存在H+时,NO
 才有氧化性;
才有氧化性;乙同学不赞成甲同学观点,他认为NO
 自身就具有氧化性,依据是
自身就具有氧化性,依据是(2)实验探究:小组同学为解决上述争论,设计并进行了以下实验
| 实验I | 实验Ⅱ | 实验Ⅲ | |
| 操作 |  | 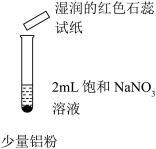 | 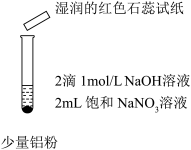 |
| 现象 | 微热,产生无色气泡,至液面上方变为浅红棕色。用拇指堵住试管口片刻,靠近酒精灯火焰,没有爆鸣声。 | 微热,产生无色气泡,湿润的红色石蕊试纸变蓝。用拇指堵住试管口片刻,靠近酒精灯火焰,没有爆鸣声。 | 微热,产生无色气泡,湿润的红色石蕊试纸变蓝。用拇指堵住试管口片刻,靠近酒精灯火焰,没有爆鸣声。 |
①实验I中反应的离子方程式为
②实验Ⅱ滴加两滴蒸馏水的目的是
③实验Ⅲ反应后静置,取上层清液,滴加稀盐酸,先产生白色浑浊,后又消失。则实验Ⅲ中反应的离子方程式为
(3)实验结论:由实验I、Ⅱ、Ⅲ可得出的结论是
您最近一年使用:0次
9 . 工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4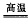 Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
(1)检验产物Fe2O3取少量FeSO4高温分解得到的固体,加入一定量__________ 溶解,再向该溶液中加入适量的__________ 溶液,如有____________ 现象产生,则证明产物中存在Fe2O3
(2)检验气体产物:将FeSO4高温分解产生的气体通入下图三个装置中,以检验产生的气体中是否含有SO2、SO3。
①三个装量的连接序为_______________ (填装置序号)
②实验中如观察到装置A中品红溶液______ ,装置B BaCl2溶液中__________ ,则可证明FeSO4高温分解产生的气体中含有SO2、SO3。
③装置C中NaOH溶液的作用是_______________ (用离子方程式表示〕。
 Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验(1)检验产物Fe2O3取少量FeSO4高温分解得到的固体,加入一定量
(2)检验气体产物:将FeSO4高温分解产生的气体通入下图三个装置中,以检验产生的气体中是否含有SO2、SO3。
①三个装量的连接序为
②实验中如观察到装置A中品红溶液
③装置C中NaOH溶液的作用是

您最近一年使用:0次
名校
解题方法
10 . 某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如下页图所示:
(1)工业制乙烯的实验原理是,烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷烃发生如下反应,反应式已配平:C16H34 C8H18+甲 甲
C8H18+甲 甲 4乙
4乙
甲的分子式为________ ;乙的结构简式为________ 。
(2)B装置中实验现象可能是________ ,写出化学方程式:________________________ ;反应类型是________ 。
(3)C装置的现象是____________ ,反应类型是____________ 。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应生成二氧化碳。根据本实验中装置________ (填序号)实验现象判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定B装置里溶液反应前后的pH,简述理由:__________________________ 。
(5)通过上述实验探究,检验甲烷和乙烯的方法是__________________ (填序号,下同);除去甲烷中乙烯的方法是_______ 。
A.气体通入水中
B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液

(1)工业制乙烯的实验原理是,烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷烃发生如下反应,反应式已配平:C16H34
 C8H18+甲 甲
C8H18+甲 甲 4乙
4乙甲的分子式为
(2)B装置中实验现象可能是
(3)C装置的现象是
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应生成二氧化碳。根据本实验中装置
(5)通过上述实验探究,检验甲烷和乙烯的方法是
A.气体通入水中
B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
您最近一年使用:0次
2018-05-01更新
|
480次组卷
|
6卷引用:江苏省泰州中学2016-2017学年高一5月月度检测化学试题
江苏省泰州中学2016-2017学年高一5月月度检测化学试题湖南省衡阳市第八中学2016-2017学年高一理科实验班下学期结业(期末)理综化学试题2017-2018学年高一化学人教版必修2:第三章检测题【全国校级联考】湖北省部分重点中学2017-2018学年高二下学期期中考试化学试题(已下线)2019年4月28日 《每日一题》 必修2 每周一测(已下线)【南昌新东方】2019 南昌一中 高一下第二次月考

 溶液
溶液