名校
1 . 探究硫元素单质及其化合物的性质,下列实验方案能达到探究目的的是
| 选项 | 探究目的 | 实验方案 |
| A | SO2是否具有漂白性 | 将SO2通入酸性KMnO4溶液中,溶液褪色 |
| B | SO2是否具有氧化性 | 将SO2通入Na2S溶液中,产生淡黄色沉淀 |
| C | Na2SO3溶液是否变质 | 向Na2SO3溶液中加入盐酸酸化的Ba(NO3)2溶液,产生白色沉淀 |
| D | S与C的非金属性强弱 | 将SO2通入饱和NaHCO3溶液中,产生使澄清石灰水变浑浊的气体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 已知氨可以与灼热的氧化铜反应生成氮气和金属铜,用下面示意图中的装置可以实现该反应。
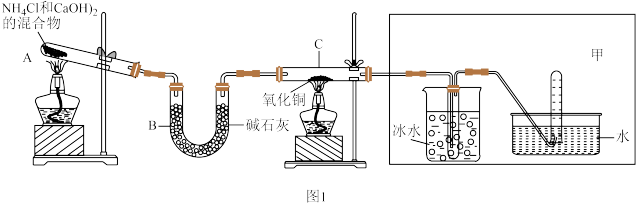
试回答下列问题:
(1)请写出A中反应的化学方程式为_______ 。
(2)装置B的作用是_______ ,碱石灰_______ (填“可以”或“不可以”)用无水CaCl2替代,请说出原因_______ 。
(3)请写出C中反应的化学方程式为_______ ,该反应中氧化剂和还原剂的物质的量之比为_______ 。
(4)若将图1甲区域中的装置换成图2装置,回答下列问题:

①实验进行一段时间后,装置D 中的现象为_______ 。
②装置E中的浓H2SO4的作用是_______ ,_______ 。

试回答下列问题:
(1)请写出A中反应的化学方程式为
(2)装置B的作用是
(3)请写出C中反应的化学方程式为
(4)若将图1甲区域中的装置换成图2装置,回答下列问题:

①实验进行一段时间后,装置D 中的现象为
②装置E中的浓H2SO4的作用是
您最近一年使用:0次
名校
解题方法
3 . 金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似。从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的流程如图所示:
请回答下列问题。
(1)“酸浸”过程中禁止明火加热,原因是___________ 。
(2)“结晶”过程中得到 的具体操作为
的具体操作为___________ 。
(3)“中和沉淀”过程中pH应调节的范围为___________ 。
(4)“碳酸化”过程中不能通入过量 的原因为
的原因为___________ (用离子方程式表示)。
(5)下列说法中不正确的是___________(填字母)。
(6)GaN具有优异的光电性能。工业上常采用在1100℃条件下,利用Ga与 反应可制备GaN,该过程的化学方程式为
反应可制备GaN,该过程的化学方程式为___________ 。

| 金属离子 |  |  |  |  |
开始沉淀时 的pH 的pH | 4.5 | 3.7 | 2.2 | 7.5 |
沉淀完全时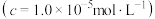 的pH 的pH | 5.5 | 4.7 | 3.2 | 9.0 |
(1)“酸浸”过程中禁止明火加热,原因是
(2)“结晶”过程中得到
 的具体操作为
的具体操作为(3)“中和沉淀”过程中pH应调节的范围为
(4)“碳酸化”过程中不能通入过量
 的原因为
的原因为(5)下列说法中不正确的是___________(填字母)。
| A.为提高浸出率,可将刚玉渣研磨 |
B.“结晶”过程中得到的 可作为净水剂 可作为净水剂 |
C.由流程图可知酸性: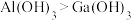 |
| D.“碱浸”过程中可用氨水代替NaOH溶液 |
 反应可制备GaN,该过程的化学方程式为
反应可制备GaN,该过程的化学方程式为
您最近一年使用:0次
2023-07-10更新
|
311次组卷
|
3卷引用:江苏省淮阴中学2022-2023学年高一下学期6月阶段测试化学试题
江苏省淮阴中学2022-2023学年高一下学期6月阶段测试化学试题江苏省昆山中学2022-2023学年高一下学期6月阶段测试化学试题(已下线)综合期末压轴85+18题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)
解题方法
4 . 为探究 的性质,采用下列实验装置制少量
的性质,采用下列实验装置制少量 并进行相应的实验探究:
并进行相应的实验探究:
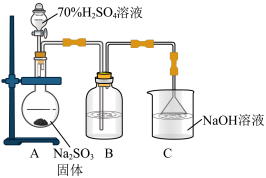
(1)装置A中盛放浓硫酸的仪器名称是___________ 。
(2)若B中的试剂是品红溶液,B中溶液红色褪去, 表现的性质
表现的性质___________ 。
(3)若B中的试剂是酸性 溶液,则B中的现象是
溶液,则B中的现象是___________ ,写出反应的离子方程式( 被还原为
被还原为 )
)___________ 。
(4)装置C中倒置漏斗的作用是___________ ,反应的离子方程式为___________ 。
(5)已知: 可还原某含碲物质(主要成分为
可还原某含碲物质(主要成分为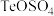 )溶液可得到粗碲。具体实验操作为:取该溶液于烧瓶中,加入适量
)溶液可得到粗碲。具体实验操作为:取该溶液于烧瓶中,加入适量 ,加热到一定温度,持续通入
,加热到一定温度,持续通入 ,待反应一定时间,过滤得到粗碲。在一定条件下,碲沉淀率与温度、还原时间的变化曲线分别如图1、图2所示:
,待反应一定时间,过滤得到粗碲。在一定条件下,碲沉淀率与温度、还原时间的变化曲线分别如图1、图2所示:
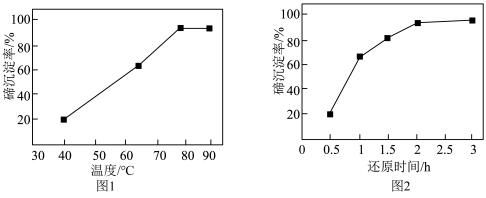
①由图可知,最适宜的温度和还原时间分别为___________ 。
②图1中80℃后,升高温度,碲沉淀率几乎不再升高,甚至有下降趋势。可能的原因是________ 。
 的性质,采用下列实验装置制少量
的性质,采用下列实验装置制少量 并进行相应的实验探究:
并进行相应的实验探究:
(1)装置A中盛放浓硫酸的仪器名称是
(2)若B中的试剂是品红溶液,B中溶液红色褪去,
 表现的性质
表现的性质(3)若B中的试剂是酸性
 溶液,则B中的现象是
溶液,则B中的现象是 被还原为
被还原为 )
)(4)装置C中倒置漏斗的作用是
(5)已知:
 可还原某含碲物质(主要成分为
可还原某含碲物质(主要成分为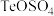 )溶液可得到粗碲。具体实验操作为:取该溶液于烧瓶中,加入适量
)溶液可得到粗碲。具体实验操作为:取该溶液于烧瓶中,加入适量 ,加热到一定温度,持续通入
,加热到一定温度,持续通入 ,待反应一定时间,过滤得到粗碲。在一定条件下,碲沉淀率与温度、还原时间的变化曲线分别如图1、图2所示:
,待反应一定时间,过滤得到粗碲。在一定条件下,碲沉淀率与温度、还原时间的变化曲线分别如图1、图2所示:
①由图可知,最适宜的温度和还原时间分别为
②图1中80℃后,升高温度,碲沉淀率几乎不再升高,甚至有下降趋势。可能的原因是
您最近一年使用:0次
5 . SO2在生活、生产中有重要用途,使用不当会造成环境污染。
(1)某同学利用图所示装置研究二氧化硫的性质。
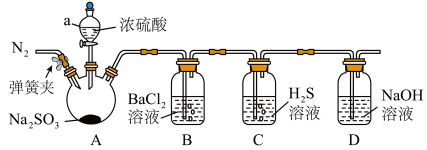
①仪器a的名称为___________ 。
②向仪器a中滴加浓硫酸之前,需先通入一段时间N2,此操作的目的是___________ 。
③实验时,装置B中没有明显变化。实验结束后取下装置B,向其中滴加适量氨水,生成的白色沉淀为___________ (填化学式)。
④装置C中出现淡黄色浑浊,说明二氧化硫具有___________ 性。
(2)某化工厂用图所示工艺流程除去燃煤产生的SO2。
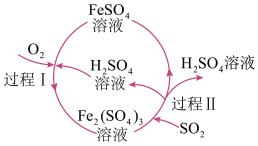
①过程I发生的反应为 ,用双线桥标出该反应电子转移的方向和数目
,用双线桥标出该反应电子转移的方向和数目___________ 。
②过程Ⅱ发生反应的化学方程式为___________ 。
(1)某同学利用图所示装置研究二氧化硫的性质。

①仪器a的名称为
②向仪器a中滴加浓硫酸之前,需先通入一段时间N2,此操作的目的是
③实验时,装置B中没有明显变化。实验结束后取下装置B,向其中滴加适量氨水,生成的白色沉淀为
④装置C中出现淡黄色浑浊,说明二氧化硫具有
(2)某化工厂用图所示工艺流程除去燃煤产生的SO2。

①过程I发生的反应为
 ,用双线桥标出该反应电子转移的方向和数目
,用双线桥标出该反应电子转移的方向和数目②过程Ⅱ发生反应的化学方程式为
您最近一年使用:0次
6 . 某化学实验小组对CO还原CuO的固体产物进行探究,装置如下图所示。
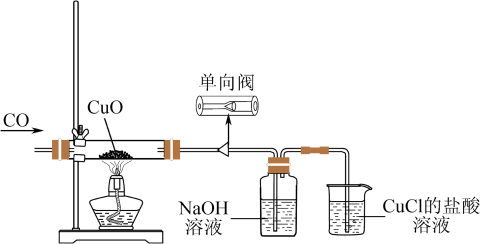
查阅资料:
I.CO还原CuO的温度需要控制在500℃以上;
II.CuO在高温下可分解生成红色Cu2O。
(1)CO还原CuO制得Cu的化学方程式是_______ 。
(2)单向阀的作用是_______ 。
(3)尾气通入CuCl盐酸溶液的目的是_______ 。
(4)为探究还原后的红色固体产物Cu中是否含有Cu2O,设计方案如下:
步骤1:准确称取1.50g固体产物,加适当过量的稀硫酸和双氧水使固体全部溶解,此时固体产物中的铜元素完全转化为Cu2+。
步骤2:微热,除去过量的过氧化氢,加水稀释成250.00mL溶液。
步骤3:取25.00mL溶液于锥形瓶中,加入适当过量的KI溶液,滴加少量淀粉溶液,再滴加0.1000mol·L-1Na2S2O3溶液,恰好完全反应时,消耗Na2S2O3溶液的体积为23.00mL。
已知:①2Cu2++4I-=2CuI↓+I2;②2 +I2=
+I2= +2I-。
+2I-。
通过计算数据判断固体产物中是否含有Cu2O_______ (写出计算过程)。

查阅资料:
I.CO还原CuO的温度需要控制在500℃以上;
II.CuO在高温下可分解生成红色Cu2O。
(1)CO还原CuO制得Cu的化学方程式是
(2)单向阀的作用是
(3)尾气通入CuCl盐酸溶液的目的是
(4)为探究还原后的红色固体产物Cu中是否含有Cu2O,设计方案如下:
步骤1:准确称取1.50g固体产物,加适当过量的稀硫酸和双氧水使固体全部溶解,此时固体产物中的铜元素完全转化为Cu2+。
步骤2:微热,除去过量的过氧化氢,加水稀释成250.00mL溶液。
步骤3:取25.00mL溶液于锥形瓶中,加入适当过量的KI溶液,滴加少量淀粉溶液,再滴加0.1000mol·L-1Na2S2O3溶液,恰好完全反应时,消耗Na2S2O3溶液的体积为23.00mL。
已知:①2Cu2++4I-=2CuI↓+I2;②2
 +I2=
+I2= +2I-。
+2I-。通过计算数据判断固体产物中是否含有Cu2O
您最近一年使用:0次
2022-09-02更新
|
82次组卷
|
2卷引用:江苏省淮安市淮阴中学教育集团涟水滨河高级中学2022-2023学年高一下学期第一次学情调研化学试题
7 . 甲、乙两同学欲验证乙醇的性质,现做如下实验:
I. 甲同学做乙醇的催化氧化实验并考查催化剂的催化机理,现设计了如下图所示的装置(夹持装置仪器已省略):
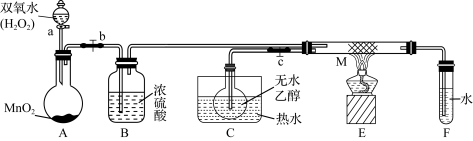
其实验操作:先按上图安装好,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
(1)A中发生反应的化学方程式为___________ , B的作用是___________ ;C中热水的作用是___________ 。
(2)M处发生反应的化学方程式为___________ 。
(3)从M管中可观察到的现象是___________ 。从中可认识到该实验过程中催化剂___________ (填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的___________ 。
(4)实验一段时间后,如果撤掉酒精灯,反应___________ (填“能”或“不能”)继续进行,其原因是___________ 。
II. 乙同学进行乙醇的沸点测定实验,装置如图所示,回答下列问题:

(5)盛乙醇的试管应浸入水浴中,水浴的温度应保持在___________(填字母)。
(6)测乙醇沸点时不把整个试管浸在水里的原因是___________ ;塞子豁口的作用是___________ 。
I. 甲同学做乙醇的催化氧化实验并考查催化剂的催化机理,现设计了如下图所示的装置(夹持装置仪器已省略):

其实验操作:先按上图安装好,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
(1)A中发生反应的化学方程式为
(2)M处发生反应的化学方程式为
(3)从M管中可观察到的现象是
(4)实验一段时间后,如果撤掉酒精灯,反应
II. 乙同学进行乙醇的沸点测定实验,装置如图所示,回答下列问题:

(5)盛乙醇的试管应浸入水浴中,水浴的温度应保持在___________(填字母)。
| A.100 ℃ | B.78.5 ℃ | C.80 ℃ | D.50 ℃ |
您最近一年使用:0次
名校
解题方法
8 . 某化学兴趣小组为制备并探究 的性质,按下图所示装置进行实验。
的性质,按下图所示装置进行实验。
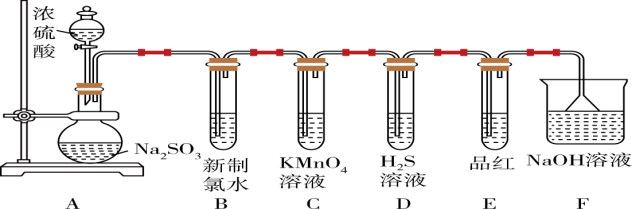
已知: (浓)
(浓)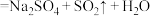
(1)装置A中盛放浓硫酸的仪器名称是_______ 。
(2)装置B中发生反应后的酸性将_______ (填“增强”、“不变”或“减弱”)。
(3)装置C中现象为_______ 。
(4)装置E目的是探究 与品红作用的可逆性,请写出实验操作及现象
与品红作用的可逆性,请写出实验操作及现象_______ 。
(5)装置F中发生反应的离子方程式为_______ 。
 的性质,按下图所示装置进行实验。
的性质,按下图所示装置进行实验。
已知:
 (浓)
(浓)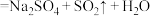
(1)装置A中盛放浓硫酸的仪器名称是
(2)装置B中发生反应后的酸性将
(3)装置C中现象为
(4)装置E目的是探究
 与品红作用的可逆性,请写出实验操作及现象
与品红作用的可逆性,请写出实验操作及现象(5)装置F中发生反应的离子方程式为
您最近一年使用:0次
9 . 实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。

图中a为氯气发生装置,c的试管中盛有15mL30%的 溶液,并置于热水浴中,d的试管中盛有15mL 8%的
溶液,并置于热水浴中,d的试管中盛有15mL 8%的 溶液,并置于冰水浴中,f为
溶液,并置于冰水浴中,f为 的发生装置。
的发生装置。
(1)制取氯气时,在烧瓶中先加入一定量的 固体,再通过
固体,再通过___________ (填写仪器名称)向烧瓶中加入适量的浓盐酸。
(2)装置b的作用是___________ 。
(3)f装置中反应的化学方程式为___________ 。
(4)比较制取氯酸钾和次氯酸钠的条件,两者的差异是___________ 。
(5)反应完毕经冷却后,c装置的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是___________ (选填字母);从c装置的试管中分离该晶体的操作是___________ (填写实验操作名称)。

(6)将d中余气与f中产生的气体通入e中,产生的现象为___________ 。
(7)该实验有一处明显的缺点是___________ 。

图中a为氯气发生装置,c的试管中盛有15mL30%的
 溶液,并置于热水浴中,d的试管中盛有15mL 8%的
溶液,并置于热水浴中,d的试管中盛有15mL 8%的 溶液,并置于冰水浴中,f为
溶液,并置于冰水浴中,f为 的发生装置。
的发生装置。(1)制取氯气时,在烧瓶中先加入一定量的
 固体,再通过
固体,再通过(2)装置b的作用是
(3)f装置中反应的化学方程式为
(4)比较制取氯酸钾和次氯酸钠的条件,两者的差异是
(5)反应完毕经冷却后,c装置的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是

(6)将d中余气与f中产生的气体通入e中,产生的现象为
(7)该实验有一处明显的缺点是
您最近一年使用:0次
2022-01-23更新
|
202次组卷
|
2卷引用:江苏省淮安市2021-2022学年高一上学期期末考试化学试题
10 . 硫酸是当今世界最重要的化工产品之一。
I.硫酸的各种制法:
(1)早在1000多年前,我国就已采用加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)的方法制取硫酸。FeSO4受热分解的化学方程式:2FeSO4 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。
①将FeSO4受热产生的气体通入如图1装置中,以检验产生的气体中是否含有SO3和SO2。能说明SO2存在的实验现象是_________ 。
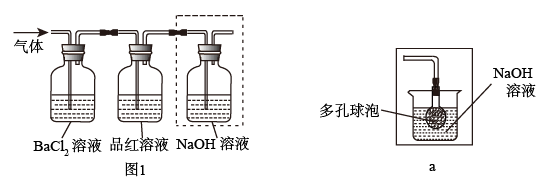
②有同学提出图1虚线框内盛装NaOH溶液的装置可以换成a装置,其中多孔玻璃球泡的作用是_____ 。
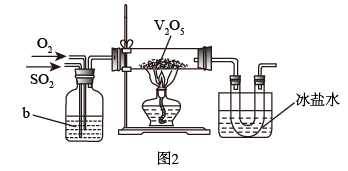
(2)目前工业上主要采用接触法制备硫酸,其中一步为:2SO2+O2 2SO3。实验室模拟该过程常用图2装置进行实验。b装置中装有浓硫酸,写出b装置的作用
2SO3。实验室模拟该过程常用图2装置进行实验。b装置中装有浓硫酸,写出b装置的作用_________ (写出两点)。
II.硫酸的性质
(3)图3中甲试管内发生反应的化学方程式为_____ ,该反应体现了浓硫酸的性质为____ 。
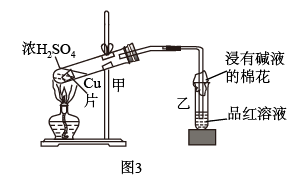
(4)当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到了白色固体,请分别写出检验该白色固体离子组成的方法___________ 。
I.硫酸的各种制法:
(1)早在1000多年前,我国就已采用加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)的方法制取硫酸。FeSO4受热分解的化学方程式:2FeSO4
 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。①将FeSO4受热产生的气体通入如图1装置中,以检验产生的气体中是否含有SO3和SO2。能说明SO2存在的实验现象是

②有同学提出图1虚线框内盛装NaOH溶液的装置可以换成a装置,其中多孔玻璃球泡的作用是
(2)目前工业上主要采用接触法制备硫酸,其中一步为:2SO2+O2
 2SO3。实验室模拟该过程常用图2装置进行实验。b装置中装有浓硫酸,写出b装置的作用
2SO3。实验室模拟该过程常用图2装置进行实验。b装置中装有浓硫酸,写出b装置的作用
II.硫酸的性质
(3)图3中甲试管内发生反应的化学方程式为

(4)当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到了白色固体,请分别写出检验该白色固体离子组成的方法
您最近一年使用:0次
2021-08-19更新
|
441次组卷
|
2卷引用:江苏省淮安市车桥中学2021-2022学年高二上学期入学调研(B)化学试题



