名校
解题方法
1 . 某小组研究NH4Cl与CuO的反应,进行如下实验(部分装置略):
经检测,实验Ⅰ中的黄色固体含有CuCl和CuCl2,实验Ⅱ中的亮红色固体为Cu。
(1)实验Ⅰ中试管口的白色固体是_____ 。
(2)实验Ⅰ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:
CuO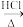 CuCl2(湿润)
CuCl2(湿润)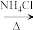 (NH4)2CuCl4
(NH4)2CuCl4 CuCl2(无水)
CuCl2(无水)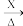 CuCl
CuCl
①(NH4)2CuCl4固体受热分解的化学方程式是_____ 。
②对于物质X,做出如下假设:
ⅰ.X是NH4Cl,反应:NH4Cl+CuCl2 CuCl+ +HCl,将方程式补充完整并配平:
CuCl+ +HCl,将方程式补充完整并配平:______ 。
ⅱ.X是____ ,理由是_____ 。
(3)实验Ⅰ和实验Ⅱ的现象不同,可能的原因是____ (列出2点)。
(4)NH4Cl溶液与CuO反应。
实验Ⅲ 向CuO粉末中加入0.1mol•L−1NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色。
资料:ⅰ.相关微粒在水溶液中的颜色:Cu2+蓝色,Cu(NH3)2+和 深蓝色
深蓝色
ⅱ.Cu(NH3)2+ Cu2++NH3,
Cu2++NH3,
 Cu2++4NH3
Cu2++4NH3
①设计实验证明实验Ⅲ得到的蓝色溶液中存在Cu(NH3)2+或 。实验方案是
。实验方案是_____ 。
②实验Ⅲ中未观察到NH4Cl溶液与CuO发生氧化还原反应的产物,可能的原因是___ (列出1点即可)。
实验 | Ⅰ | Ⅱ |
装置 |
|
|
现象 | 加热试管,产生白烟,试管口有白色固体;试管中有水生成,继续加热,黑色固体变蓝,最终部分变为黄色 | 将细玻璃管口加热至红热,迅速垂直插入NH4Cl晶体中,一段时间后,取出玻璃管,管口处有亮红色固体 |
经检测,实验Ⅰ中的黄色固体含有CuCl和CuCl2,实验Ⅱ中的亮红色固体为Cu。
(1)实验Ⅰ中试管口的白色固体是
(2)实验Ⅰ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:
CuO
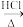 CuCl2(湿润)
CuCl2(湿润)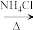 (NH4)2CuCl4
(NH4)2CuCl4 CuCl2(无水)
CuCl2(无水)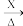 CuCl
CuCl①(NH4)2CuCl4固体受热分解的化学方程式是
②对于物质X,做出如下假设:
ⅰ.X是NH4Cl,反应:NH4Cl+CuCl2
 CuCl+ +HCl,将方程式补充完整并配平:
CuCl+ +HCl,将方程式补充完整并配平:ⅱ.X是
(3)实验Ⅰ和实验Ⅱ的现象不同,可能的原因是
(4)NH4Cl溶液与CuO反应。
实验Ⅲ 向CuO粉末中加入0.1mol•L−1NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色。
资料:ⅰ.相关微粒在水溶液中的颜色:Cu2+蓝色,Cu(NH3)2+和
 深蓝色
深蓝色ⅱ.Cu(NH3)2+
 Cu2++NH3,
Cu2++NH3,
 Cu2++4NH3
Cu2++4NH3①设计实验证明实验Ⅲ得到的蓝色溶液中存在Cu(NH3)2+或
 。实验方案是
。实验方案是②实验Ⅲ中未观察到NH4Cl溶液与CuO发生氧化还原反应的产物,可能的原因是
您最近一年使用:0次
20-21高一上·全国·课时练习
名校
解题方法
2 . 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质。甲同学设计了如图所示的实验装置(部分支撑用的铁架台省略)。
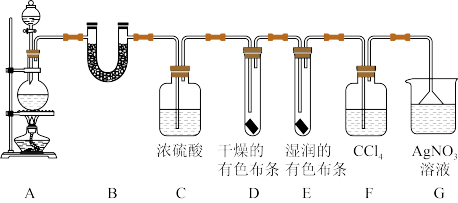
按要求回答下列问题。
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2总是小于3.55 g的原因是__ 。
(2)①装置B中盛放的试剂名称为____ ,作用是_____ ,现象是_____ 。
②装置D和E中出现的不同现象说明的问题是_____ 。
③装置F的作用是______ 。
④写出装置G中发生反应的离子方程式_____ 。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在______ 与______ 之间(填装置标号),装置中应放入_______ (填试剂或用品名称)。

按要求回答下列问题。
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2总是小于3.55 g的原因是
(2)①装置B中盛放的试剂名称为
②装置D和E中出现的不同现象说明的问题是
③装置F的作用是
④写出装置G中发生反应的离子方程式
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
您最近一年使用:0次
3 . 某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3的名称为硫代硫酸钠,可视为一个S原子取代了Na2SO4中的一个O原子。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究了自己的预测。
【提出假设】
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此推测室温时Na2S2O3溶液的pH____ 7(填“>”、“=”或“<”)。
(2)部分学生从S元素化合价推测Na2S2O3与Na2SO3性质相似,推测具有较强的______________ 。
【实验探究】取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)。
【实验结论】
(5)从探究①、②的结论:_________________________________________________________ 。
【问题讨论】
(6)甲同学向“探究②”反应后的溶液中滴加AgNO3溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由______________________________ 。
(7)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化,你的方案是______________________________ 。
【提出假设】
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此推测室温时Na2S2O3溶液的pH
(2)部分学生从S元素化合价推测Na2S2O3与Na2SO3性质相似,推测具有较强的
【实验探究】取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)。
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | 溶液pH=8 | (3) |
| 探究② | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (4) |
(5)从探究①、②的结论:
【问题讨论】
(6)甲同学向“探究②”反应后的溶液中滴加AgNO3溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
(7)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化,你的方案是
您最近一年使用:0次
名校
解题方法
4 . 某研究性学习小组探究FeSO4的化学性质并测定某药片中FeSO4的含量,回答下列问题。
(1)探究FeSO4溶液的酸碱性。实验测得FeSO4溶液呈______ (填“酸性”、“中性”、“碱性”),原因为______ (用离子方程式表示)。
(2)利用如图装置探究FeSO4的稳定性。
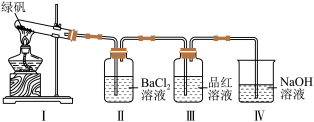
已知:绿矾为FeSO4·7H2O晶体,受热分解产物为4种氧化物。
①实验中观察到Ⅰ中固体逐渐变为红棕色,Ⅱ中有白色沉淀生成。Ⅱ中现象表明绿矾分解产物有_____________ (填化学式)。
②预测Ⅲ中现象为_________ ,设计实验证明Ⅲ中现象有可逆性,操作和现象为:取少量Ⅲ中溶液于试管中,___________ 。
③Ⅳ中NaOH溶液的作用是吸收尾气,防止污染空气。反应的化学方程式为_____ 。
(3)缺铁性贫血往往口服主要成分为FeSO4的药片。现用氧化还原滴定法测定某品牌药片中FeSO4含量,反应原理为:MnO + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。
+ 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。
该药片中FeSO4的质量分数为______ ,若盛装KMnO4溶液的滴定管用蒸馏水洗净后没有润洗,则测定结果将______ 。(填“偏大”、“偏小”、“不变”)。
(1)探究FeSO4溶液的酸碱性。实验测得FeSO4溶液呈
(2)利用如图装置探究FeSO4的稳定性。

已知:绿矾为FeSO4·7H2O晶体,受热分解产物为4种氧化物。
①实验中观察到Ⅰ中固体逐渐变为红棕色,Ⅱ中有白色沉淀生成。Ⅱ中现象表明绿矾分解产物有
②预测Ⅲ中现象为
③Ⅳ中NaOH溶液的作用是吸收尾气,防止污染空气。反应的化学方程式为
(3)缺铁性贫血往往口服主要成分为FeSO4的药片。现用氧化还原滴定法测定某品牌药片中FeSO4含量,反应原理为:MnO
 + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。
+ 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。| 滴定次数 | 待测FeSO4溶液体积/mL | 0.1000 mol/LKMnO4溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 25.11 |
| 2 | 25.00 | 0.56 | 30.56 |
| 3 | 25.00 | 0.22 | 25.11 |
您最近一年使用:0次
2020-11-14更新
|
185次组卷
|
2卷引用:云南省昆明市四川师范大学昆明实验学校安宁校区2020-2021学年高二下学期入学化学试题
名校
解题方法
5 . 用下列实验装置完成对应的实验(夹持装置已略去),不能达到实验目的的是
A.证明氨气极易溶于水 |
B.证明二氧化硫具有漂白性 |
C.证明碳酸钠热稳定性比碳酸氢钠高 |
D.证明铁与水蒸气反应生成氢气 |
您最近一年使用:0次
2020-11-06更新
|
579次组卷
|
5卷引用:北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题
名校
解题方法
6 . 某化学课外兴趣小组为探究铜与浓硫酸的反应情况,用如图所示装置进行有关实验。

回答下列问题
(1)装置A中发生反应的化学方程式为________________ 。
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是________ ,其作用是________ 。
(3)装置B的作用是储存多余的气体:当装置D中有明显的现象后,关闭K并移去酒精灯,但由于余热的作用装置A中仍有气体产生,此时装置B中现象是________ ,装置B中应盛放的液体是________ (填字母)。
A.水 B.酸性 溶液 C.浓溴水 D.饱和
溶液 C.浓溴水 D.饱和 溶液
溶液
(4)实验中,取一定质量的铜片和一定体积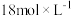 的浓硫酸放在圆底烧瓶中共热,直到反应完全,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的
的浓硫酸放在圆底烧瓶中共热,直到反应完全,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的 剩余。
剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是________________ 。
②下列药品中能用来证明反应结束后的圆底烧瓶中存在余酸的是________________ (填字母)。
A.铁粉 B. 溶液 C.银粉 D.
溶液 C.银粉 D. 溶液
溶液

回答下列问题
(1)装置A中发生反应的化学方程式为
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是
(3)装置B的作用是储存多余的气体:当装置D中有明显的现象后,关闭K并移去酒精灯,但由于余热的作用装置A中仍有气体产生,此时装置B中现象是
A.水 B.酸性
 溶液 C.浓溴水 D.饱和
溶液 C.浓溴水 D.饱和 溶液
溶液(4)实验中,取一定质量的铜片和一定体积
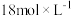 的浓硫酸放在圆底烧瓶中共热,直到反应完全,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的
的浓硫酸放在圆底烧瓶中共热,直到反应完全,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的 剩余。
剩余。①有一定量的余酸但未能使铜片完全溶解,你认为原因是
②下列药品中能用来证明反应结束后的圆底烧瓶中存在余酸的是
A.铁粉 B.
 溶液 C.银粉 D.
溶液 C.银粉 D. 溶液
溶液
您最近一年使用:0次
2020-09-23更新
|
788次组卷
|
11卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023高二上学期开学考试化学试题
黑龙江省哈尔滨师范大学附属中学2022-2023高二上学期开学考试化学试题高一必修第一册(鲁科2019)第3章 第2节 硫的转化 教材帮高一必修第一册(苏教2019)专题4 第一单元 含硫化合物的性质1(已下线)练习10 硫酸和硫酸盐-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物广东省肇庆市高要区第二中学2020-2021学年高一下学期段考(一)化学试题(已下线)4.1.2 硫酸的工业制备 浓硫酸的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)云南省普洱市镇沅彝族哈尼族拉祜族自治县第一中学2021-2022学年高一下学期4月份考试化学试题陕西省延安市第一中学2021-2022学年高一下学期期中考试化学试题甘肃省临夏州积石中学2021-2022学年高一下学期第一次月考化学试题(已下线)题型51 浓硫酸的性质
7 . I. “铝热反应”的化学方程式为2Al+Fe2O3 Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是_______ 。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________ ,当观察到________ 时,说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的____ (填字母)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II. 已知固体Na2SO3受热易分解。实验流程和结果如图:

气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,请回答:
(4)气体Y的分子式________ ,白色沉淀的化学式______________ 。
(5)该流程中Na2SO3受热分解的化学方程式_________ 。
(6)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式_________ (不考虑空气的影响)。
 Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | —— |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)实验室溶解该熔融物,最好选用下列试剂中的
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II. 已知固体Na2SO3受热易分解。实验流程和结果如图:

气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,请回答:
(4)气体Y的分子式
(5)该流程中Na2SO3受热分解的化学方程式
(6)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式
您最近一年使用:0次
2013·山东潍坊·一模
名校
解题方法
8 . 某课外活动小组欲利用 CuO 与 NH3反应,研究 NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
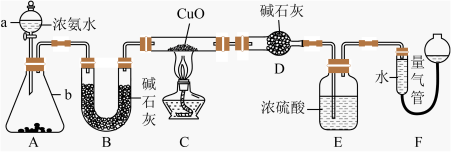
(1)仪器a的名称为_____ ;仪器b中可选择的试剂为________ (填名称)。
(2)实验室中,利用装置A,还可制取的无色气体是______ (填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______ 性,写出相应的化学方程式____________ 。
(4)E装置中浓硫酸的作用________ 。
(5)读取气体体积前,应对装置F进行的操作:__________ 。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为___________ (用含m、n字母的代数式表示)。

(1)仪器a的名称为
(2)实验室中,利用装置A,还可制取的无色气体是
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有
(4)E装置中浓硫酸的作用
(5)读取气体体积前,应对装置F进行的操作:
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为
您最近一年使用:0次
2020-06-13更新
|
735次组卷
|
40卷引用:云南省富宁县一中2019-2020学年高二上学期开学考试化学试题
云南省富宁县一中2019-2020学年高二上学期开学考试化学试题云南省漾濞二中2019-2020学年高二上学期开学考试化学试题(已下线)【浙江新东方】95(已下线)2013届山东省潍坊市高三3月第一次模拟考试化学试卷(已下线)2014高考化学名师高考模拟演练练习卷(A)(已下线)2014届高考化学二轮专题冲刺第15讲 实验方案的设计与评价练习卷(已下线)2014高考化学名师知识点精编 专题17氮及其化合物练习卷2017届广东省仲元中学、中山一中等七校高三第一次联考化学试卷2017届江西省铅山一中、横峰中学高三上学期暑假联考化学试卷2017届陕西省西藏民族学院附中高三10月检测化学试卷2017届甘肃省天水一中高三上学期12月月考化学卷2017届甘肃省天水一中高三上12月月考化学试卷苏教版2017届高三单元精练检测九化学试题云南省鹤庆三中2018-2019学年高一下学期期末考试化学试题安徽省”皖南八校“2020届高三上学期摸底考试化学试题云南省玉溪市新平三中2019-2020学年高一上学期12月月考化学试题云南省玉溪市江川区第二中学2019-2020学年高一上学期12月月考化学试题云南省大姚县一中2019-2020学年高一12月月考化学试题云南省红河哈尼族彝族自治州绿春县一中2019-2020学年高一上学期12月份月考化学试题云南省绿春县二中2019-2020学年高一12月月考化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题1云南省镇康县第一中学2019-2020学年高一12月月考化学试题云南省梁河县第一中学2019-2020学年高一上学期期末考试化学试题云南省广南县第三中学校2019-2020学年高一上学期期末考试化学试题云南省麻栗坡民族中学2019-2020学年高一上学期期末考试化学试题云南省普洱市普洱第二中学2019—2020学年高一上学期期末考试化学试题云南省普洱市澜沧县第一中学2019-2020学年高一上学期期末考试化学试题云南省普洱市孟连县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题云南省昭通市巧家县第四中学2019-2020学年高一上学期期末考试化学试题云南省玉溪市元江县一中2019-2020学年高一12月月考化学试题云南省勐腊县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)专题02 氮及其化合物(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)安徽省安庆市怀宁县怀宁中学2019-2020学年高一下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第二次综合测试化学试题(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练辽宁省六校2020-2021学年高一下学期期中联考化学试题(已下线)第17讲 氨的转化与生成-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)内蒙古通辽市科尔沁左翼中旗实验高级中学2021-2022学年高一下学期期中考试(A卷)化学试题河南省安阳市第二中学2021-2022学年高一下学期第一次段考化学试题
9 . 某校化学实验兴趣小组探究实验室中制备 Cl2的过程,为证明过程中有水蒸气和 HCl 挥发出来,同时证明Cl2的某些性质,甲同学设计了如下图所示的实验装置,按要求回答问题。

(1)用浓盐酸与足量的 MnO2反应制Cl2的化学反应方程式_____ 。
(2)①装置 B 中盛放的试剂名称为_____ ,作用是_____ ,现象是_____ 。
②装置 D 和E 中出现的不同现象说明的问题是_________ 。
③装置 F 的作用是_____ 。
④写出装置G 中发生反应的离子方程式_____ 。

(1)用浓盐酸与足量的 MnO2反应制Cl2的化学反应方程式
(2)①装置 B 中盛放的试剂名称为
②装置 D 和E 中出现的不同现象说明的问题是
③装置 F 的作用是
④写出装置G 中发生反应的离子方程式
您最近一年使用:0次
2020-05-02更新
|
492次组卷
|
3卷引用:单科化学-2021年秋季高三开学摸底考试卷02(课标全国专用)
(已下线)单科化学-2021年秋季高三开学摸底考试卷02(课标全国专用)北京市人大附中朝阳学校2019~2020年度第二学期高一年级阶段练习化学化学试题(合格班)安徽省池州市江南教育集团2021届高三上学期1月月考化学试题
10 . 为研究 NH3的某种性质并测定其组成,某小组课外活动欲利用 CuO 与 NH3反应,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
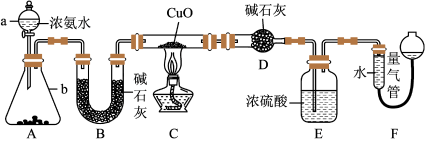
(1)仪器 D 的名称为_____________ 。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有_____________ 性,写出相应的化学方程式 ____________ 。
(3)E 装置中浓硫酸的作用____________ 。
(4)读取气体体积前,应对装置 F 进行的操作:_____________ 。
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________ (用含 m、n 字母的代数式表示)
(6)在实验室中用图中 A 装置也可制取 SO2气体:
①选用的药品可以是_____________ 。
A.Na2SO3溶液与 HNO3 B.铜与浓 H2SO4
C.碳与浓 H2SO4 D.Na2SO3固体与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为_______________________ ,表明 SO2的氧化性比 I2________ (填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是_________ (填化学式)。

(1)仪器 D 的名称为
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有
(3)E 装置中浓硫酸的作用
(4)读取气体体积前,应对装置 F 进行的操作:
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为
(6)在实验室中用图中 A 装置也可制取 SO2气体:
①选用的药品可以是
A.Na2SO3溶液与 HNO3 B.铜与浓 H2SO4
C.碳与浓 H2SO4 D.Na2SO3固体与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为
③实验室用 NaOH 溶液作为 SO2的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是
您最近一年使用:0次





