1 . 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已省略)。在试管①中加入石蜡油和氧化铝;试管②放在冷水中,试管③中加入溴的四氯化碳溶液。
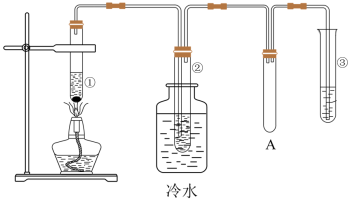
实验现象:试管①中加热一段时间后,可以看到试管内液体沸腾;试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
(1)试管①中氧化铝的作用是_______ 、_______
(2)装置A的作用是_______
(3)已知:试管①中发生的主要反应有:C17H36 C8H18+C9H18;C8H18
C8H18+C9H18;C8H18 C4H10+C4H8。丁烷可进一步分解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为
C4H10+C4H8。丁烷可进一步分解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为_______ 和_______ ,这两种有机物混合后在一定条件下可聚合成高分子化合物,其可能结构为_______ (答案可能不止一个,下同)
A.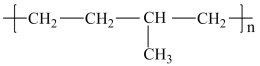 B.
B.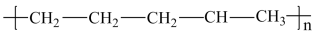
C.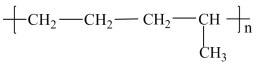 D.
D.
(4)试管②中的少量液体的组成是_______ (填序号)
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃

实验现象:试管①中加热一段时间后,可以看到试管内液体沸腾;试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
(1)试管①中氧化铝的作用是
(2)装置A的作用是
(3)已知:试管①中发生的主要反应有:C17H36
 C8H18+C9H18;C8H18
C8H18+C9H18;C8H18 C4H10+C4H8。丁烷可进一步分解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为
C4H10+C4H8。丁烷可进一步分解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为A.
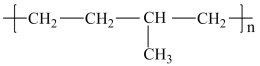 B.
B.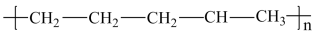
C.
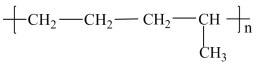 D.
D.
(4)试管②中的少量液体的组成是
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃
您最近一年使用:0次
2020-08-02更新
|
400次组卷
|
3卷引用:黑龙江省大庆市第四中学 2019~2020 学年高一下学期第三次检测化学试题
名校
解题方法
2 . 某小组利用电导率(电导率越大,导电能力越强)传感器、pH传感器探究NaHCO3和CaCl2能否发生化学反应。向25.00mL0.1mol•L-1NaHCO3溶液中滴入等体积、等浓度CaCl2溶液,电导率以及pH变化曲线如图所示。下列说法错误的是
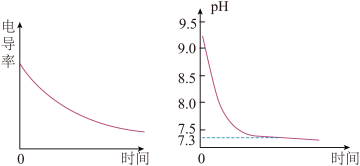

| A.电导率下降的原因是生成了CaCO3沉淀导致溶液中离子浓度降低 |
B.pH下降的原因是Ca2+促进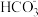 ⇌H++ ⇌H++ 平衡右移 平衡右移 |
| C.pH=7.3时溶液中溶质主要为NaCl、CaCl2 |
| D.可用0.1mol•L-1CaCl2溶液鉴别浓度均为0.1mol•L-l的NaHCO3和Na2CO3溶液 |
您最近一年使用:0次
2020-07-11更新
|
423次组卷
|
6卷引用:江西省上饶中学2020届高三6月高考模拟理科综合化学试题
名校
解题方法
3 . 铁粉具有平肝镇心、消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是

| A.在锌粒中加入几粒硫酸铜晶体可能加快H2的生成 |
| B.装置②、③中的药品分别是无水硫酸铜、氯化钙 |
| C.装置①、④中药品为浓H2SO4 |
| D.加热装置Y前,应先让X反应一段时间,排除装置中的空气 |
您最近一年使用:0次
2020-07-10更新
|
970次组卷
|
8卷引用:山东省泰安市肥城市2020届高三适应性训练(三)化学试题
山东省泰安市肥城市2020届高三适应性训练(三)化学试题(已下线)专题05 元素及其化合物-2020年高考真题和模拟题化学分项汇编江西省赣州市十六县(市)十九校2021-2022学年高一下学期期中联考化学试题山东省菏泽市2021届高三上学期期末考试化学试题(已下线)第1周 晚练题-备战2022年高考化学周测与晚练(新高考专用)河北省石家庄市第二中学2022届高三上学期11月第三次考试化学试题宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题山东省济南大学城实验高中2021-2022学年高三2月阶段性调研化学试题
名校
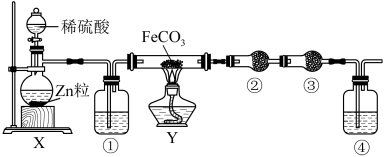
4 . 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验,请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__ 。
(2)实验过程中,装置B中发生的现象是__ ,说明SO2具有的性质是__ 。
(3)装置B中发生反应的离子方程式为__ 。
(4)尾气可采用__ 溶液吸收,离子方程式为:__ 。

(1)装置A中盛放亚硫酸钠的仪器名称是
(2)实验过程中,装置B中发生的现象是
(3)装置B中发生反应的离子方程式为
(4)尾气可采用
您最近一年使用:0次
名校
解题方法
5 . 过氧化尿素的化学式为CO(NH2)2•H2O2,是过氧化氢和尿素的加合物,外观为白色针状晶体,无毒无味,热分解温度为 45℃,易溶于水和乙醇,熔点 75-85℃,其水溶液兼有尿素和过氧化氢的性质,具有活性氧含量高、稳定性好等特点,被广泛用于医药、纺织领域。已知尿素与KMnO4溶液、NaOH 溶液都不反应。
I.合成过氧化尿素的流程及反应器的示意图如下:
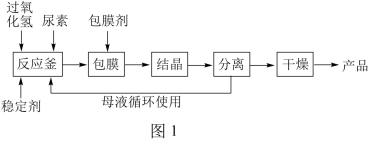
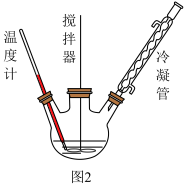
回答下列问题:
(1)图1中分离操作的名称为_______ ,图 2 中反应器的名称是 _______ ;
(2)过氧化尿素是尿素分子与过氧化氢分子之间通过_________ (填字母)结合形成的。
A.氢键 B.共价键 C.离子键 D.化学键
反应器中发生反应的化学方程式为____________ 。
(3)工业生产中,除向反应釜中投料反应物过氧化氢、工业尿素(含少量杂质铁、铜等离子)外,添加稳定剂可以提高产品的稳定性。不加稳定剂导致产品稳定率差的原因是__ 。
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品 2.500g,溶解于水,在250mL 容量瓶中定容,准确量取其中 25.00mL 溶液于锥形瓶中,加入1mL6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2,三次滴定平均消耗KMnO4溶液 8.000mL。
①达到滴定终点的现象是____________ 。
②根据滴定结果确定产品质量_ (填“合格”或“不合格”),活性氧的质量分数为___ 。
II.过氧化尿素的性质探究:
(5)过氧化尿素的催化分解实验:在试管中加入 0.1g 产品、少量水及二氧化锰,用火柴余烬检验生成气体,可观察到火柴复燃。实验中加入二氧化锰的量一定要少(固体控制在小米粒大小)的原因是:_________ 。
(6)测定过氧化尿素溶液的酸碱性:在试管中加入1mL 6mol/L NaOH溶液、1mL过氧化尿素溶液和 2mL无水乙醇,振荡试管。测得pH约为6,并观察到有白色的胶状沉淀生成,该沉淀为生成的NaHO2在乙醇中析出。写出该反应的化学方程式:___
I.合成过氧化尿素的流程及反应器的示意图如下:


回答下列问题:
(1)图1中分离操作的名称为
(2)过氧化尿素是尿素分子与过氧化氢分子之间通过
A.氢键 B.共价键 C.离子键 D.化学键
反应器中发生反应的化学方程式为
(3)工业生产中,除向反应釜中投料反应物过氧化氢、工业尿素(含少量杂质铁、铜等离子)外,添加稳定剂可以提高产品的稳定性。不加稳定剂导致产品稳定率差的原因是
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品 2.500g,溶解于水,在250mL 容量瓶中定容,准确量取其中 25.00mL 溶液于锥形瓶中,加入1mL6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2,三次滴定平均消耗KMnO4溶液 8.000mL。
①达到滴定终点的现象是
②根据滴定结果确定产品质量
II.过氧化尿素的性质探究:
(5)过氧化尿素的催化分解实验:在试管中加入 0.1g 产品、少量水及二氧化锰,用火柴余烬检验生成气体,可观察到火柴复燃。实验中加入二氧化锰的量一定要少(固体控制在小米粒大小)的原因是:
(6)测定过氧化尿素溶液的酸碱性:在试管中加入1mL 6mol/L NaOH溶液、1mL过氧化尿素溶液和 2mL无水乙醇,振荡试管。测得pH约为6,并观察到有白色的胶状沉淀生成,该沉淀为生成的NaHO2在乙醇中析出。写出该反应的化学方程式:
您最近一年使用:0次
13-14高一上·江西九江·期中
名校
6 . 按图的装置连接好仪器,先在烧杯中加入20 mL左右的Ba(OH)2溶液,接通电源后,逐渐滴加稀硫酸至过量 。
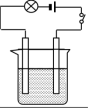
(1)当逐渐滴加稀硫酸时,烧杯中观察到的现象是:_____________ ;
(2)灯泡的现象是:_____________ ;原因是:_____________ ;
(3)发生反应的离子方程式为:_____________ 。

(1)当逐渐滴加稀硫酸时,烧杯中观察到的现象是:
(2)灯泡的现象是:
(3)发生反应的离子方程式为:
您最近一年使用:0次
2013·山东潍坊·一模
名校
解题方法
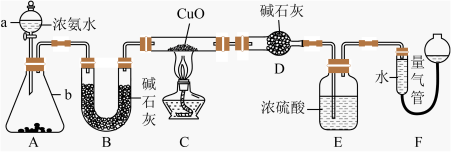
7 . 某课外活动小组欲利用 CuO 与 NH3反应,研究 NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:_____ ;仪器b中可选择的试剂为________ (填名称)。
(2)实验室中,利用装置A,还可制取的无色气体是______ (填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______ 性,写出相应的化学方程式____________ 。
(4)E装置中浓硫酸的作用________ 。
(5)读取气体体积前,应对装置F进行的操作:__________ 。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为___________ (用含m、n字母的代数式表示)。
(2)实验室中,利用装置A,还可制取的无色气体是
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有
(4)E装置中浓硫酸的作用
(5)读取气体体积前,应对装置F进行的操作:
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为
您最近一年使用:0次
2020-06-13更新
|
747次组卷
|
41卷引用:2017届江西省铅山一中、横峰中学高三上学期暑假联考化学试卷
2017届江西省铅山一中、横峰中学高三上学期暑假联考化学试卷(已下线)2013届山东省潍坊市高三3月第一次模拟考试化学试卷(已下线)2014高考化学名师高考模拟演练练习卷(A)(已下线)2014届高考化学二轮专题冲刺第15讲 实验方案的设计与评价练习卷(已下线)2014高考化学名师知识点精编 专题17氮及其化合物练习卷2017届广东省仲元中学、中山一中等七校高三第一次联考化学试卷2017届陕西省西藏民族学院附中高三10月检测化学试卷2017届甘肃省天水一中高三上学期12月月考化学卷2017届甘肃省天水一中高三上12月月考化学试卷苏教版2017届高三单元精练检测九化学试题云南省鹤庆三中2018-2019学年高一下学期期末考试化学试题云南省富宁县一中2019-2020学年高二上学期开学考试化学试题云南省漾濞二中2019-2020学年高二上学期开学考试化学试题安徽省”皖南八校“2020届高三上学期摸底考试化学试题云南省玉溪市新平三中2019-2020学年高一上学期12月月考化学试题云南省玉溪市江川区第二中学2019-2020学年高一上学期12月月考化学试题云南省大姚县一中2019-2020学年高一12月月考化学试题云南省红河哈尼族彝族自治州绿春县一中2019-2020学年高一上学期12月份月考化学试题云南省绿春县二中2019-2020学年高一12月月考化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题1云南省镇康县第一中学2019-2020学年高一12月月考化学试题云南省梁河县第一中学2019-2020学年高一上学期期末考试化学试题云南省广南县第三中学校2019-2020学年高一上学期期末考试化学试题云南省麻栗坡民族中学2019-2020学年高一上学期期末考试化学试题云南省普洱市普洱第二中学2019—2020学年高一上学期期末考试化学试题云南省普洱市澜沧县第一中学2019-2020学年高一上学期期末考试化学试题云南省普洱市孟连县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题云南省昭通市巧家县第四中学2019-2020学年高一上学期期末考试化学试题云南省玉溪市元江县一中2019-2020学年高一12月月考化学试题云南省勐腊县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)专题02 氮及其化合物(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)安徽省安庆市怀宁县怀宁中学2019-2020学年高一下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第二次综合测试化学试题(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练(已下线)【浙江新东方】95辽宁省六校2020-2021学年高一下学期期中联考化学试题(已下线)第17讲 氨的转化与生成-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)内蒙古通辽市科尔沁左翼中旗实验高级中学2021-2022学年高一下学期期中考试(A卷)化学试题河南省安阳市第二中学2021-2022学年高一下学期第一次段考化学试题福建省泉州市泉港区第五中学等五校2022-2023学年高一下学期期中考试化学试题
8 . I.某化学实验小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,某同学设计了如图所示的实验装置(氯气易溶于CCl4,HCl不溶于CCl4)。

请回答下列问题:
(1)装置A中连接橡皮管的目的是_____________________________________ 。
(2)装置A中发生反应的离子方程式为_________________________________ ,装置B中盛放的试剂是___________ 。
(3)装置D与E中出现的不同现象说明的问题是_________________________ 。
(4)有同学基于实验的严谨性考虑,认为可在F、G两个装置之间再加一个装有湿润的淀粉KI试纸的装置,其目的是___________________________________ 。
Ⅱ.某研究性学习小组欲制备漂白粉,设计在上述装置A后连接如右图所示的组合装置:
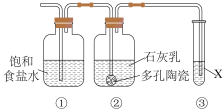
(5)装置②中发生反应的化学方程为___________________________________ 。
(6)制漂白粉的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是___________________________________ 。

请回答下列问题:
(1)装置A中连接橡皮管的目的是
(2)装置A中发生反应的离子方程式为
(3)装置D与E中出现的不同现象说明的问题是
(4)有同学基于实验的严谨性考虑,认为可在F、G两个装置之间再加一个装有湿润的淀粉KI试纸的装置,其目的是
Ⅱ.某研究性学习小组欲制备漂白粉,设计在上述装置A后连接如右图所示的组合装置:

(5)装置②中发生反应的化学方程为
(6)制漂白粉的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是
您最近一年使用:0次
2020-06-04更新
|
441次组卷
|
2卷引用:辽宁省六校2019-2020学年高一下学期期初考试化学试题
9 . 用如图所示装置进行下列实验,所选的药品、现象和结论正确的一组是( )
| 选项 | a | b | c | 现象 | 结论 | 装置 |
| A | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | H2CO3酸性大于H2SiO3 | 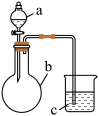 |
| B | 浓盐酸 | MnO2 | 石蕊试液 | 石蕊试液先变红后褪色 | 氯气具有漂白性 | |
| C | 稀硫酸 | 锌粒 | 水 | 一段时间有气泡 | 反应生成了H2 | |
| D | NaOH溶液 | Al | 水 | 产生大量气泡 | Al能与NaOH溶液反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-05-19更新
|
116次组卷
|
2卷引用:四川省自贡市田家炳中学2019-2020学年高一下学期开学考试化学试题
名校
解题方法
10 . 在通风橱中进行下列实验:
下列说法正确的是( )
| 步骤 | 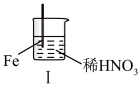 | 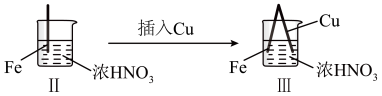 | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
| A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=NO2 |
| B.Ⅱ中现象是因为浓HNO3会使Fe表面覆盖一层保护膜,阻止Fe进一步反应,此反应不属于氧化还原反应 |
| C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 |
| D.针对Ⅲ中现象,在Fe、Cu之间连接电流表,可判断Fe是否被氧化 |
您最近一年使用:0次
2020-05-11更新
|
595次组卷
|
3卷引用:辽宁省沈阳铁路实验中学2019-2020学年高一下学期期中考试化学试题



