13-14高一上·河北石家庄·期中
名校
解题方法
1 . 如表是某城市场上销售的一种“加碘盐”包装上的部分文字说明。
回答下列问题:
(1)结合物质分类中的树状分类法,根据物质的组成对物质进行分类。在下列五种___ (填“混合物”“化合物”“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的是__ (填序号)。
①HIO3②NaIO3③KOH④I2O5⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)___ (填“能”或“不能”)溶于水;化学性质:碘酸钾(KIO3)在受热时___ (填“易分解”或“不易分解”)。
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘量 | 20~40mg·kg-1 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时待食品熟后加入碘盐 |
回答下列问题:
(1)结合物质分类中的树状分类法,根据物质的组成对物质进行分类。在下列五种
①HIO3②NaIO3③KOH④I2O5⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)
您最近一年使用:0次
2021-10-20更新
|
335次组卷
|
13卷引用:2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷
(已下线)2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷(已下线)2013-2014学年甘肃省嘉峪关市一中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷2015-2016学年福建省莆田二十五中高一上学期期中测试化学试卷2015-2016学年吉林松原油田高中高一下期初考试化学试卷江苏省宿迁市泗阳县桃州中学2020-2021学年高一上学期第一次调研测试化学试题黑龙江省漠河市高级中学2020-2021学年高一上学期12月考化学试题吉林省辉南县第六中学2021-2022学年高一上学期第一次月考化学试题安徽省池州市第一中学2021-2022学年高一上学期10月月考化学试题山东省德州市临邑县第一中学2021-2022学年高一10月月考化学试题四川省雅安中学2021-2022学年高一上学期10月月考化学试题重庆市求精中学2021-2022学年高一上学期第二次月考化学试题
名校
解题方法
2 . CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6 g;在150℃时转变成NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质。
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
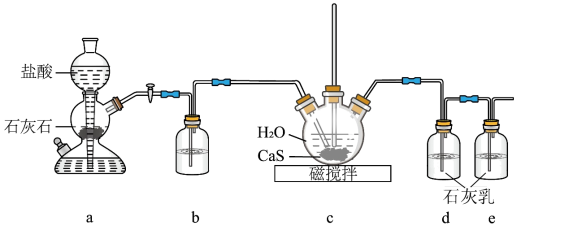
①使装置a中反应发生的操作为_____ ;装置b中盛放的试剂是_____________ 。
②装置c中的长直导管的作用是__________ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱。合适的加热方式是__________ ;该反应的化学方程式为__________ 。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是___ (填化学式,下同)。
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为_________ 。
③可用酸性KMnO4溶液滴定硫脲,已知MnO 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO
被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO ,该反应的离子方程式为
,该反应的离子方程式为_____ 。
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):

①使装置a中反应发生的操作为
②装置c中的长直导管的作用是
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱。合适的加热方式是
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为
③可用酸性KMnO4溶液滴定硫脲,已知MnO
 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO
被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
2021-10-13更新
|
858次组卷
|
3卷引用:2020年全国卷Ⅲ化学真题变式题
名校
解题方法
3 . 为了预防传染性疾病,不少地方都采用了“84”消毒液进行消毒。“84”消毒液(有效成分为NaClO)可用于消毒和漂白。下列对相关实验现象的分析,不正确 的是


| 实验 | I | II | III |
| 滴管中的液体 | 1mL的蒸馏水 | 1mL0.0002mol•L-1的H2SO4 | 1mL2mol•L-1的H2SO4 |
| 实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去 | 混合后溶液的pH=5.0,蓝色迅速褪去,无气体产生 | 混合后溶液的pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝 |
| A.对比实验I和II,II中蓝色迅速褪去的原因是发生了反应:ClO-+H+=HClO |
| B.对比实验II和III,溶液的pH可能会影响ClO-的氧化性或Cl-的还原性 |
| C.实验III中产生的气体是Cl2,由HClO分解得到:2HClO=Cl2↑+H2O |
| D.加酸可以提高“84”消毒液的漂白效果,但需合适的pH才能安全使用 |
您最近一年使用:0次
4 . 某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+
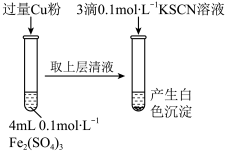
(1)Fe3+与Cu粉发生反应的离子方程式为__________________________________ 。
(2)探究白色沉淀产生的原因,请填写实验方案:
查阅资料:
已知:①SCN-的化学性质与I-相似;②2Cu2++4I-=2CuI↓+I2。
Cu2+与SCN-反应的离子方程式为________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO⇌Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;
反应Ⅱ:Fe2+与NO反应
①依据实验现象,可推知反应Ⅰ的速率比反应Ⅱ的____ (填“快”或“慢”)。
②反应Ⅰ是一个不可逆反应,设计实验方案加以证明:___________________ 。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:_______________ 。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为
(2)探究白色沉淀产生的原因,请填写实验方案:
| 实验方案 | 现象 | 结论 |
| 步骤1:取4 mL | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
| 步骤2:取 | 无明显现象 |
已知:①SCN-的化学性质与I-相似;②2Cu2++4I-=2CuI↓+I2。
Cu2+与SCN-反应的离子方程式为
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3 mL 0.1 mol·L-1 FeSO4溶液中加入1 mL稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:Fe2++NO⇌Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;
反应Ⅱ:Fe2+与NO反应
①依据实验现象,可推知反应Ⅰ的速率比反应Ⅱ的
②反应Ⅰ是一个不可逆反应,设计实验方案加以证明:
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:
您最近一年使用:0次
2021-08-09更新
|
965次组卷
|
15卷引用:重庆市第一中学2017届高三下学期考前热身考试理科综合化学试题
重庆市第一中学2017届高三下学期考前热身考试理科综合化学试题湖北省武汉市2018届高三毕业生二月调研理综化学试题【全国校级联考】江西省景德镇市第一中学等盟校2018届高三第二次联考理综化学试题(已下线)《考前20天终极攻略》-5月27日 综合实验设计、探究和评价【全国百强校】宁夏回族自治区石嘴山市第三中学2019届高三下学期一模考试理科综合化学试题2020届高三化学二轮复习实验题必练-化学平衡的移动及影响因素四川省成都市双流棠湖中学2020届高三下学期第三次月考理综化学试题(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(十)化学实验设计与探究(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)北京市北京一零一中学2022-2023学年高二上学期期中考试化学试题(已下线)02 物质性质、实验原理的探究型综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型32 原因描述型实验(已下线)实验探究题
名校
解题方法
5 . 某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。 [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法中不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法中不正确的是
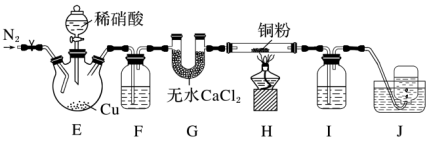
 [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法中不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法中不正确的是| A.装置F、I中的试剂依次为水、硫酸亚铁溶液 |
| B.若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应 |
| C.实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞 |
| D.装置J收集的气体中一定不含NO |
您最近一年使用:0次
2021-08-09更新
|
1425次组卷
|
24卷引用:江西名校学术联盟(临川一中、景德镇一中、雁潭一中等)2018届高三教学质量检测考试(二)理综-化学试题
江西名校学术联盟(临川一中、景德镇一中、雁潭一中等)2018届高三教学质量检测考试(二)理综-化学试题(已下线)黄金30题系列 高一化学 小题好拿分【提升版】(已下线)2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(理综)(B卷)江西省抚州市临川区第一中学2018届高三上学期教学质量检测(二)理科化学试题四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.15 物质的制备及实验方案设计与评价江西省2018届高三六校联考理科综合化学试题【全国百强校】广西陆川县中学2018届高三下学期第二次质量检测理科综合化学试题(已下线)2018年5月27日 每周一测——《每日一题》2018年高三化学四轮复习辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题【全国百强校】四川省棠湖中学2019届高三上学期期末考试理综-化学试题(已下线)2019年5月26日 《每日一题》四轮复习——每周一测020届高三化学实验复习——仪器连接、实验操作顺序【选择突破】浙江省富阳中学2020-2021学年高二上学期第一次月考化学试题(已下线)【浙江新东方】42.(已下线)第14讲 氮及其化合物(精讲)-2022年一轮复习讲练测(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省大庆实验中学2022届高三10月月考化学试题福建省三明市第一中学2022届高三10月月考化学试题2021年北京高考化学试题变式题1-10(已下线)专题25 化学实验综合性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)福建省德化第一中学2024-2024学年高一下学期第一次月考化学试题
6 . 下列关于石蜡油(主要是含17个以上碳原子的烷烃混合物)分解实验的分析,错误 的是


| A.碎瓷片是反应物 | B.产物的主要成分是烷烃与烯烃的混合物 |
| C.所产生的气体能使酸性高锰酸钾溶液褪色 | D.所产生的气体能使溴的四氯化碳溶液褪色 |
您最近一年使用:0次
7 . “探究与创新能力”是化学的关键能力。下列各项中“操作或现象”能达到预期“实验目的”的是
| 选项 | 实验目的 | 操作或现象 |
| A | 制作简单原电池 | 将铁钉和铜丝连接插入食醋中即可形成原电池 |
| B | 验证碳能与浓硝酸反应 | 向浓硝酸中插入红热的碳,产生红棕色气体 |
| C | 鉴别溴蒸气和 | 分别通入 溶液中,产生浅黄色沉淀的是溴蒸气 溶液中,产生浅黄色沉淀的是溴蒸气 |
| D | 除去乙酸乙酯中的少量乙酸 | 加入足量饱和氢氧化钠溶液,充分混合后分液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 某实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
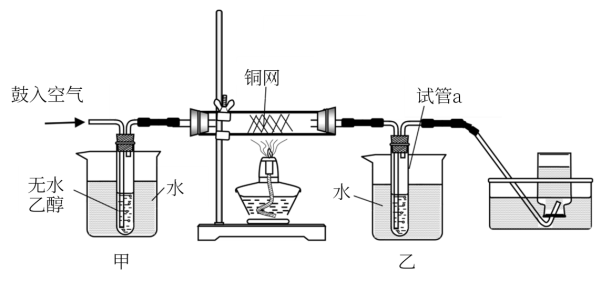
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式______ 。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化氧化反应是________ (填“放热”或“吸热”)反应。进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如下图所示。试解释出现图中现象的原因___________ 。

(3)甲和乙两个水浴作用不相同。甲的作用是________ ;乙的作用是___________ 。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有______ 。要除去该物质,可在混合液中加入________ (填写字母)。
A.氯化钠溶液B.苯
C.碳酸氢钠溶液D.四氯化碳
然后,再通过________________ (填实验操作名称)即可除去。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化氧化反应是

(3)甲和乙两个水浴作用不相同。甲的作用是
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有
A.氯化钠溶液B.苯
C.碳酸氢钠溶液D.四氯化碳
然后,再通过
您最近一年使用:0次
2021-07-14更新
|
535次组卷
|
6卷引用:云南省玉溪市江川二中2018-2019学年高一下学期5月份考试化学试题
9 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图装置来制取。写出制取氯气的化学方程式_______ ;a的作用是_______ 。

(2)实验室通过测定不同浓度NaClO溶液在不同pH下的细菌杀灭率(%),以探究“84”消毒液杀菌能力的影响因素,实验结果如表。
①结合表中数据可推断,相同条件下,HClO的杀菌消毒能力_______ (填“强于”、“弱于”或“相当于”)NaClO的杀菌消毒能力。
②下列关于“84消毒液”使用方法的描述中,正确的是_______ (填字母序号)。
a.与双氧水消毒液混合使用会增强杀菌消毒能力
b.其杀菌消毒能力与其浓度无关
c.不能与洁厕灵混合使用,可能会导致安全事故
d.喷洒在物品表面后适当保持一段时间,以达到杀菌消毒效果
(3)ClO2和NaClO2均为重要的杀菌消毒剂。已知NaClO2易溶于水,难溶于乙醇。NaClO2饱和溶液在温度低于38 ℃时析出NaClO2·3H2O晶体,高于38 ℃时析出NaClO2晶体,高于60 ℃时NaClO2分解成NaClO3和NaCl。
①将ClO2通入到NaOH和H2O2混合溶液中,可制备NaClO2溶液。所得溶液在减压和55 ℃条件下蒸发至大量晶体析出后,_______ ,_______ ,低于60℃干燥,得到干燥的NaClO2 (补全实验步骤)。
②一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,得到ClO2和NaCl,理论上每消耗1molNaClO2生成ClO2的量为_______ mol。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图装置来制取。写出制取氯气的化学方程式

(2)实验室通过测定不同浓度NaClO溶液在不同pH下的细菌杀灭率(%),以探究“84”消毒液杀菌能力的影响因素,实验结果如表。
| NaClO溶液浓度 (mg·L-1) | 不同pH下的细菌杀灭率(%) | ||
| pH=4.5 | pH=7.0 | pH=9.5 | |
| 250 | 98.90 | 77.90 | 53.90 |
| 500 | 99.99 | 97.90 | 65.54 |
②下列关于“84消毒液”使用方法的描述中,正确的是
a.与双氧水消毒液混合使用会增强杀菌消毒能力
b.其杀菌消毒能力与其浓度无关
c.不能与洁厕灵混合使用,可能会导致安全事故
d.喷洒在物品表面后适当保持一段时间,以达到杀菌消毒效果
(3)ClO2和NaClO2均为重要的杀菌消毒剂。已知NaClO2易溶于水,难溶于乙醇。NaClO2饱和溶液在温度低于38 ℃时析出NaClO2·3H2O晶体,高于38 ℃时析出NaClO2晶体,高于60 ℃时NaClO2分解成NaClO3和NaCl。
①将ClO2通入到NaOH和H2O2混合溶液中,可制备NaClO2溶液。所得溶液在减压和55 ℃条件下蒸发至大量晶体析出后,
②一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,得到ClO2和NaCl,理论上每消耗1molNaClO2生成ClO2的量为
您最近一年使用:0次
2019高三·全国·专题练习
名校
解题方法
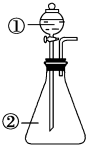
10 . 用如图所示装置进行下列实验:将①中浓硫酸溶液滴入②中。预测的现象与结论相符的是

| 选项 | ② | 预测②中现象 | 实验结论 |
| A | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-02更新
|
545次组卷
|
14卷引用:2019年8月19日《每日一题》2020年高考一轮复习—— 浓硫酸的性质
(已下线)2019年8月19日《每日一题》2020年高考一轮复习—— 浓硫酸的性质(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测四川省雅安中学2020-2021学年高一下学期4月月考化学试题合肥市第九中学2020-2021学年高一下学期期中考试化学试题辽宁省大连市第一中学2020-2021学年高一下学期4月月考化学试题河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期4月期中考试化学试题河南省叶县高级中学2021-2022学年高一下学期5月质量检测化学试题湖北省襄阳市襄州区第二高级中学2021-2022学年高一下学期期中考试化学试题新疆精河县高级中学2021-2022学年高一下学期期中考试化学试题广东省江门市第一中学2021-2022学年高一下学期第一次月考化学试题(已下线)题型51 浓硫酸的性质广东省佛山市第四中学2022-2023学年高一下学期3月月考化学试卷山西省实验中学2022-2023学年高一下学期3月月考化学试题



