解题方法
1 . 在生活中亚硝酸钠(NaNO2)应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长等。某化学兴趣小组查阅资料得知2NO+Na2O2=2NaNO2,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去)。

已知:NO能被酸性高锰酸钾氧化成最高价离子,但不能被浓硫酸氧化。回答下列问题:
(1)盛装稀硝酸的仪器名称为___________ ,仪器按气流方向连接顺序为b→___________ (部分装置可重复使用)。
(2)反应开始前打开止水夹a,通入过量氮气的目的是为了排除装置内的空气,反应结束后打开止水夹a,通入过量氮气的目的是___________ 。
(3)已知:亚硝酸钠在中性或碱性条件中是稳定的,但酸化后能氧化KI,生成I2。若需鉴别亚硝酸钠和食盐,可供选择的物质有:①自来水②淀粉-KI试纸③淀粉④白糖⑤食醋,进行实验时,必须使用的物质有(填序号)___________ 。
(4)写出NO被酸性高锰酸钾溶液吸收的离子方程式___________ 。

已知:NO能被酸性高锰酸钾氧化成最高价离子,但不能被浓硫酸氧化。回答下列问题:
(1)盛装稀硝酸的仪器名称为
(2)反应开始前打开止水夹a,通入过量氮气的目的是为了排除装置内的空气,反应结束后打开止水夹a,通入过量氮气的目的是
(3)已知:亚硝酸钠在中性或碱性条件中是稳定的,但酸化后能氧化KI,生成I2。若需鉴别亚硝酸钠和食盐,可供选择的物质有:①自来水②淀粉-KI试纸③淀粉④白糖⑤食醋,进行实验时,必须使用的物质有(填序号)
(4)写出NO被酸性高锰酸钾溶液吸收的离子方程式
您最近一年使用:0次
名校
2 . 下图是实验室制备K2FeO4的实验装置图,其中甲为制氯气的装置。(资料:K2FeO4为紫色固体,微溶于KOH,具有强氧化性)

下列说法不正确 的是( )

下列说法
| A.乙中所用试剂为饱和食盐水 |
| B.丙和丁中均会发生反应:Cl2+2OH-=Cl-+ClO-+H2O |
| C.丙中产生紫色固体,说明碱性条件下,Cl2氧化性强于K2FeO4 |
| D.若取反应后丙中紫色溶液,加入稀硫酸产生Cl2,则证明了K2FeO4具有氧化性 |
您最近一年使用:0次
2020-04-03更新
|
883次组卷
|
11卷引用:【浙江新东方】在线化学(13)
(已下线)【浙江新东方】在线化学(13)北京市东城区2019-2020学年高一上学期期末教学统一检测化学试题天津市和平区2021-2022学年高一上学期线上期末质量检测化学试题北京市房山区2021-2022学年高一下学期期中考试化学试题(已下线)2.2.3 氯气的实验室制法 氯离子的检验-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)(已下线)【知识图鉴】单元讲练测必修第一册第二单元03巩固练四川省眉山市仁寿第一中学校南校区2023-2024学年高一上学期开学化学试题(已下线)期中测试卷一【测试范围:第一、二章】-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)北京市第五十中学2023-2024学年高一上学期期中考试化学试题四川省南充市嘉陵区四川省南充市嘉陵第一中学2023-2024学年高一上学期11月期中考试化学试题河北省迁安市2023-2024学年高三上学期期中考试化学试题
解题方法
3 . 实验室可用如图装置制得氯气并与铝粉反应制备无水AlCl3。已知AlCl3在183°C升华,遇潮湿空气即反应产生大量白雾。请回答问题:
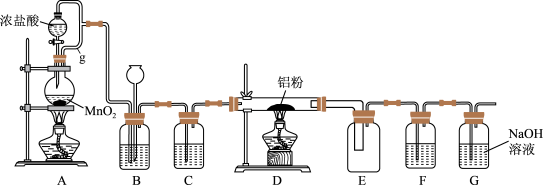
(1)A中反应的化学方程式为_________ ;HCl在反应中表现出的性质为______ (填:酸性、氧化性或还原性)。
(2)A中g管的作用是________ 。
(3)B中盛放饱和食盐水的作用是________ ;若D中生成的AlCl3凝华堵塞导管,B中可观察到的现象为________ 。
(4)C和F所装试剂相同,其中F的作用是___________ 。

(1)A中反应的化学方程式为
(2)A中g管的作用是
(3)B中盛放饱和食盐水的作用是
(4)C和F所装试剂相同,其中F的作用是
您最近一年使用:0次
2019-12-16更新
|
326次组卷
|
2卷引用:浙江省浙东北联盟(ZDB)2019-2020学年高一上学期期中考试化学试题
名校
解题方法
4 . 高铁酸钾( )是一种高效的水处理剂,实验室制备
)是一种高效的水处理剂,实验室制备 的装置如图所示。(夹持装置略去)
的装置如图所示。(夹持装置略去)

查阅 资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成
资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成 和
和 。④KOH溶于醇,微溶于乙醚。
。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,盛放 的仪器名称是
的仪器名称是___________ ,盛放浓盐酸的仪器名称是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中生成 的离子方程式为
的离子方程式为___________ 。
(4)以下说法正确的是___________。
(5)装置D的作用是(用离子方程式说明)___________ 。
 )是一种高效的水处理剂,实验室制备
)是一种高效的水处理剂,实验室制备 的装置如图所示。(夹持装置略去)
的装置如图所示。(夹持装置略去)
查阅
 资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成
资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成 和
和 。④KOH溶于醇,微溶于乙醚。
。④KOH溶于醇,微溶于乙醚。回答下列问题:
(1)装置A为氯气发生装置,盛放
 的仪器名称是
的仪器名称是(2)装置B中盛放的试剂是
(3)装置C中生成
 的离子方程式为
的离子方程式为(4)以下说法正确的是___________。
A.装置C中KOH溶液过量的目的是 在碱性环境中能稳定存在。 在碱性环境中能稳定存在。 |
| B.搅拌操作,既可以防止因局部溶液碱性减弱,又可以使反应物充分接触,加快反应速率 |
C.该反应放热,不利于 固体析出,将装置C放入冰水浴中进行改进 固体析出,将装置C放入冰水浴中进行改进 |
D. 在水处理中仅起到净水作用 在水处理中仅起到净水作用 |
(5)装置D的作用是(用离子方程式说明)
您最近一年使用:0次
20-21高一·浙江·阶段练习
解题方法
5 . 浓盐酸与氯酸钾固体反应制氯气时发现所得气体颜色偏深,经分析该气体主要含有Cl2和ClO2两种气体。某研究性学习小组用如图所示装置分离制得混合气体,并测定两种气体的体积比。

查阅资料可知常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为1.0℃,能溶于水,不溶于浓硫酸、四氯化碳,有强氧化性,能与NaOH溶液反应生成等物质的量的两种盐,其中种为NaClO3,另外又知氯气易溶于四氯化碳或苯等有机溶剂。
(1)实验加药品前应进行的实验操作是___________ 。
(2)若装置D中试管内收集的液体为纯净物,则它的摩尔质量是___________ 。
(3)装置E及分液漏斗所连接橡皮管的作用分别是
①装置E的作用为___________ 。
②橡皮管的作用为___________ 。
(4)F中ClO2与NaOH溶液反应的离子方程式为___________ 。
(5)在一定条件下,测得浓盐酸与氯酸钾反应生成的两种气体(ClO2和Cl2的体积比为1:2,则该反应的化学方程式为___________ 。

查阅资料可知常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为1.0℃,能溶于水,不溶于浓硫酸、四氯化碳,有强氧化性,能与NaOH溶液反应生成等物质的量的两种盐,其中种为NaClO3,另外又知氯气易溶于四氯化碳或苯等有机溶剂。
(1)实验加药品前应进行的实验操作是
(2)若装置D中试管内收集的液体为纯净物,则它的摩尔质量是
(3)装置E及分液漏斗所连接橡皮管的作用分别是
①装置E的作用为
②橡皮管的作用为
(4)F中ClO2与NaOH溶液反应的离子方程式为
(5)在一定条件下,测得浓盐酸与氯酸钾反应生成的两种气体(ClO2和Cl2的体积比为1:2,则该反应的化学方程式为
您最近一年使用:0次
6 . 亚硝酸钠( )是一种常见的食品添加剂,某兴趣小组用如图所示装置制备
)是一种常见的食品添加剂,某兴趣小组用如图所示装置制备 (A中加热装置已略去)。
(A中加热装置已略去)。
① ;
; 。
。
②NO能被酸性 氧化成
氧化成 。
。
③ 暴露在空气中容易被氧化。
暴露在空气中容易被氧化。
(1)装置A中装有浓硝酸的仪器的名称为______ ,A中反应的化学方程式:______ 。
(2)装置B中Cu的作用为:______ 。(用离子方程式表示)
(3)装置C的作用是______ 。
(4)A中滴入浓硝酸之前,应先通入 一段时间,原因是
一段时间,原因是______ 。
(5)写出NO被酸性 溶液氧化的离子方程式:
溶液氧化的离子方程式:______ 。
 )是一种常见的食品添加剂,某兴趣小组用如图所示装置制备
)是一种常见的食品添加剂,某兴趣小组用如图所示装置制备 (A中加热装置已略去)。
(A中加热装置已略去)。
①
 ;
; 。
。②NO能被酸性
 氧化成
氧化成 。
。③
 暴露在空气中容易被氧化。
暴露在空气中容易被氧化。(1)装置A中装有浓硝酸的仪器的名称为
(2)装置B中Cu的作用为:
(3)装置C的作用是
(4)A中滴入浓硝酸之前,应先通入
 一段时间,原因是
一段时间,原因是(5)写出NO被酸性
 溶液氧化的离子方程式:
溶液氧化的离子方程式:
您最近一年使用:0次
2023-04-20更新
|
227次组卷
|
3卷引用:浙江省杭州市及周边重点中学2022-2023学年高一下学期期中考试化学试题
名校
7 . 二氧化氯是高效、低毒的消毒剂。已知:ClO2 是一种黄绿色易溶于水的气体,具有强氧化性,用如图装置制备ClO2及性质探究,回答下列问题:
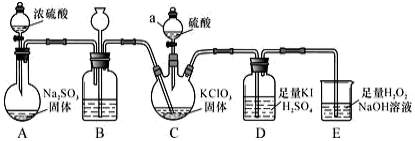
(1)仪器a的名称_______ ,装置B的作用是_______ 。
(2)装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_______ ,装置 D 中滴有几滴淀粉溶液,其作用是_______ 。
(3)科学家在此基础上用H2C2O4代替Na2SO3研究出一种新的制备ClO2方法:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2 ↑+2H2O。试回答下列问题。
①该反应中氧化产物的化学式是_______ 。
②若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为_______ ,消耗还原剂的物质的量为_______ 。
③在酸性条件下,标准状况下44. 8mL的ClO2气体恰好能与50mL0.1mol/L的Na2SO3溶液完全反应生成Na2SO4,请写出该反应的离子方程式_______ 。

(1)仪器a的名称
(2)装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为
(3)科学家在此基础上用H2C2O4代替Na2SO3研究出一种新的制备ClO2方法:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2 ↑+2H2O。试回答下列问题。
①该反应中氧化产物的化学式是
②若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为
③在酸性条件下,标准状况下44. 8mL的ClO2气体恰好能与50mL0.1mol/L的Na2SO3溶液完全反应生成Na2SO4,请写出该反应的离子方程式
您最近一年使用:0次
2021-03-19更新
|
402次组卷
|
3卷引用:浙江省淳安县汾口中学2019-2020学年高一下学期期末联考化学试题
浙江省淳安县汾口中学2019-2020学年高一下学期期末联考化学试题四川省广安代市中学校2020-2021学年高一下学期第二次月考化学试题(已下线)2021年高考化学押题预测卷(新课标Ⅰ卷)(02)(含考试版、答题卡、参考答案、全解全析)
解题方法
8 . “84”消毒液是常见的含氯消毒剂,其主要成分是次氯酸钠,在防控新冠疫情过程中发挥了重要作用。某化学兴趣小组设计了如图所示的制备装置。已知:

 。
。
请回答:
(1)连接好装置,装入药品前必须检查气密性,该装置气密性检查的具体操作是:关闭分液漏斗旋塞,往C中加水使长导管浸没,_______ ,则气密性良好。
(2)B中所加试剂的名称是_______ ,其作用是_______ 。
(3)同学甲查阅资料后发现 与NaOH的反应会放热,由此他认为NaClO的产率会较低。为此他对装置进行了改进,其改进的措施是
与NaOH的反应会放热,由此他认为NaClO的产率会较低。为此他对装置进行了改进,其改进的措施是_______ 。
(4)同学乙认为该制备装置还存在一个较大的缺点,请你指出_______ 。
(5)同学丙查阅资料发现“84”消毒液与家用清洁剂洁厕灵(主要成分为盐酸)混合使用会产生一种有毒的黄绿色气体而发生中毒事故,写出有关的离子方程式_______ 。

 。
。请回答:
(1)连接好装置,装入药品前必须检查气密性,该装置气密性检查的具体操作是:关闭分液漏斗旋塞,往C中加水使长导管浸没,
(2)B中所加试剂的名称是
(3)同学甲查阅资料后发现
 与NaOH的反应会放热,由此他认为NaClO的产率会较低。为此他对装置进行了改进,其改进的措施是
与NaOH的反应会放热,由此他认为NaClO的产率会较低。为此他对装置进行了改进,其改进的措施是(4)同学乙认为该制备装置还存在一个较大的缺点,请你指出
(5)同学丙查阅资料发现“84”消毒液与家用清洁剂洁厕灵(主要成分为盐酸)混合使用会产生一种有毒的黄绿色气体而发生中毒事故,写出有关的离子方程式
您最近一年使用:0次
20-21高一上·浙江·期中
9 . 氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用它。
(1)工业上通常采用电解法制氯气,请观察图后回答下列问题:
请写出该反应的化学方程式___________ 。
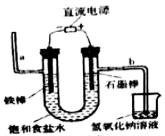
(2)某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉是一个放热反应,回答下列问题:
①漂白粉将在U形管中产生,其化学方程式是_________ ;
②装置C的作用是___________ ;
③此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,温度较高时,氯气与消石灰发生副反应生成Ca(ClO3)2。有效成分偏低的可能原因有________ ,为提高产率,可采取的措施有_______ 。
(1)工业上通常采用电解法制氯气,请观察图后回答下列问题:

请写出该反应的化学方程式
(2)某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉是一个放热反应,回答下列问题:

①漂白粉将在U形管中产生,其化学方程式是
②装置C的作用是
③此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,温度较高时,氯气与消石灰发生副反应生成Ca(ClO3)2。有效成分偏低的可能原因有
您最近一年使用:0次
19-20高二·浙江·期末
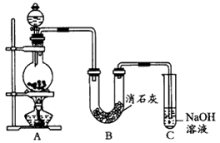
10 . 某学生设计如图实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)装置B中发生反应的化学方程式为___________ 。
(2)漂白粉将在U形管中产生,其化学反应方程式为___________ 。
(3)此实验结果所得Ca(ClO)2产率太低、经分析并查阅资料发现主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______ 。
②试判断另一个副反应是(用化学方程式表示)______ ,为避免此副反应发生,可采取的措施是________ 。

(1)装置B中发生反应的化学方程式为
(2)漂白粉将在U形管中产生,其化学反应方程式为
(3)此实验结果所得Ca(ClO)2产率太低、经分析并查阅资料发现主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
②试判断另一个副反应是(用化学方程式表示)
您最近一年使用:0次



