名校
解题方法
1 . 海洋资源的利用具有广阔前景。
(1)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是___________ 。
(2)下图是从海水中提取镁的简单流程。
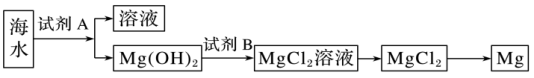
①工业上常用于沉淀Mg2+的试剂A是___________ ,Mg(OH)2转化为MgCl2的离子方程式是___________ 。
②由无水MgCl2制取Mg的化学方程式是___________ 。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带时所用的主要仪器名称是___________ 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:___________ 。
(1)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是
(2)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是
②由无水MgCl2制取Mg的化学方程式是
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带时所用的主要仪器名称是
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:
您最近一年使用:0次
解题方法
2 . 碘和碘的化合物在有机化学中十分重要,另外在医药和照相方面的用途也很广泛。海带提碘的相关流程如下所示,已知 ,请回答下列问题:
,请回答下列问题:
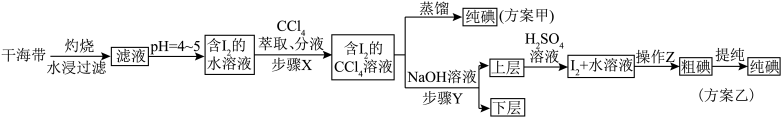
(1)海带灼烧的目的是_______ ;实验室进行此操作用到的主要仪器名称为_______ 。
(2)滤液得到含 的水溶液,除了调节
的水溶液,除了调节 ,还需要加入臭氧或过氧化氢,所加试剂在反应中作
,还需要加入臭氧或过氧化氢,所加试剂在反应中作_______ 剂(填“氧化”或“还原”),写出加入过氧化氢时发生反应的离子方程式:_______ 。
(3)步骤 是否可以用酒精代替
是否可以用酒精代替 ,并说明理由
,并说明理由_______ 。
(4)步骤 的操作为
的操作为_______ 。
(5)上层液体加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(6)以上流程中可以循环使用的试剂是_______ 。
(7)加碘食盐中的碘以碘酸钾 形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在
形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在 。可供选用的物质有:①
。可供选用的物质有:① 试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是_______ (填序号)。
 ,请回答下列问题:
,请回答下列问题:
(1)海带灼烧的目的是
(2)滤液得到含
 的水溶液,除了调节
的水溶液,除了调节 ,还需要加入臭氧或过氧化氢,所加试剂在反应中作
,还需要加入臭氧或过氧化氢,所加试剂在反应中作(3)步骤
 是否可以用酒精代替
是否可以用酒精代替 ,并说明理由
,并说明理由(4)步骤
 的操作为
的操作为(5)上层液体加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(6)以上流程中可以循环使用的试剂是
(7)加碘食盐中的碘以碘酸钾
 形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在
形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在 。可供选用的物质有:①
。可供选用的物质有:① 试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
您最近一年使用:0次
名校
解题方法
3 . 将碘单质加到普通食盐中可制成加碘食盐,经常食用可消除碘缺乏贫。___
您最近一年使用:0次
解题方法
4 . 当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一、
I.利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:
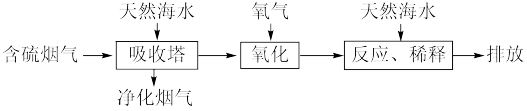
(1)天然海水(pH≈8)吸收含硫的烟气后,会溶有H2SO3、 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式_______ 。
(2)氧化后的海水需要用大量的天然海水与之混合后才能排放。该操作的主要目的是_______ 。
II.从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
(3)从离子反应的角度思考,在母液中加入石灰乳所起的作用是_______ 。
(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_______(填字母)。
III.海带中含有碘元素。从海带中提取碘的实验过程如下图:

(5)灼烧海带时盛装海带的仪器名称是_______ 。
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤_______ (填序号)中实现与碘分离。
(7)写出步骤④反应的离子方程式_______ 。
I.利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:

(1)天然海水(pH≈8)吸收含硫的烟气后,会溶有H2SO3、
 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式(2)氧化后的海水需要用大量的天然海水与之混合后才能排放。该操作的主要目的是
II.从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
(3)从离子反应的角度思考,在母液中加入石灰乳所起的作用是
(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_______(填字母)。
| A.O2 | B.N2 | C.Ar | D.水蒸气 |
III.海带中含有碘元素。从海带中提取碘的实验过程如下图:

(5)灼烧海带时盛装海带的仪器名称是
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤
(7)写出步骤④反应的离子方程式
您最近一年使用:0次
2022-07-28更新
|
192次组卷
|
2卷引用:山西省晋中市平遥县第二中学校2022-2023学年高二上学期8月质检化学试题
5 . I.海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
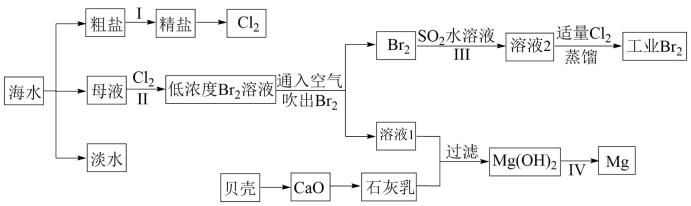
请回答下列问题:
(1)请列举除蒸馏法外海水淡化的一种方法:_______ 。
(2)步骤I中,粗盐中含有Ca2+、Mg2+、 等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______(填字母)。
等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______(填字母)。
(3)步骤II已经获得Br2,步骤III又将Br2还原为Br-,其目的是_______ 。
(4)写出步骤III反应的离子方程式:_______ 。
II.海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海带中提取碘的流程如下:

(5)灼烧所用仪器有酒精灯、泥三角、_______ (填仪器名称)。
(6)向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2;请写出该反应的离子方程式:_______ 。

请回答下列问题:
(1)请列举除蒸馏法外海水淡化的一种方法:
(2)步骤I中,粗盐中含有Ca2+、Mg2+、
 等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______(填字母)。
等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______(填字母)。| A.①②③④ | B.②③④① | C.②④③① | D.③④②① |
(4)写出步骤III反应的离子方程式:
II.海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海带中提取碘的流程如下:

(5)灼烧所用仪器有酒精灯、泥三角、
(6)向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2;请写出该反应的离子方程式:
您最近一年使用:0次
名校
6 . 从海产品中提取碘是我国工业上获取碘的重要途径,实验室证明海带中存在碘元素的方法如下:
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的_______ (填标号)。
a. b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。
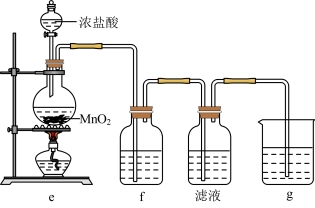
①装置e中发生反应的化学方程式是_______ 。
②装置f、g中所装的试剂分别是_______ 、_______ 。
③检验“滤液”中有碘单质生成的方法是_______ 。若通入 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是_______ 。
(3)“步骤Ⅲ”氧化剂氧化时,用 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是_______ 。
(4)若“步骤Ⅲ”所得溶液经过分离提纯获得 ,其物质的量是
,其物质的量是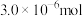 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是_______ mg/kg。
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的
a.
 b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。

①装置e中发生反应的化学方程式是
②装置f、g中所装的试剂分别是
③检验“滤液”中有碘单质生成的方法是
 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是(3)“步骤Ⅲ”氧化剂氧化时,用
 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是(4)若“步骤Ⅲ”所得溶液经过分离提纯获得
 ,其物质的量是
,其物质的量是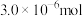 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是
您最近一年使用:0次
2022-07-20更新
|
508次组卷
|
3卷引用:山西省大同市第二中学校2023届高三上学期开学考试化学试题
解题方法
7 . 海带、紫菜等藻类植物中含有丰富的碘元素,下列叙述正确的是( )
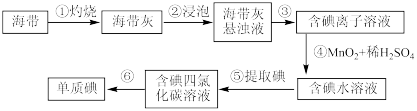

| A.加碘食盐可以使淀粉溶液变蓝 |
| B.步骤④中发生的反应为2I-+MnO2+4H+=I2+Mn2++2H2O |
C.步骤④如果用碘酸钾氧化,理论上每产生 ,转移2mol电子 ,转移2mol电子 |
| D.步骤⑤中提取碘的方法是蒸馏 |
您最近一年使用:0次
8 . 海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计以下实验方案,从海带中提取 。
。
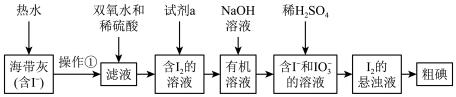
(1)灼烧海带时,需要用到的瓷质实验仪器是___________ 。
(2)如将加双氧水改为加二氧化锰也可达到实验目的,写出向滤液中加入 和稀硫酸发生反应的离子方程式:
和稀硫酸发生反应的离子方程式:___________ 。
(3)试剂a可以是___________ (填字母)。
a.乙醇 b.裂化汽油 c.四氯化碳
(4) 和
和 生成
生成 的离子方程式是
的离子方程式是___________ 。
(5)上图中,含 的溶液经3步转化为
的溶液经3步转化为 的悬浊液,其目的是
的悬浊液,其目的是___________ 。
(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:___________ 。
 。
。
(1)灼烧海带时,需要用到的瓷质实验仪器是
(2)如将加双氧水改为加二氧化锰也可达到实验目的,写出向滤液中加入
 和稀硫酸发生反应的离子方程式:
和稀硫酸发生反应的离子方程式:(3)试剂a可以是
a.乙醇 b.裂化汽油 c.四氯化碳
(4)
 和
和 生成
生成 的离子方程式是
的离子方程式是(5)上图中,含
 的溶液经3步转化为
的溶液经3步转化为 的悬浊液,其目的是
的悬浊液,其目的是(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:
您最近一年使用:0次
2022-01-26更新
|
128次组卷
|
2卷引用:山西省怀仁市大地中学高中部2021-2022学年高二下学期第三次月考化学试题
名校
解题方法
9 . 海水中含有丰富的人体不可缺少的碘元素,它以碘离子的形式存在。某学生为探究海带中碘元素的存在,按如图流程进行了实验:

回答下列问题:
(1)A步骤的操作名称是____ ;A步骤用到的主要玻璃仪器是____ (选填下列字母代号)
a.漏斗 b.分液漏斗 c.量筒 d.蒸发皿
(2)B步骤中加入的试剂是____ 。
(3)通入Cl2时反应的离子方程式为____ ,其中氧化剂是____ 。
(4)下列试剂,可用来萃取碘水中的碘的有:____ (填字母代号)
A.酒精 B.苯 C.水 D.四氯化碳

回答下列问题:
(1)A步骤的操作名称是
a.漏斗 b.分液漏斗 c.量筒 d.蒸发皿
(2)B步骤中加入的试剂是
(3)通入Cl2时反应的离子方程式为
(4)下列试剂,可用来萃取碘水中的碘的有:
A.酒精 B.苯 C.水 D.四氯化碳
您最近一年使用:0次
解题方法
10 . 海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
(1)工业上进行海水淡化有多种方法。
①蒸馏法是历史最久,技术和工艺比较成熟的海水淡化方法。图a是海水蒸馏装置示意图,仪器B的名称是___________ 。
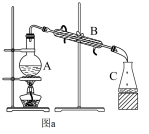
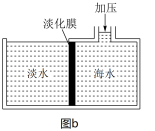
②图b是膜分离技术进行海水淡化的原理示意图。水分子可以透过淡化膜,而海水中其他各种离子不能通过淡化膜。加压后,右侧海水中减少的是________ (填序号)。
a.溶质质量 b.溶液质量 c.溶剂质量 d.溶质的物质的量浓度
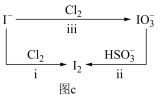
(2)碘在海水中主要以I-的形式存在,而在地壳中主要以 的形式存在(几种粒子之间的转化关系如图c所示)。
的形式存在(几种粒子之间的转化关系如图c所示)。
①以海水为原料,按方法i制取I2的离子方程式是__________ 。
②以方法ii在溶液中制取I2,反应的离子方程式是(已知:反应后所得溶液显酸性)__________ 。
③图中按iii反应后溶液中 和Cl-的个数比为1:6,则该反应中氧化剂和还原剂的物质的量之比是
和Cl-的个数比为1:6,则该反应中氧化剂和还原剂的物质的量之比是_____________ 。
(3)海藻中含有丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程的一部分。
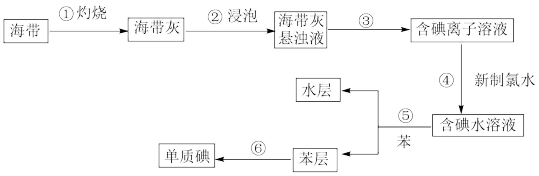
①步骤①灼烧海带时,除需三脚架外,还需要用到的实验仪器是_________ 。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
②请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:____________ 。
(1)工业上进行海水淡化有多种方法。
①蒸馏法是历史最久,技术和工艺比较成熟的海水淡化方法。图a是海水蒸馏装置示意图,仪器B的名称是



②图b是膜分离技术进行海水淡化的原理示意图。水分子可以透过淡化膜,而海水中其他各种离子不能通过淡化膜。加压后,右侧海水中减少的是
a.溶质质量 b.溶液质量 c.溶剂质量 d.溶质的物质的量浓度
(2)碘在海水中主要以I-的形式存在,而在地壳中主要以
 的形式存在(几种粒子之间的转化关系如图c所示)。
的形式存在(几种粒子之间的转化关系如图c所示)。①以海水为原料,按方法i制取I2的离子方程式是
②以方法ii在溶液中制取I2,反应的离子方程式是(已知:反应后所得溶液显酸性)
③图中按iii反应后溶液中
 和Cl-的个数比为1:6,则该反应中氧化剂和还原剂的物质的量之比是
和Cl-的个数比为1:6,则该反应中氧化剂和还原剂的物质的量之比是(3)海藻中含有丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程的一部分。

①步骤①灼烧海带时,除需三脚架外,还需要用到的实验仪器是
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
②请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
您最近一年使用:0次



