名校
1 . I.海洋是生命的摇篮,浩瀚的海洋中蕴藏着丰富的资源。人们可以从海水中提取淡水和制得镁、溴等重要的化工产品。
(1)从海水中获得淡水的主要方法有蒸馏法、离子交换法和___________ 。离子交换法净化水的过程如图所示。下列说法正确的是___________ (填序号)。
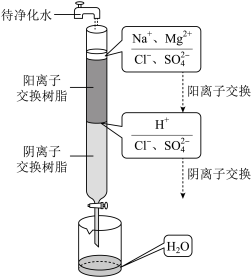
A.经过阳离子交换树脂后,水中阳离子总数
B.通过阴离子交换树脂后,水中只有 被除去
被除去
C.通过净化处理后的水,导电性增强
D.阴离子交换树脂填充段存在反应:
(2)工业上通过 制备Mg,常用的冶炼方法是
制备Mg,常用的冶炼方法是___________ 。制备溴时通入热空气可以吹出溴,是利用了溴的___________ 。
Ⅱ.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
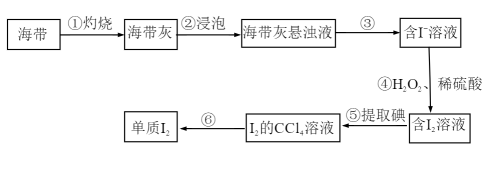
(3)实验步骤①不会用到下列仪器中的___________ (填字母)
a.泥三角 b.250ml容量瓶 c.坩埚 d.漏斗 e.酒精灯
(4)步骤③的操作名称是___________
(5)步骤④中反应的离子方程式为___________
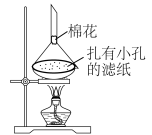
(6)利用如图装置,可以从氯化钠固体中分离出碘单质。简述原理________ ;棉花的作用是________ 。
(1)从海水中获得淡水的主要方法有蒸馏法、离子交换法和

A.经过阳离子交换树脂后,水中阳离子总数
B.通过阴离子交换树脂后,水中只有
 被除去
被除去C.通过净化处理后的水,导电性增强
D.阴离子交换树脂填充段存在反应:

(2)工业上通过
 制备Mg,常用的冶炼方法是
制备Mg,常用的冶炼方法是Ⅱ.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:

(3)实验步骤①不会用到下列仪器中的
a.泥三角 b.250ml容量瓶 c.坩埚 d.漏斗 e.酒精灯
(4)步骤③的操作名称是
(5)步骤④中反应的离子方程式为
(6)利用如图装置,可以从氯化钠固体中分离出碘单质。简述原理

您最近一年使用:0次
名校
2 . 海洋化学资源的综合利用对人类的发展意义重大。
Ⅰ.以海水为原料获得的粗盐中含有 、
、 、
、 和难溶性杂质。
和难溶性杂质。
(1)除去粗盐中可溶性杂质,加入试剂的顺序是_______ (填标号),过滤,滴加稀盐酸调节溶液呈中性。
A.


B.


C.


Ⅱ.从海藻中提取碘:
步骤一:制备含碘离子的溶液

(2)实验室焙烧海藻的装置如图,仪器A的名称是_______ 。

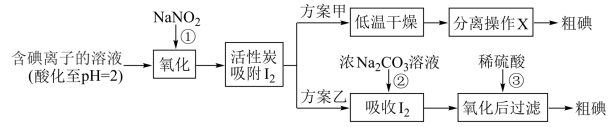
步骤二:活性炭吸附法提取碘,其流程如下:
资料显示: 时,
时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO。
,同时生成NO。
(3)写出反应①的离子方程式:_______ 。
(4)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为_______ 、_______ 。
(5)方案乙中, 浓溶液吸收
浓溶液吸收 有
有 生成,写出反应②的离子方程式:
生成,写出反应②的离子方程式:_______ 。
(6)方案乙中,已知:反应③充分进行后,过滤,滤液中仍存在少量的 、
、 。为检验滤液中的
。为检验滤液中的 ,请将下列实验方案补充完整。实验中可供选择的试剂:稀
,请将下列实验方案补充完整。实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。
A.将滤液_______ ,直到水层用淀粉溶液检验不出碘单质存在。
B.从水层取少量溶液于试管中,_______ 。
Ⅰ.以海水为原料获得的粗盐中含有
 、
、 、
、 和难溶性杂质。
和难溶性杂质。(1)除去粗盐中可溶性杂质,加入试剂的顺序是
A.



B.



C.



Ⅱ.从海藻中提取碘:
步骤一:制备含碘离子的溶液

(2)实验室焙烧海藻的装置如图,仪器A的名称是

步骤二:活性炭吸附法提取碘,其流程如下:

资料显示:
 时,
时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO。
,同时生成NO。(3)写出反应①的离子方程式:
(4)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(5)方案乙中,
 浓溶液吸收
浓溶液吸收 有
有 生成,写出反应②的离子方程式:
生成,写出反应②的离子方程式:(6)方案乙中,已知:反应③充分进行后,过滤,滤液中仍存在少量的
 、
、 。为检验滤液中的
。为检验滤液中的 ,请将下列实验方案补充完整。实验中可供选择的试剂:稀
,请将下列实验方案补充完整。实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。A.将滤液
B.从水层取少量溶液于试管中,
您最近一年使用:0次
2023-11-01更新
|
115次组卷
|
2卷引用:云南省部分名校2023-2024学年高二上学期9月大联考化学试题
名校
解题方法
3 . 海水的综合利用
海水的综合利用主要包括海水直接利用、海水淡化和海水中化学元素的利用三个方面。其中,海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素,以及从海洋植物如海带中提取碘等。
(1)海水中含量最多的卤素是___________ 。
A.氟 B.氯 C.溴 D.碘
(2)海洋中蕴藏着巨大的化学资源。下列有关海水综合利用的说法正确的是___________ 。
A.蒸发海水可以得到单质碘
B.蒸馏海水可以得到淡水
C.利用活泼金属钾可置换海水中的镁
D.电解海水可以制得金属钠
(3)下列有关从海水中提取镁的说法错误的是___________ 。
A.贝壳在海水提取镁的生产流程中,主要经历了 的过程
的过程
B.工业生产中利用电解熔融 制备镁
制备镁
C.在从海水中提取镁的工业流程中, 可循环使用,用于制备盐酸,再溶解
可循环使用,用于制备盐酸,再溶解
D.利用 将海水中的
将海水中的 转化为
转化为 沉淀,然后电解
沉淀,然后电解 制备纯镁
制备纯镁
(4)下图是海水提溴的工艺流程,下列说法错误的是___________ 。
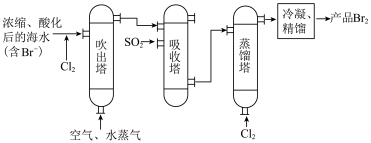
A.在海水中加“酸和氯气”,酸的作用是中和海水中的碱性物质
B .“吹出塔”中热空气的作用是将多余的氯气吹出
C.“吸收塔”中发生的反应为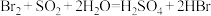
D.以上流程“吹出塔”和“吸收塔”内的反应是为了富集海水中的溴
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式___________ 。
②检验阳极产物时可选用___________ ,向阴极附近溶液滴加紫色石蕊试液呈___________ 色。
③实验测得产生的 体积(标准状况下)为5.60mL,若电解后溶液的体积为50.0mL,则溶液中NaOH的物质的量浓度为
体积(标准状况下)为5.60mL,若电解后溶液的体积为50.0mL,则溶液中NaOH的物质的量浓度为___________  。
。
(6)实验室模拟工业从海藻中提碘的流程如图:
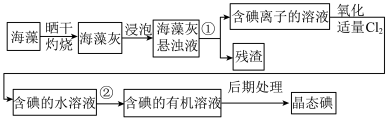
①选择合适实验操作名称填入流程图中:①___________ ,②___________ 。
A.溶解 B.过滤 C.萃取 D.分液
从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如图装置完成。
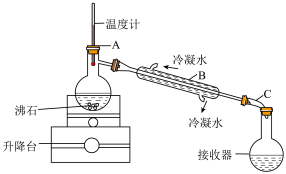
②装置中间部分是“冷凝管”,该装置中有一处明显的错误是___________ 。
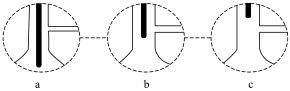
③装置A中,温度计所处的正确位置是___________ 。(选填编号)
海水的综合利用主要包括海水直接利用、海水淡化和海水中化学元素的利用三个方面。其中,海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素,以及从海洋植物如海带中提取碘等。
(1)海水中含量最多的卤素是
A.氟 B.氯 C.溴 D.碘
(2)海洋中蕴藏着巨大的化学资源。下列有关海水综合利用的说法正确的是
A.蒸发海水可以得到单质碘
B.蒸馏海水可以得到淡水
C.利用活泼金属钾可置换海水中的镁
D.电解海水可以制得金属钠
(3)下列有关从海水中提取镁的说法错误的是
A.贝壳在海水提取镁的生产流程中,主要经历了
 的过程
的过程B.工业生产中利用电解熔融
 制备镁
制备镁C.在从海水中提取镁的工业流程中,
 可循环使用,用于制备盐酸,再溶解
可循环使用,用于制备盐酸,再溶解
D.利用
 将海水中的
将海水中的 转化为
转化为 沉淀,然后电解
沉淀,然后电解 制备纯镁
制备纯镁(4)下图是海水提溴的工艺流程,下列说法错误的是

A.在海水中加“酸和氯气”,酸的作用是中和海水中的碱性物质
B .“吹出塔”中热空气的作用是将多余的氯气吹出
C.“吸收塔”中发生的反应为
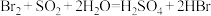
D.以上流程“吹出塔”和“吸收塔”内的反应是为了富集海水中的溴
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式
②检验阳极产物时可选用
③实验测得产生的
 体积(标准状况下)为5.60mL,若电解后溶液的体积为50.0mL,则溶液中NaOH的物质的量浓度为
体积(标准状况下)为5.60mL,若电解后溶液的体积为50.0mL,则溶液中NaOH的物质的量浓度为 。
。(6)实验室模拟工业从海藻中提碘的流程如图:

①选择合适实验操作名称填入流程图中:①
A.溶解 B.过滤 C.萃取 D.分液
从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如图装置完成。

②装置中间部分是“冷凝管”,该装置中有一处明显的错误是
③装置A中,温度计所处的正确位置是

您最近一年使用:0次
解题方法
4 .  常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
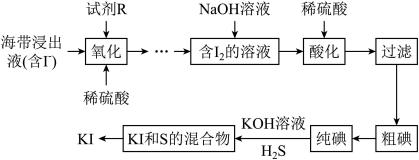
回答下列问题:
(1)“酸化”时稀硫酸的作用是___________ 。
(2)分离 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是___________ (填标号)。
(3)利用下图装置完成 与
与 反应制备
反应制备 。
。

① 溶液的作用是
溶液的作用是___________ (用离子方程式表示)。
②三颈烧瓶中产生 的正确操作顺序为
的正确操作顺序为___________ (填标号)。
a.旋开活塞K,通入 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液
(4)产品纯度测定。
准确称取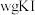 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的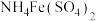 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用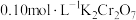 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为___________ (用含w,V的式子表示)。
 常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)“酸化”时稀硫酸的作用是
(2)分离
 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是| 选项 | 试剂 | 方法 |
| a | 二硫化碳 | 分液 |
| b | 酒精 | 分液 |
| c |  溶液 溶液 | 过滤 |
(3)利用下图装置完成
 与
与 反应制备
反应制备 。
。
①
 溶液的作用是
溶液的作用是②三颈烧瓶中产生
 的正确操作顺序为
的正确操作顺序为a.旋开活塞K,通入
 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液(4)产品纯度测定。
准确称取
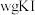 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的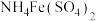 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用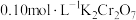 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为
您最近一年使用:0次
5 . 海洋资源的综合利用是21世纪世界海洋开发利用的重点领域之一。
(1)模拟工业制备氯气
装置如图所示,接通电源,当观察到石墨电极与滤纸接触的区域有细小的气泡产生时,停止通电。将pH试纸分别放在a、b处滤纸上,观察颜色变化。
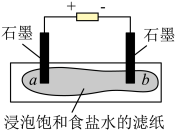
①写出“通电”时发生反应的离子方程式_______ 。
②在上述实验中观察a处pH试纸中心呈白色,边缘有一圈淡淡的红色,b处pH试纸呈_______ 色。
(2)模拟从海水提取食盐后的母液中提取溴的流程如下图:
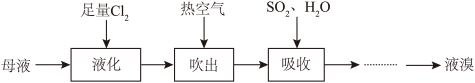
①“吸收”步骤中发生的离子反应方程式为_______ 。
②设计简单的实验验证溴的非金属性比碘强_______ 。(可供选择的试剂:溴水、碘水、NaBr溶液、KI溶液、淀粉溶液)
(3)模拟反萃取法提取碘的实验流程如下图:
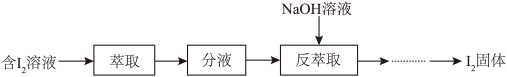
①“萃取”操作中可使用 作为
作为 的萃取剂,其原因除
的萃取剂,其原因除 不与
不与 反应外,还有
反应外,还有_______ 。
②“反萃取”操作时溶液中有 、
、 生成。该步骤发生反应的离子反应方程式:
生成。该步骤发生反应的离子反应方程式:_______ 。
(1)模拟工业制备氯气
装置如图所示,接通电源,当观察到石墨电极与滤纸接触的区域有细小的气泡产生时,停止通电。将pH试纸分别放在a、b处滤纸上,观察颜色变化。

①写出“通电”时发生反应的离子方程式
②在上述实验中观察a处pH试纸中心呈白色,边缘有一圈淡淡的红色,b处pH试纸呈
(2)模拟从海水提取食盐后的母液中提取溴的流程如下图:

①“吸收”步骤中发生的离子反应方程式为
②设计简单的实验验证溴的非金属性比碘强
(3)模拟反萃取法提取碘的实验流程如下图:

①“萃取”操作中可使用
 作为
作为 的萃取剂,其原因除
的萃取剂,其原因除 不与
不与 反应外,还有
反应外,还有②“反萃取”操作时溶液中有
 、
、 生成。该步骤发生反应的离子反应方程式:
生成。该步骤发生反应的离子反应方程式:
您最近一年使用:0次
名校
6 . 实验室用有机含碘(主要以 和
和 的形式存在)废水制备单质碘的实验流程如下:
的形式存在)废水制备单质碘的实验流程如下:
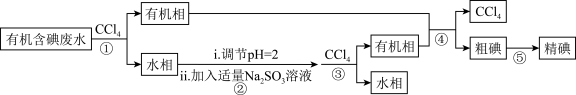
已知:碘的熔点为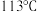 ,但固态的碘可以不经过熔化直接升华。下列说法错误的是
,但固态的碘可以不经过熔化直接升华。下列说法错误的是
 和
和 的形式存在)废水制备单质碘的实验流程如下:
的形式存在)废水制备单质碘的实验流程如下:
已知:碘的熔点为
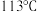 ,但固态的碘可以不经过熔化直接升华。下列说法错误的是
,但固态的碘可以不经过熔化直接升华。下列说法错误的是
| A.操作①和③中的有机相从分液漏斗下端放出 |
B.操作②中发生反应的离子方程式为 |
| C.操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、接引管及锥形瓶 |
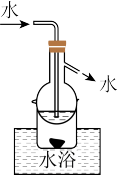
| D.操作⑤可用如图所示的水浴装置进行 |
您最近一年使用:0次
2022-09-01更新
|
134次组卷
|
2卷引用:河南省南阳市第一中学校2022-2023学年高三上学期第一次月考化学试题
名校
7 . 下列有关实验操作、现象和目的或结论的说法正确的是
选项 | 操作 | 目的或结论 |
A | 将Fe(NO3)2晶体溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红 | 检验Fe(NO3)2样品是否已被氧化而变质 |
B | 海带提碘实验中,为了制取海带灰的浸取液,需要煮沸海带灰和水的混合物1~2min | 主要目的是去除溶液中的氧气,避免氧气氧化碘离子 |
C | 在试管中依次加入2mL浓硫酸、3mL乙醇和2mL乙酸,用酒精灯缓慢加热 | 制备乙酸乙酯 |
D | 向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分振荡,白色固体溶解 | NH4+与Mg(OH)2溶解出的OH-结合,导致Mg(OH)2溶解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-03-15更新
|
885次组卷
|
2卷引用:2017届四川省成都市第七中学高三二诊模拟考试理综化学试卷
11-12高三上·浙江绍兴·阶段练习
8 . 下列结论均出自《实验化学》中的实验,其中不正确的是
| A.硫酸铜溶液中加入过量浓氨水,可得到深蓝色透明溶液 |
| B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 |
| C.提取海带中碘元素时为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
| D.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 |
您最近一年使用:0次
9 . 实验室模拟工业制法从卤水中的碘(主要以I-形式存在)提取碘产品的工艺流程如下:
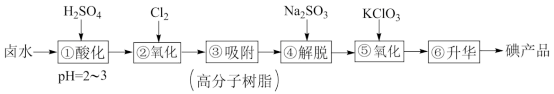
回答下列问题:
(1)实验室中常用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,所用装置如图所示:
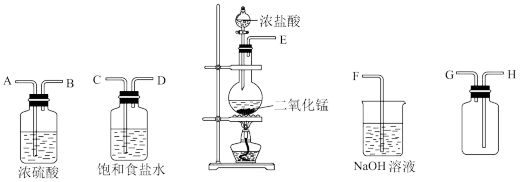
①写出气体发生装置制取氯气的化学方程式___________ 。
②连接上述仪器的正确顺序(填各接口处的字母)是:___________ 。
___________接___________;___________接___________;___________接___________;___________接___________。
③装置中,饱和食盐水的作用是___________ 。
(2)设计步骤③和④的目的是___________ 。
(3)步骤④解脱反应的离子方程式为___________ 。
(4)若②和⑤中分别得到等量I2,则消耗的m(Cl2):m(KClO3)=___________ 。

回答下列问题:
(1)实验室中常用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,所用装置如图所示:

①写出气体发生装置制取氯气的化学方程式
②连接上述仪器的正确顺序(填各接口处的字母)是:
___________接___________;___________接___________;___________接___________;___________接___________。
③装置中,饱和食盐水的作用是
(2)设计步骤③和④的目的是
(3)步骤④解脱反应的离子方程式为
(4)若②和⑤中分别得到等量I2,则消耗的m(Cl2):m(KClO3)=
您最近一年使用:0次
10 . 围绕海水的综合利用,化学课外兴趣小组进行下列实验:
(1)模拟工业制备氯气
装置如图所示,接通电源,当观察到石墨电极与滤纸接触的区域有细小的气泡产生时,停止通电。将pH试纸分别放在a、b处滤纸上,观察颜色变化。
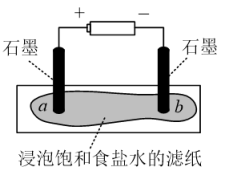
①在上述实验中观察a处pH试纸中心呈白色,边缘有一圈淡淡的红色,b处pH试纸呈___________ 色。
②实验结束后,将滤纸对折,使a、b处充分接触,可将a处残余的Cl2进一步处理。此时发生反应的化学反应方程式是___________ 。
(2)模拟反萃取法提取碘实验流程如下图:
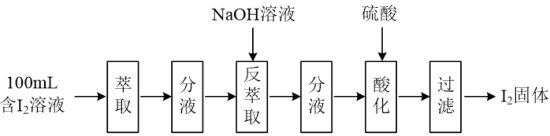
①“萃取”操作时须使用的玻璃仪器有烧杯、玻璃棒和___________ 。
②“反萃取”操作时溶液中有I-、IO 生成。“酸化”步骤发生反应的离子反应方程式为
生成。“酸化”步骤发生反应的离子反应方程式为___________ 。
(3)模拟浓海水提取镁实验流程如下图:
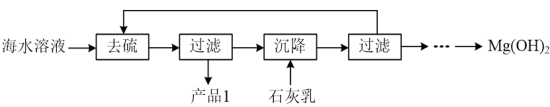
说明:模拟浓海水成分配制的“海水溶液”主要成分如下:
①产品1的化学式为___________ 。
②沉降阶段主要的化学反应方程式为___________ 。
(1)模拟工业制备氯气
装置如图所示,接通电源,当观察到石墨电极与滤纸接触的区域有细小的气泡产生时,停止通电。将pH试纸分别放在a、b处滤纸上,观察颜色变化。

①在上述实验中观察a处pH试纸中心呈白色,边缘有一圈淡淡的红色,b处pH试纸呈
②实验结束后,将滤纸对折,使a、b处充分接触,可将a处残余的Cl2进一步处理。此时发生反应的化学反应方程式是
(2)模拟反萃取法提取碘实验流程如下图:

①“萃取”操作时须使用的玻璃仪器有烧杯、玻璃棒和
②“反萃取”操作时溶液中有I-、IO
 生成。“酸化”步骤发生反应的离子反应方程式为
生成。“酸化”步骤发生反应的离子反应方程式为(3)模拟浓海水提取镁实验流程如下图:

说明:模拟浓海水成分配制的“海水溶液”主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②沉降阶段主要的化学反应方程式为
您最近一年使用:0次



