解题方法
1 . 溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。从海带中提取碘单质,工艺流程如图。
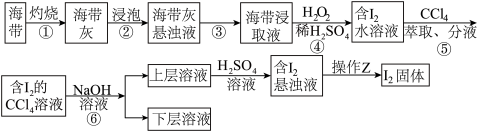
(1)步骤①操作时,除需要酒精灯、三脚架、泥三角外,还需的主要仪器是____ (填名称)。
(2)步骤⑤的具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静置、分层。
①实验步骤的正确顺序为_____→_____→_____→A→H→_____→_____→_____。____
②静置、分层后的现象为_____ 。
(3)步骤⑤中,某学生选择用CCl4来萃取碘的理由_____ 。
(4)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为_____ 。每消耗1molI2转移电子数为_____ 。
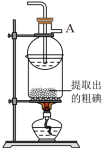
(5)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是_____ ;为得到较多较高纯度的单质碘,A容器中可盛放的试剂为_____ (填字母)。
a.冷水 b.热水 c.热氢氧化钠溶液

(1)步骤①操作时,除需要酒精灯、三脚架、泥三角外,还需的主要仪器是
(2)步骤⑤的具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静置、分层。
①实验步骤的正确顺序为_____→_____→_____→A→H→_____→_____→_____。
②静置、分层后的现象为
(3)步骤⑤中,某学生选择用CCl4来萃取碘的理由
(4)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为
(5)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是
a.冷水 b.热水 c.热氢氧化钠溶液

您最近一年使用:0次
名校
解题方法
2 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___________ (填序号)。
A.食盐 B.淡水 C.烧碱 D.纯碱 E.溴
(2)大量的镁从海水中提取,一种工业制备无水氯化镁的工艺流程如下:
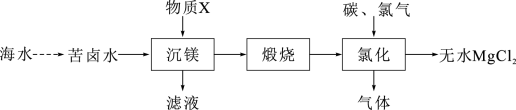
工业上常用“沉镁”物质X的是___________ ,“氯化”过程中的气态副产物常用作还原剂,“氯化”发生的化学方程式是___________ 。
(3)海带中含有碘元素。实验室提取碘的步骤如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是_______ 。海带灰中含有硫酸镁、碳酸钠等,在实验步骤___________ (填序号)中实现与碘分离。
②写出步骤④反应的离子方程式_______ 。反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈___________ 色。
③请设计实验检验用CCl4提取碘后的水溶液中是否还含有碘单质___________ (包括实验步骤、现象及结论)。
(1)无需经过化学变化就能从海水中获得的物质是
A.食盐 B.淡水 C.烧碱 D.纯碱 E.溴
(2)大量的镁从海水中提取,一种工业制备无水氯化镁的工艺流程如下:

工业上常用“沉镁”物质X的是
(3)海带中含有碘元素。实验室提取碘的步骤如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是
②写出步骤④反应的离子方程式
③请设计实验检验用CCl4提取碘后的水溶液中是否还含有碘单质
您最近一年使用:0次
2022-09-21更新
|
339次组卷
|
3卷引用:陕西师范大学附属中学2021-2022学年高一下学期期中考试化学试题
3 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。工业上从含碘海水中制备 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性 ,还原性
,还原性 。回答下列问题:
。回答下列问题:
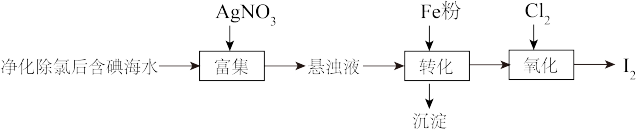
(1)海带中含有丰富的碘元素,处理时应将海带放入_______ (填仪器名称)中进行灼烧得含 的灰烬。
的灰烬。
(2)转化过程加入的Fe粉是过量的,发生的反应为: 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为_______ ;若要检验转化过程所加Fe粉是否过量,可取适量转化所得的溶液于试管中,加入_______ 溶液,观察现象。
(3)氧化过程可以用适量的酸化的 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为_______ 。用 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物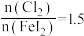 时,氧化产物为
时,氧化产物为 和
和_______ ,当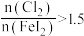 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。
(4)实验室从含碘废液(除 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
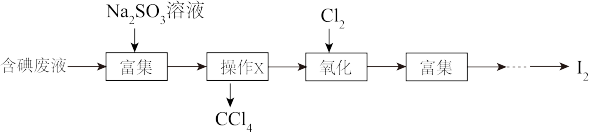
①操作X的名称为_______ 。
②向含碘废液中加入稍过量的 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是_______ 。
③氧化时,在三颈烧瓶中将含 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是_______ 。(选填字母编号)
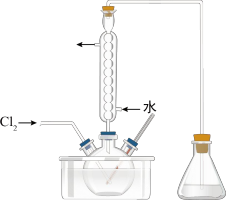
A.增大 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性 ,还原性
,还原性 。回答下列问题:
。回答下列问题:
(1)海带中含有丰富的碘元素,处理时应将海带放入
 的灰烬。
的灰烬。(2)转化过程加入的Fe粉是过量的,发生的反应为:
 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为(3)氧化过程可以用适量的酸化的
 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物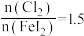 时,氧化产物为
时,氧化产物为 和
和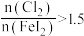 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。(4)实验室从含碘废液(除
 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
①操作X的名称为
②向含碘废液中加入稍过量的
 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是③氧化时,在三颈烧瓶中将含
 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
A.增大
 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
您最近一年使用:0次
名校
解题方法
4 . 碘是人体必需的生命元素,对人类的生长发育起着重要作用。碘主要存在于海草(如海带)、海水和盐矿中。某小组同学设计如下实验流程模拟从海草中提取碘。
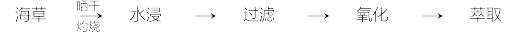
(1)灼烧海草时,除需要三脚架外,还需要用到的下列仪器有_____ (填标号字母)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥管
(2)“氧化” 是关键步骤。小组同学设计实验探究 KI 溶液的氧化反应,实验记录如表所示:
①实验Ⅰ中溶液变为浅黄色所发生反应的离子方程式是:_________________ 。
②对比实验 I 和 II,探究实验 II 反应后“溶液不变蓝”的原因,小组同学提出两种假设:
假设 1:NaClO 溶液显碱性,I2在碱性溶液发生歧化反应 3I2 +6OH-= IO3-+ 5I-+ 3H2O。
假设 2:NaClO 溶液有强氧化性,可氧化 I2。
(a)NaClO 溶液显碱性的原因:__________ (用离子方程式表示)。
(b)设计实验 III,证实假设 2 成立,所用装置如图所示,甲溶液是___________ ,实验现象是______________ 。

③小组同学又设计了如下实验:
(a)分析实验Ⅳ、Ⅴ和Ⅵ,得出影响氧气氧化 KI 溶液的反应速率的因素有 ____ 、_____ 。
(b)试解释与实验Ⅵ相比,实验Ⅴ速率较慢的原因_____________ 。
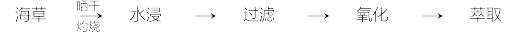
(1)灼烧海草时,除需要三脚架外,还需要用到的下列仪器有
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥管
(2)“氧化” 是关键步骤。小组同学设计实验探究 KI 溶液的氧化反应,实验记录如表所示:
| 序号 | 实验 | 操作 | 现象 |
| Ⅰ |  | 先加 0.5 mL 0.5 mol/L NaClO 溶液,后滴几滴淀粉溶液 | 溶液先变为浅黄色后溶液变蓝 |
| Ⅱ |  | 先加 0.5 mL 0.5 mol/L KI 溶液后滴几滴淀粉溶液 | 先溶液保持无色后溶液也不变蓝,且 pH=10 |
②对比实验 I 和 II,探究实验 II 反应后“溶液不变蓝”的原因,小组同学提出两种假设:
假设 1:NaClO 溶液显碱性,I2在碱性溶液发生歧化反应 3I2 +6OH-= IO3-+ 5I-+ 3H2O。
假设 2:NaClO 溶液有强氧化性,可氧化 I2。
(a)NaClO 溶液显碱性的原因:
(b)设计实验 III,证实假设 2 成立,所用装置如图所示,甲溶液是

③小组同学又设计了如下实验:
| 序号 | 实验 | 操作 | 现象 |
| Ⅳ |  | 敞口试管 | 2 小时后滴加淀粉溶液才出现蓝色 |
| Ⅴ | 敞口试管 水浴 70℃ | 20 min 溶液保持无色,冷却至室温后滴加淀粉溶液出现蓝色 | |
| Ⅵ | 密闭试管 水浴 70℃ | 溶液迅速出现黄色,且黄色逐渐加,冷却至室温后滴加淀粉溶液出现蓝色 |
(b)试解释与实验Ⅵ相比,实验Ⅴ速率较慢的原因
您最近一年使用:0次
解题方法
5 . 食盐中的加碘剂选用的是碘酸钾( )。实验室可用采用如图实验流程制备碘酸钾。
)。实验室可用采用如图实验流程制备碘酸钾。

(1)操作①的名称为______ 。
(2)操作②包括萃取、______ ,萃取后分液漏斗内的现象______ 。
(3)试剂X是18电子分子,写出溶液M与X反应的离子反应方程式为______ 。
(4)由单质碘制备碘酸钾的化学方程式为______ 。
(5)同学甲认为操作③可以用蒸馏的方法,但同学乙认为不可以,原因是______ ;于是改用下列分离法,具体流程如下:
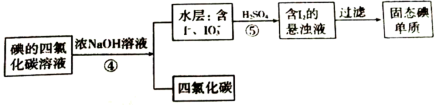
该分离方法叫______ 法,写出反应⑤离子反应方程式______ 。
 )。实验室可用采用如图实验流程制备碘酸钾。
)。实验室可用采用如图实验流程制备碘酸钾。
(1)操作①的名称为
(2)操作②包括萃取、
(3)试剂X是18电子分子,写出溶液M与X反应的离子反应方程式为
(4)由单质碘制备碘酸钾的化学方程式为
(5)同学甲认为操作③可以用蒸馏的方法,但同学乙认为不可以,原因是

该分离方法叫
您最近一年使用:0次
2021-04-10更新
|
212次组卷
|
2卷引用:山东新高考质量测评联盟2020-2021学年高一4月联考化学试题
名校
解题方法
6 . 某兴趣小组利用下列装置,进行与氯气相关的实验。
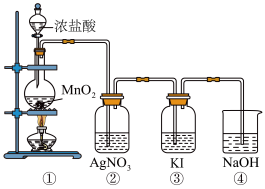
请回答:
(1)写出实验室用上述方法制取氯气的化学方程式_________ 。
(2)利用该原理和装置①进行实验,制得的氯气中往往含有的杂质可依次通入到_________ 、_________ 除去。
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2_________ (填“能”或者“否”),请说明理由_________ 。
(4)实验室从海带中提取碘的就是利用装置③的原理,请写出该溶液中发生反应的离子反应方程式_________ 。
(5)图中④所示的溶液是为了减少对环境的污染,请写出该溶液中发生反应的离子反应方程式_________ 。

请回答:
(1)写出实验室用上述方法制取氯气的化学方程式
(2)利用该原理和装置①进行实验,制得的氯气中往往含有的杂质可依次通入到
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2
(4)实验室从海带中提取碘的就是利用装置③的原理,请写出该溶液中发生反应的离子反应方程式
(5)图中④所示的溶液是为了减少对环境的污染,请写出该溶液中发生反应的离子反应方程式
您最近一年使用:0次
名校
解题方法
7 . 海洋是一座巨大的化学资源宝库,从海水中或海产品中提取多种化学物质。
I.试剂级 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程如下:
等杂质)为原料制备。制备流程如下:
(1)
焙炒海盐的目的是___________ 。
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
其中步骤2和步骤3是否可以颠倒,请给出解释:___________ 。
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

Ⅱ.实验室模拟工业从海藻中提碘的流程如图:
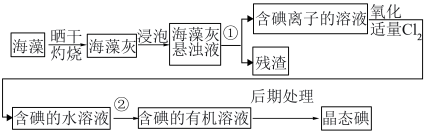
(4)选择合适实验操作名称填入流程图中:①___________ ,②___________ 。(可多选)
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误___________ 。
(6)
装置 中,温度计所处的正确位置是
中,温度计所处的正确位置是___________ 。(选填编号)

Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含 )中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:
)中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为
的沸点为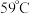 ,微溶于水,有毒。
,微溶于水,有毒。
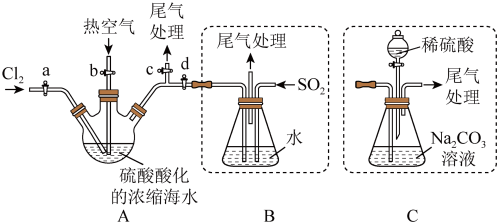
①连接 与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入
与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入 至反应完全:
至反应完全:
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量 ;
;
④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量 ;
;
⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为___________ 。
(8)进行步骤③时,B中尾气可用___________吸收处理。
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、 、
、 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(10)与B装置相比,采用C装置的优点为___________ 。
I.试剂级
 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程如下:
等杂质)为原料制备。制备流程如下:(1)

焙炒海盐的目的是
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | 略过量 |  、 、 |
| 步骤2 | 略过量 |  |
| 步骤3 | 略过量 |  |
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

| A.铂片上发生还原反应 |
| B.铂片端作阴极 |
| C.铅笔端有少量的氯气产生 |
| D.a连接的是电源负极 |
Ⅱ.实验室模拟工业从海藻中提碘的流程如图:

(4)选择合适实验操作名称填入流程图中:①
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误
(6)

装置
 中,温度计所处的正确位置是
中,温度计所处的正确位置是
Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含
 )中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:
)中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为
的沸点为 ,微溶于水,有毒。
,微溶于水,有毒。
①连接
 与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入
与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入 至反应完全:
至反应完全:②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量
 ;
;④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量
 ;
;⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为
(8)进行步骤③时,B中尾气可用___________吸收处理。
| A.水 | B.浓硫酸 | C. 溶液 溶液 | D.饱和 溶液 溶液 |
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、
 、
、 ,则该反应的化学方程式为
,则该反应的化学方程式为(10)与B装置相比,采用C装置的优点为
您最近一年使用:0次
名校
8 . 海洋化学资源的综合利用对人类的发展意义重大。
Ⅰ.以海水为原料获得的粗盐中含有 、
、 、
、 和难溶性杂质。
和难溶性杂质。
(1)除去粗盐中可溶性杂质,加入试剂的顺序是_______ (填标号),过滤,滴加稀盐酸调节溶液呈中性。
A.


B.


C.


Ⅱ.从海藻中提取碘:
步骤一:制备含碘离子的溶液

(2)实验室焙烧海藻的装置如图,仪器A的名称是_______ 。

步骤二:活性炭吸附法提取碘,其流程如下:
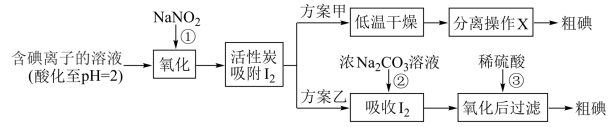
资料显示: 时,
时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO。
,同时生成NO。
(3)写出反应①的离子方程式:_______ 。
(4)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为_______ 、_______ 。
(5)方案乙中, 浓溶液吸收
浓溶液吸收 有
有 生成,写出反应②的离子方程式:
生成,写出反应②的离子方程式:_______ 。
(6)方案乙中,已知:反应③充分进行后,过滤,滤液中仍存在少量的 、
、 。为检验滤液中的
。为检验滤液中的 ,请将下列实验方案补充完整。实验中可供选择的试剂:稀
,请将下列实验方案补充完整。实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。
A.将滤液_______ ,直到水层用淀粉溶液检验不出碘单质存在。
B.从水层取少量溶液于试管中,_______ 。
Ⅰ.以海水为原料获得的粗盐中含有
 、
、 、
、 和难溶性杂质。
和难溶性杂质。(1)除去粗盐中可溶性杂质,加入试剂的顺序是
A.



B.



C.



Ⅱ.从海藻中提取碘:
步骤一:制备含碘离子的溶液

(2)实验室焙烧海藻的装置如图,仪器A的名称是

步骤二:活性炭吸附法提取碘,其流程如下:

资料显示:
 时,
时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO。
,同时生成NO。(3)写出反应①的离子方程式:
(4)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(5)方案乙中,
 浓溶液吸收
浓溶液吸收 有
有 生成,写出反应②的离子方程式:
生成,写出反应②的离子方程式:(6)方案乙中,已知:反应③充分进行后,过滤,滤液中仍存在少量的
 、
、 。为检验滤液中的
。为检验滤液中的 ,请将下列实验方案补充完整。实验中可供选择的试剂:稀
,请将下列实验方案补充完整。实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。A.将滤液
B.从水层取少量溶液于试管中,
您最近一年使用:0次
2023-11-01更新
|
113次组卷
|
2卷引用:云南省部分名校2023-2024学年高二上学期9月大联考化学试题
解题方法
9 .  常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
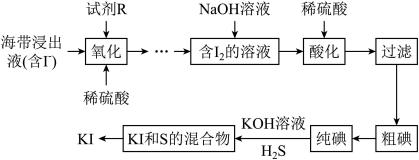
回答下列问题:
(1)“酸化”时稀硫酸的作用是___________ 。
(2)分离 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是___________ (填标号)。
(3)利用下图装置完成 与
与 反应制备
反应制备 。
。

① 溶液的作用是
溶液的作用是___________ (用离子方程式表示)。
②三颈烧瓶中产生 的正确操作顺序为
的正确操作顺序为___________ (填标号)。
a.旋开活塞K,通入 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液
(4)产品纯度测定。
准确称取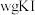 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用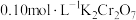 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为___________ (用含w,V的式子表示)。
 常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)“酸化”时稀硫酸的作用是
(2)分离
 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是| 选项 | 试剂 | 方法 |
| a | 二硫化碳 | 分液 |
| b | 酒精 | 分液 |
| c |  溶液 溶液 | 过滤 |
(3)利用下图装置完成
 与
与 反应制备
反应制备 。
。
①
 溶液的作用是
溶液的作用是②三颈烧瓶中产生
 的正确操作顺序为
的正确操作顺序为a.旋开活塞K,通入
 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液(4)产品纯度测定。
准确称取
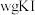 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用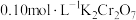 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为
您最近一年使用:0次
名校
解题方法
10 . 海水的综合利用
海水的综合利用主要包括海水直接利用、海水淡化和海水中化学元素的利用三个方面。其中,海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素,以及从海洋植物如海带中提取碘等。
(1)海水中含量最多的卤素是___________ 。
A.氟 B.氯 C.溴 D.碘
(2)海洋中蕴藏着巨大的化学资源。下列有关海水综合利用的说法正确的是___________ 。
A.蒸发海水可以得到单质碘
B.蒸馏海水可以得到淡水
C.利用活泼金属钾可置换海水中的镁
D.电解海水可以制得金属钠
(3)下列有关从海水中提取镁的说法错误的是___________ 。
A.贝壳在海水提取镁的生产流程中,主要经历了 的过程
的过程
B.工业生产中利用电解熔融 制备镁
制备镁
C.在从海水中提取镁的工业流程中, 可循环使用,用于制备盐酸,再溶解
可循环使用,用于制备盐酸,再溶解
D.利用 将海水中的
将海水中的 转化为
转化为 沉淀,然后电解
沉淀,然后电解 制备纯镁
制备纯镁
(4)下图是海水提溴的工艺流程,下列说法错误的是___________ 。
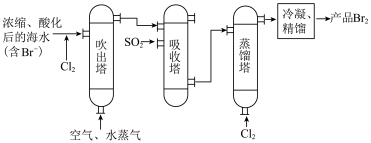
A.在海水中加“酸和氯气”,酸的作用是中和海水中的碱性物质
B .“吹出塔”中热空气的作用是将多余的氯气吹出
C.“吸收塔”中发生的反应为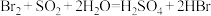
D.以上流程“吹出塔”和“吸收塔”内的反应是为了富集海水中的溴
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式___________ 。
②检验阳极产物时可选用___________ ,向阴极附近溶液滴加紫色石蕊试液呈___________ 色。
③实验测得产生的 体积(标准状况下)为5.60mL,若电解后溶液的体积为50.0mL,则溶液中NaOH的物质的量浓度为
体积(标准状况下)为5.60mL,若电解后溶液的体积为50.0mL,则溶液中NaOH的物质的量浓度为___________  。
。
(6)实验室模拟工业从海藻中提碘的流程如图:
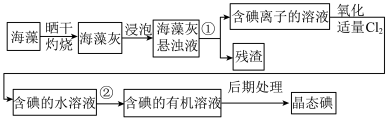
①选择合适实验操作名称填入流程图中:①___________ ,②___________ 。
A.溶解 B.过滤 C.萃取 D.分液
从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如图装置完成。
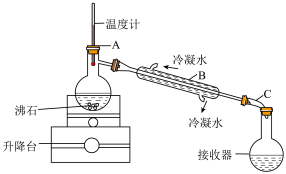
②装置中间部分是“冷凝管”,该装置中有一处明显的错误是___________ 。
③装置A中,温度计所处的正确位置是___________ 。(选填编号)
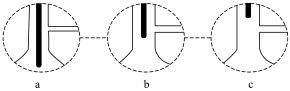
海水的综合利用主要包括海水直接利用、海水淡化和海水中化学元素的利用三个方面。其中,海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素,以及从海洋植物如海带中提取碘等。
(1)海水中含量最多的卤素是
A.氟 B.氯 C.溴 D.碘
(2)海洋中蕴藏着巨大的化学资源。下列有关海水综合利用的说法正确的是
A.蒸发海水可以得到单质碘
B.蒸馏海水可以得到淡水
C.利用活泼金属钾可置换海水中的镁
D.电解海水可以制得金属钠
(3)下列有关从海水中提取镁的说法错误的是
A.贝壳在海水提取镁的生产流程中,主要经历了
 的过程
的过程B.工业生产中利用电解熔融
 制备镁
制备镁C.在从海水中提取镁的工业流程中,
 可循环使用,用于制备盐酸,再溶解
可循环使用,用于制备盐酸,再溶解
D.利用
 将海水中的
将海水中的 转化为
转化为 沉淀,然后电解
沉淀,然后电解 制备纯镁
制备纯镁(4)下图是海水提溴的工艺流程,下列说法错误的是

A.在海水中加“酸和氯气”,酸的作用是中和海水中的碱性物质
B .“吹出塔”中热空气的作用是将多余的氯气吹出
C.“吸收塔”中发生的反应为
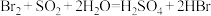
D.以上流程“吹出塔”和“吸收塔”内的反应是为了富集海水中的溴
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式
②检验阳极产物时可选用
③实验测得产生的
 体积(标准状况下)为5.60mL,若电解后溶液的体积为50.0mL,则溶液中NaOH的物质的量浓度为
体积(标准状况下)为5.60mL,若电解后溶液的体积为50.0mL,则溶液中NaOH的物质的量浓度为 。
。(6)实验室模拟工业从海藻中提碘的流程如图:

①选择合适实验操作名称填入流程图中:①
A.溶解 B.过滤 C.萃取 D.分液
从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如图装置完成。

②装置中间部分是“冷凝管”,该装置中有一处明显的错误是
③装置A中,温度计所处的正确位置是

您最近一年使用:0次



