广东省执信中学2021届高三上学期第二次月考化学试题
广东
高三
阶段练习
2020-11-08
721次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、有机化学基础、化学实验基础、物质结构与性质、化学反应原理
广东省执信中学2021届高三上学期第二次月考化学试题
广东
高三
阶段练习
2020-11-08
721次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、有机化学基础、化学实验基础、物质结构与性质、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
1. 下列说法正确的是
| A.酸性氧化物不一定是非金属氧化物,碱性氧化物-定是金属氧化物 |
| B.有化学键断裂的变化一定是化学变化 |
| C.胶体区别其他分散系的本质特征是丁达尔效应 |
| D.Na2CO3·10H2O的风化是物理变化 |
您最近一年使用:0次
2020-11-04更新
|
188次组卷
|
2卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
单选题
|
较易(0.85)
名校
2. 下列说法正确的是
| A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅 |
| B.金属钠着火时,可用泡沫灭火器或干燥的沙土灭火 |
| C.玻璃是混合物,没有固定的熔点 |
| D.N和P是植物营养素,海洋或湖泊中N、P含量越高越有利于水生动植物的生长 |
您最近一年使用:0次
2020-11-04更新
|
199次组卷
|
2卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
单选题
|
适中(0.65)
真题
名校
3. 下列有关实验操作的叙述正确的是:


| A.实验室常用右图所示的装置制取少量的乙酸乙酯 |
| B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液 |
| C.用量筒量取5.00mL1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol·L-1盐酸 |
| D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
您最近一年使用:0次
2019-01-30更新
|
1730次组卷
|
8卷引用:2009年普通高等学校招生统一考试化学试题(江苏卷)
2009年普通高等学校招生统一考试化学试题(江苏卷)2009高考真题汇编-化学实验常用仪器和基本操作(已下线)2010届天津新华中学高三下学期第四次月考化学试卷(已下线)2014年高考化学苏教版总复习 10-4 化学实验方案设计与评价练习卷福建省莆田第六中学2017-2018学年高二6月月考化学试题A2020年安徽省全省教学质量检测统一考试(练习检测一)广东省执信中学2021届高三上学期第二次月考化学试题(已下线)第10周 周测卷-备战2022年高考化学周测与晚练(新高考专用)
单选题
|
较易(0.85)
名校
解题方法
4. 下列分离提纯实验不能达到目的的是
| A.除去乙酸乙酯中少量乙酸:加入乙醇和浓硫酸,使乙酸转化为乙酸乙酯 |
| B.除去氯气中的水蒸气:将气体通过装有浓硫酸的洗气瓶 |
| C.海水淡化:将海水进行蒸馏 |
| D.提取溶解在水中的少量碘:加入四氯化碳振荡、静置、分层后取出有机层再分离 |
您最近一年使用:0次
2020-11-04更新
|
185次组卷
|
3卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 设NA为阿伏加德罗常数,下列说法正确的是
| A.1mol过氧化钠中含有的阴离子为2NA |
| B.乙烯和环丙烷组成的28g混合气体中含有3NA个氢原子 |
| C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| D.0.1mol水中,含有0.4NA氢键 |
您最近一年使用:0次
2020-11-04更新
|
189次组卷
|
2卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
您最近一年使用:0次
2020-11-04更新
|
160次组卷
|
2卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
单选题
|
较易(0.85)
名校
7. 下列离子方程式正确的是
A.将过量SO2气体通入NaClO溶液中:SO2+H2O+ClO-= +Cl-+2H+ +Cl-+2H+ |
| B.Cl2通入水中:Cl2+H2O=2H++C1-+ClO- |
C.NaHCO3溶液水解: +H2O= +H2O= +H3O+ +H3O+ |
D.小苏打溶液中加入过量澄清石灰水:2 +Ca2++2OH-=CaCO3↓+2H2O+ +Ca2++2OH-=CaCO3↓+2H2O+ |
您最近一年使用:0次
2020-11-04更新
|
305次组卷
|
4卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
广东省执信中学2021届高三上学期第二次月考化学试题广东省揭阳普宁二中2021届上学期高三第三次月考化学试题(已下线)2022年浙江1月高考真题变式题(11-20)广东省广州英豪学校2020-2021学年高三上学期9月月考化学试题
单选题
|
适中(0.65)
名校
8. 下列关于有机物的说法错误的是
| A.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量不相等 |
| B.光照下2,2-二甲基丙烷与Br2反应其一溴取代物只有一种 |
| C.纤维素乙酸酯、油脂和蛋白质在一定条件都能水解 |
| D.甲烷中的乙烯杂质可将气体通过溴的四氯化碳溶液来除杂 |
您最近一年使用:0次
2020-11-04更新
|
189次组卷
|
2卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
单选题
|
较易(0.85)
名校
9. X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 ( )
| A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 |
| B.元素X不能与元素Y形成化合物X2Y2 |
| C.元素Y、R分别与元素X形成的化合物的沸点:XmY>XmR |
| D.元素W、R的最高价氧化物的水化物都是强酸 |
您最近一年使用:0次
2020-05-21更新
|
267次组卷
|
21卷引用:2011-2012学年四川成都外国语学校高一下学期期中考试化学试卷
(已下线)2011-2012学年四川成都外国语学校高一下学期期中考试化学试卷(已下线)2013届北京市通州区高三年级上学期期末摸底考试化学试卷2015届山东省淄博七中高三上学期期中考试化学试卷2014-2015江苏省启东中学高二下学期期中考试化学试卷2015-2016学年黑龙江省哈尔滨六中高一下期中化学试卷2016-2017学年辽宁省盘锦中学高二上期初考试化学卷四川省威远中学2019-2020学年高二上学期第二次月考化学试题云南省普洱市普洱第二中学2019—2020学年高一上学期期末考试化学试题2020年春季人教版高中化学必修2第一章《物质结构 元素周期律》测试卷山西省大同市天镇一中2019-2020学年高二上学期期中考试化学试题湖南省常德市桃花源一中2019-2020学年高一下学期期中考试化学试题甘肃省会宁县第一中学2019-2020学年高一下学期第一次月考化学试题吉林省辽源市辽县第一高级中学2019-2020高一下学期期中考试化学试题广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题安徽省安庆市第二中学2019-2020学年高一下学期期中考试化学试题吉林省四平市公主岭范家屯镇第一中学2019-2020学年高一期中考试化学试题宁夏银川市宁夏大学附属中学2019-2020学年高一下学期期中考试化学试题河南省新乡市辉县市第二高级中学2019-2020学年高一下学期第一次月考试化学试题(A部)广东省执信中学2021届高三上学期第二次月考化学试题广东省河源中学2021届高三上学期第二次质量检测化学试题(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)
单选题
|
适中(0.65)
名校
10. 下列叙述不正确的是
| A.珠港澳大桥桥底镶嵌锌块,锌作负极,以防大桥被腐蚀 |
| B.精炼铜工业中,当阳极通过的电子数为2NA,阴极析出的铜为1mol |
| C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- |
| D.金属表面覆盖保护层,保护层破损后,就完全失去了对金属的保护作用 |
【知识点】 金属的电化学腐蚀与防护
您最近一年使用:0次
2020-11-04更新
|
259次组卷
|
3卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
11. 由下列实验及现象得出的结论正确的是
| 实验 | 现象 | 结论 | |
| A | SO2 与H2S气体混合 | 产生淡黄色沉淀 | 氧化性: SO2>S |
| B | 向盛有FeSO4溶液的试管中滴入氯水,然后滴入KSCN溶液 | 滴入KSCN后溶液变为红色 | 原FeSO4溶液已被空气中O2氧化变质 |
| C | 试管中盛有Cu(NO3)2溶液,底部有少量铜,向其中加入稀硫酸 | 铜粉逐渐溶解 | 铜可与稀硫酸反应 |
| D | 向2 支盛有2mL 相同浓度的NaOH溶液的试管中分别滴入2滴相同浓度的AlCl3和MgCl2溶液,振荡并静置 | 前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-03-16更新
|
431次组卷
|
4卷引用:广东省佛山市2018届高三下学期综合能力测试(二)化学试题
单选题
|
适中(0.65)
名校
12. 已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12。下列有关说法正确的是(溶解度以mol/L表示)
A.25℃时,在c(Cl-)=c( )=0.001mol/L的溶液中逐滴加入AgNO3溶液,首先生成Ag2CrO4(黄色)沉淀 )=0.001mol/L的溶液中逐滴加入AgNO3溶液,首先生成Ag2CrO4(黄色)沉淀 |
| B.25°C时,AgCl的溶解度小于Ag2CrO4的溶解度 |
| C.在AgCl中加入稀K2CrO4溶液,搅拌,转化为黄色Ag2CrO4沉淀 |
| D.25℃时,与水中相比,AgCl在AgNO3溶液中的溶解度、Ksp均要小 |
【知识点】 溶度积 沉淀转化解读 溶度积常数与溶解度的关系解读
您最近一年使用:0次
2020-11-04更新
|
349次组卷
|
3卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
单选题
|
适中(0.65)
名校
13. 化合物W、X、Y、Z的分子式均为C7H8,Z的空间结构类似于篮子。 下列说法正确的是
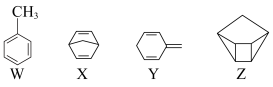

| A.Z的一氯代物只有3种 |
| B.化合物W的同分异构体只有X、Y、Z |
| C.X、Y、Z均可与酸性KMnO4溶液反应 |
| D.1molX、1molY与足量Br2/CCl4溶液反应最多消耗Br2均为2mol |
【知识点】 含碳碳双键物质的性质的推断解读
您最近一年使用:0次
2018-05-21更新
|
918次组卷
|
13卷引用:广东省佛山市2018届高三下学期综合能力测试(二)化学试题
广东省佛山市2018届高三下学期综合能力测试(二)化学试题福建省漳州市2018届高三下学期第二次调研测试(3月)化学试题【全国市级联考】天津市红桥区2018届高三下学期第二次模拟考试化学试题【全国百强校】辽宁省沈阳市东北育才学校2017-2018学年高二下学期第二阶段考试化学试题【全国百强校】河南省新乡市铁一中2019届高三上学期一轮复习阶段测试卷(七)化学试题广东省执信中学2021届高三上学期第二次月考化学试题江西省南昌市新建区第二中学2020-2021学年高二上学期“新星计划”体验营10月考化学试题(已下线)考点37 烃-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点37 烃和卤代烃-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时58 烃和卤代烃-2022年高考化学一轮复习小题多维练(全国通用)安徽省合肥市第一中学2021-2022学年高三上学期10月月考化学试题黑龙江省哈尔滨工业大学附属中学校2021-2022学年高二上学期期末考试化学试题广东省广州英豪学校2020-2021学年高三上学期9月月考化学试题
单选题
|
较易(0.85)
名校
14. 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如图所示,下列说法不正确的是
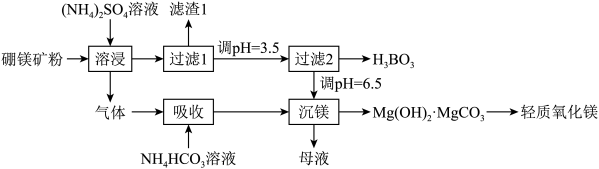

| A.“溶浸"硼镁矿粉过程中产生的气体经“吸收”转变为(NH4)2CO3 |
| B.“滤渣1”的主要成分有SiO2、Fe2O3、Al2O3 |
| C.在“过滤2”前,将溶液pH调节至3.5,目的是使Fe3+转变为Fe(OH)3除去 |
| D.母液经加热后可返回溶浸工序循环使用 |
您最近一年使用:0次
2020-11-04更新
|
243次组卷
|
3卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
单选题
|
适中(0.65)
名校
15. 最近报道的一种处理垃圾渗滤液并用其发电的示意图如下。装置工作时,下列说法不正确的是
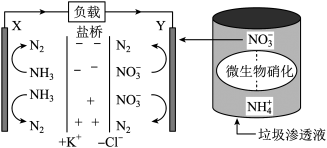

| A.盐桥中Cl-向Y 极移动 |
| B.化学能转变为电能 |
| C.电子由X 极沿导线流向Y 极 |
| D.Y 极发生的反应为2NO3-+10e- +12H+=N2+6H2O,周围pH 增大 |
您最近一年使用:0次
2018-03-16更新
|
693次组卷
|
5卷引用:广东省佛山市2018届高三下学期综合能力测试(二)化学试题
单选题
|
较难(0.4)
名校
16. 物质的量浓度相同的三种一元弱酸HX、HY、HZ及一种一元强酸还有纯水,分别加入相同浓度的NaOH溶液, 与pH的关系如下图所示。
与pH的关系如下图所示。

下列说法正确的是
 与pH的关系如下图所示。
与pH的关系如下图所示。
下列说法正确的是
| A.①为强酸的滴定曲线 |
| B.酸性:HX>HY>HZ |
| C.滴定HX溶液可用甲基橙作指示剂 |
D.HZ+Y HY+Z的平衡常数为K=1×103 HY+Z的平衡常数为K=1×103 |
您最近一年使用:0次
2020-11-04更新
|
1148次组卷
|
3卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
17. MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:
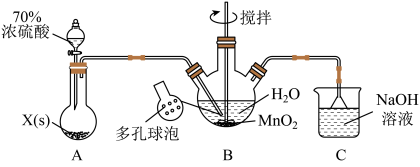
①A装置中固体药品X(正盐)通常是___________ (填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是_____________ 。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),趁热振荡,溶液显紫色,发生反应的离子方程式为__________ 。
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。
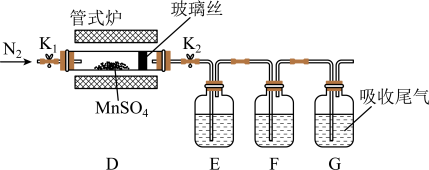
①检验分解的气态产物中是否有SO2及SO3装置E、F中的溶液依次是________ (填字母)。
a.Ba(NO3)2溶液b.BaCl2溶液c.品红溶液d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为__________________ 。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要__________________ 。
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:

①A装置中固体药品X(正盐)通常是
②B装置中通SO2的导管末端接多孔球泡的目的是
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),趁热振荡,溶液显紫色,发生反应的离子方程式为
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。

①检验分解的气态产物中是否有SO2及SO3装置E、F中的溶液依次是
a.Ba(NO3)2溶液b.BaCl2溶液c.品红溶液d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要
您最近一年使用:0次
2020-11-04更新
|
250次组卷
|
2卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
解答题-原理综合题
|
适中(0.65)
名校
解题方法
18. 甲烷水蒸气催化重整是制备高纯氢的方法之一。
(1)甲烷水蒸气催化重整发生如下反应:
i.CH4(g)+H2O(g) CO(g)+3H2(g)△H=+206kJ/mol
CO(g)+3H2(g)△H=+206kJ/mol
ii.CH4(g)+2H2O(g) CO2(g)+4H2(g)△H=+165kJ/mol
CO2(g)+4H2(g)△H=+165kJ/mol
把甲烷和水蒸气按物质的量之比1:3通入反应器中,其它条件不变,在不同温度下探究CaO对平衡时干燥出口气中H2物质的量分数的影响,结果如下:
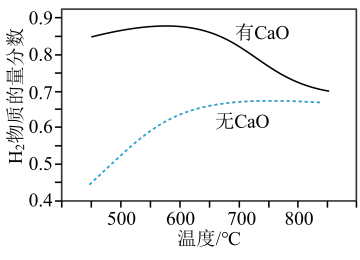
①反应i平衡常数:K(500℃)_________ K(700°C)(填“大于”、“等于”或“小于”)。
②在400~600°C范围内,反应器中有CaO能大幅提高H2物质的量分数,原因是___________ (用化学方程式表示);600℃后,随温度升高,氢气的物质的量分数逐渐降低,主要原因是__________ (填标号)。
A.催化剂活性降低B.体系中CO2浓度增大C.反应i和ii平衡向右移动
③某温度下,在体积为1L的容器中加入1molCH4、3mol水蒸气进行催化重整反应,达到平衡时CH4的总转化率为80%,CO的浓度为0.2mol/L。H2的平衡浓度为____ mol/L;反应ii的平衡常数为_____ mol2/L2(保留一位小数)。
(2)一种高性能甲烷燃料电池的工作原理如图所示。负极区发生的电极反应有____ 。电路中转移2mol电子,消耗氧气的体积为_____ L(标准状况)。

(1)甲烷水蒸气催化重整发生如下反应:
i.CH4(g)+H2O(g)
 CO(g)+3H2(g)△H=+206kJ/mol
CO(g)+3H2(g)△H=+206kJ/molii.CH4(g)+2H2O(g)
 CO2(g)+4H2(g)△H=+165kJ/mol
CO2(g)+4H2(g)△H=+165kJ/mol把甲烷和水蒸气按物质的量之比1:3通入反应器中,其它条件不变,在不同温度下探究CaO对平衡时干燥出口气中H2物质的量分数的影响,结果如下:

①反应i平衡常数:K(500℃)
②在400~600°C范围内,反应器中有CaO能大幅提高H2物质的量分数,原因是
A.催化剂活性降低B.体系中CO2浓度增大C.反应i和ii平衡向右移动
③某温度下,在体积为1L的容器中加入1molCH4、3mol水蒸气进行催化重整反应,达到平衡时CH4的总转化率为80%,CO的浓度为0.2mol/L。H2的平衡浓度为
(2)一种高性能甲烷燃料电池的工作原理如图所示。负极区发生的电极反应有

您最近一年使用:0次
2020-11-04更新
|
260次组卷
|
2卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
解答题-工业流程题
|
适中(0.65)
名校
19. 一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:

(1)“煅烧氧化”时,1molMnO完全转化为Na2MnO4失去电子的物质的量为____ mol;MnO2煅烧反应的化学方程式为______________ 。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________ 。
(3)“调pH”是将溶液pH调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应生成MnO2和____________ 。
(4)“还原”时有无机含氧酸盐生成,反应的化学方程式为___________ 。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1:准确称取mg产品,加入c1mol/LNa2C2O4溶液V1mL(过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2:用c2mol/LKMnO4标准溶液滴定剩余的Na2C2O4,滴定至终点时消耗KMnO4标准溶液VmL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+l0CO2↑+K2SO4+8H2O)
步骤2达滴定终点时的判断依据是___________ ,产品中MnO2的质量分数为w(MnO2)=______ (列出计算表达式即可)。

(1)“煅烧氧化”时,1molMnO完全转化为Na2MnO4失去电子的物质的量为
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有
(3)“调pH”是将溶液pH调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应生成MnO2和
(4)“还原”时有无机含氧酸盐生成,反应的化学方程式为
(5)测定产品中MnO2质量分数的步骤如下:
步骤1:准确称取mg产品,加入c1mol/LNa2C2O4溶液V1mL(过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2:用c2mol/LKMnO4标准溶液滴定剩余的Na2C2O4,滴定至终点时消耗KMnO4标准溶液VmL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+l0CO2↑+K2SO4+8H2O)
步骤2达滴定终点时的判断依据是
您最近一年使用:0次
2020-11-04更新
|
300次组卷
|
2卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
解答题-结构与性质
|
适中(0.65)
名校
20. 硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________ ,第四电离能I4(Co) < I4(Fe),其原因是______________________________ ;Co 与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是___________________________________________________ .
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______ ,中心原子杂化方式是_______ ,与其互为等电子体的分子是_______ (举1例)。
(3)K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是___________________________________________________________________ 。
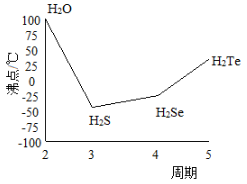
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图象所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。
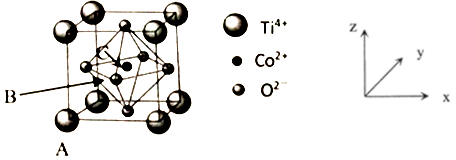
①已知A点的原子坐标参数为为(0,0,0),B点为(1/2,0,1/2),则C点的原子坐标参数为_____ 。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____ g/cm3(列出计算表达式即可)。
(1)基态Co原子价电子轨道排布式为
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是
(3)K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图象所示变为的原因是

(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(1/2,0,1/2),则C点的原子坐标参数为
②已知晶胞参数为a=0.5485nm,则该晶体的密度为
您最近一年使用:0次
2018-12-19更新
|
202次组卷
|
2卷引用:【全国百强校】内蒙古第一机械制造(集团)有限公司第一中学2019届高三上学期12月月考理科综合化学试题
解答题-有机推断题
|
适中(0.65)
名校
21. 化合物G是一种药物合成中间体,其合成路线如下:
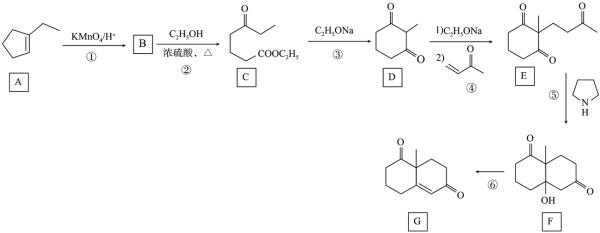
回答下列问题:
(1)A中的官能团名称是___________ 。
(2)①和⑤的反应类型分别是_____________ 。
(3)②的反应方程式是_________________ 。
(4)③除生成D外,另一生成物的结构简式是__________________ 。
(5)反应⑥所需的试剂和条件是______________ 。
(6)X是D的同分异构体,写出具有五元环结构、能发生银镜反应且核磁共振氢谱有四组峰的X的结构简式:_____________ (写出2个)。
(7)设计由丙烯和苯甲酸乙酯制备化合物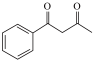 的合成路线
的合成路线___________ (无机试剂任选)。

回答下列问题:
(1)A中的官能团名称是
(2)①和⑤的反应类型分别是
(3)②的反应方程式是
(4)③除生成D外,另一生成物的结构简式是
(5)反应⑥所需的试剂和条件是
(6)X是D的同分异构体,写出具有五元环结构、能发生银镜反应且核磁共振氢谱有四组峰的X的结构简式:
(7)设计由丙烯和苯甲酸乙酯制备化合物
 的合成路线
的合成路线
您最近一年使用:0次
2020-11-04更新
|
360次组卷
|
3卷引用:广东省执信中学2021届高三上学期第二次月考化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、化学与STSE、有机化学基础、化学实验基础、物质结构与性质、化学反应原理
试卷题型(共 21题)
题型
数量
单选题
16
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 酸、碱、盐、氧化物的概念及其相互联系 胶体的性质和应用 物理变化与化学变化 | |
| 2 | 0.85 | 钠单质的保存与用途 氧化铝的物理性质与用途 化学科学对人类文明发展的意义 玻璃 | |
| 3 | 0.65 | 乙酸乙酯制备实验的装置及操作 配制一定物质的量浓度的溶液实验的仪器 萃取和分液 | |
| 4 | 0.85 | 物质的分离、提纯 物质分离、提纯的常见化学方法 萃取和分液 海水淡化 | |
| 5 | 0.65 | 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 含有氢键的物质 | |
| 6 | 0.65 | 离子反应的发生条件 离子共存 | |
| 7 | 0.85 | 离子反应的发生及书写 离子反应的发生条件 离子方程式的书写 离子方程式的正误判断 | |
| 8 | 0.65 | 同分异构体的数目的确定 乙烯的加成反应 油脂的性质 蛋白质的水解 | |
| 9 | 0.85 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 “位构性”关系理解及应用 | |
| 10 | 0.65 | 金属的电化学腐蚀与防护 | |
| 11 | 0.65 | Fe2+的鉴别及其应用 化学实验方案的设计与评价 综合实验设计与评价 | |
| 12 | 0.65 | 溶度积 沉淀转化 溶度积常数与溶解度的关系 | |
| 13 | 0.65 | 含碳碳双键物质的性质的推断 | |
| 14 | 0.85 | 物质分离、提纯综合应用 常见无机物的制备 物质制备的探究 | |
| 15 | 0.65 | 原电池 原电池原理理解 电极材料的特殊性质对原电池正负极判断的影响 | |
| 16 | 0.4 | 酸碱中和滴定指示剂选择 一元强酸与一元弱酸的比较 电离平衡常数及影响因素 | |
| 二、解答题 | |||
| 17 | 0.65 | 二氧化硫的制备 铝热反应 物质性质的探究 物质制备的探究 | 实验探究题 |
| 18 | 0.65 | 温度对化学平衡移动的影响 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 烃燃料电池 | 原理综合题 |
| 19 | 0.65 | 氧化还原反应方程式的配平 物质分离、提纯综合应用 常见无机物的制备 探究物质组成或测量物质的含量 | 工业流程题 |
| 20 | 0.65 | 轨道表示式 电离能变化规律 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 21 | 0.65 | 根据要求书写同分异构体 逆合成分析法 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |

 、
、 、
、

