四川省成都实验中学2021届高三上学期11月月考理综化学试题
四川
高三
阶段练习
2020-12-23
137次
整体难度:
适中
考查范围:
化学实验基础、有机化学基础、常见无机物及其应用、认识化学科学、物质结构与性质、化学反应原理
四川省成都实验中学2021届高三上学期11月月考理综化学试题
四川
高三
阶段练习
2020-12-23
137次
整体难度:
适中
考查范围:
化学实验基础、有机化学基础、常见无机物及其应用、认识化学科学、物质结构与性质、化学反应原理
一、单选题 添加题型下试题
单选题
|
较易(0.85)
解题方法
1. 明代《本草纲目》中对民间酿酒有如下叙述:“凡酸杯之酒,皆可蒸烧。”这里用到的操作方法可用于分离
| A.丙烯酸甲酯和丙烯酸 |
| B.对硝基甲苯和HNO3溶液 |
| C.硝酸钾和氯化钠 |
| D.氯化铵和碳酸铵 |
您最近一年使用:0次
2020-12-16更新
|
151次组卷
|
2卷引用:四川省成都实验中学2021届高三上学期11月月考理综化学试题
单选题
|
较难(0.4)
名校
2. 1,1-二环丙基乙烯(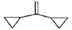 )是重要医药中间体,下列关于该化合物的说法错误的是
)是重要医药中间体,下列关于该化合物的说法错误的是
 )是重要医药中间体,下列关于该化合物的说法错误的是
)是重要医药中间体,下列关于该化合物的说法错误的是| A.所有碳原子不能在同一平面 | B.能被酸性高锰酸钾溶液氧化 |
| C.二氯代物只有3种 | D.生成1 molC8H18至少需要3molH2 |
您最近一年使用:0次
2019-02-05更新
|
1922次组卷
|
4卷引用:【市级联考】广东省茂名市2019届高三上学期第一次综合测试理科综合化学试题
单选题
|
适中(0.65)
真题
名校
3. 用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
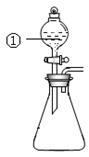

| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
6065次组卷
|
47卷引用:2015年全国普通高等学校招生统一考试化学(新课标II卷)
2015年全国普通高等学校招生统一考试化学(新课标II卷)2016届山西省忻州市第一中学高三上学期第一次月考化学试卷2016届四川省雅安中学高三9月月考化学试卷2016届甘肃省天水市秦安县第二中学高三上第一次检测考试化学试卷2016届河南省三门峡市陕州中学高三上学期第一次精英对抗赛化学试卷2016届江苏省海门中学高三上学期9月学情调研化学试卷2016届西藏拉萨中学高三上学期第二次月考化学试卷2016届江西省高安市第二中学高三上学期第二次段考化学试卷2016届福建省厦门第一中学高三上学期期中考试化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测一化学试卷2016届吉林省吉林大学附属中学高三上第一次摸底考试化学试卷2016届广东省汕头金山中学高三上期末理综化学试卷2017届西藏自治区拉萨中学高三上第一次月考化学卷新疆呼图壁县第一中学2018届高三期初考试化学试题甘肃省武威市第十八中学2018届高三上学期第一次诊断考试化学试题河北省定州中学2018届高三上学期第二次月考化学试题1河北省衡水市安平中学2018届高三上学期期中考试化学试题(已下线)《考前20天终极攻略》-5月21日 基础实验(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【教学案】西藏自治区日喀则市南木林高级中学2019届高三第一次月考理综化学试题山东省德州市武城县第二中学2019届高三9月月考化学试题【全国百强校】甘肃省兰州市第一中学2019届高三上学期9月月考化学试题【全国百强校】宁夏回族自治区石嘴山市第三中学2019届高三上学期第二次(10月)月考化学试题云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第2讲 铝及其化合物(已下线)2019高考备考二轮复习精品资料-专题5 金属及其化合物(教学案)重庆市大学城第一中学2018-2019学年高一下学期第一次月考化学试题吉林省延边市第二中学2020届高三入学考试化学试题湖南省长沙市师大附中梅溪湖中学2020届高三上学期开学测试化学试题吉林省公主岭市范家屯镇第一中学2020届高三上学期第二次月考化学试题陕西省西安中学2020届高三上学期第三次月考化学试题山东宁津一中2019--2020学年高三上学期模拟考试化学试题上海市虹口区2016届高三3月分层练习化学(B卷)试题(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训西藏自治区拉萨那曲第二高级中学2020届高三第五次月考理综化学试题重庆市合川区瑞山中学2018-2019高一下学期第一次月考化学试题山东省枣庄三中2021届高三上学期第二次阶段测试化学试题山东省济钢高级中学2021届高三10月质量检测化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题河北省衡水市武强中学2021届高三上学期第一次月考化学试题(已下线)第10周 周测卷-备战2022年高考化学周测与晚练(新高考专用)四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题陕西省武功县普集高中2021-2022学年高三上学期期中考试化学试题河南省郑州市第一0六高级中学2021-2022学年高三上学期期中考试化学试题(已下线)专题16 化学实验综合题-备战2023年高考化学母题题源解密(广东卷)湖北省麻城市实验高级中学2021-2022学年高三下学期第一次联考化学试题内蒙古彦淖尔市临河区第三中学2022届高三上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
4. 一种制备高效漂白剂NaClO2的实验流程如图所示,反应I中发生的反应为3NaClO3+4SO2+3H2O====2ClO2+Na2SO4+3H2SO4+NaCl,下列说法中正确的是
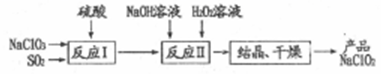

| A.反应Ⅱ中H2O2做还原剂 |
| B.产品中含有SO42-、Cl- |
| C.NaClO2的漂白原理与SO2相同 |
| D.实验室进行结晶操作通常在坩埚中进行 |
您最近一年使用:0次
2019-01-12更新
|
866次组卷
|
11卷引用:【市级联考】河南省郑州市开封市2019届高三上学期第一次模拟考试理科综合化学试题
【市级联考】河南省郑州市开封市2019届高三上学期第一次模拟考试理科综合化学试题【市级联考】河南省开封市2019届高三下学期高考一模化学试题江西省南昌市三校(一中、十中、铁一中)2018-2019学年高二下学期期末联考化学试题福建省莆田市第十一中学2019-2020学年高三上学期期中考试化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(九)浙江省宁波市奉化高中、慈溪市三山高中等六校2019-2020学年高二下学期期中联考化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题(已下线)【浙江新东方】高中化学20210513-003【2021】【高二下】重庆市第八中学校2021-2022学年高三上学期期中考试化学试题上海市杨浦高级中学2021-2022学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
名校
5. 已知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是
| a | b |
| c | d |
| A.a、c两元素的最高正价一定相等 |
| B.d的原子序数不可能是b的原子序数的3倍 |
| C.若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性 |
| D.c的最高价氧化物对应的水化物一定可溶于d的最高价氧化物对应的水化物 |
【知识点】 元素周期律、元素周期表的推断 “位构性”关系理解及应用解读
您最近一年使用:0次
2019-03-28更新
|
382次组卷
|
7卷引用:河南省漯河市高级中学2018届高三上学期第三次模拟考试(期中)化学试题
单选题
|
适中(0.65)
名校
6. 我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
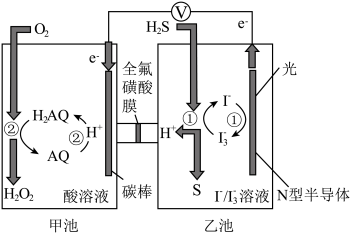

| A.甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物 |
| B.电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变 |
| C.光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+ |
| D.甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ |
【知识点】 原电池电子流向判断及应用解读 原电池正负极判断解读
您最近一年使用:0次
2019-02-21更新
|
848次组卷
|
9卷引用:【校级联考】江西省临川一中,南昌二中,九江一中,新余一中等九校重点中学协作体2019届高三上学期第一次联考理科综合化学试题
【校级联考】江西省临川一中,南昌二中,九江一中,新余一中等九校重点中学协作体2019届高三上学期第一次联考理科综合化学试题陕西省西安中学2020届高三上学期第三次月考化学试题2020届高三化学化学二轮复习——高考常考题型:电极反应式的书写专练【精编29题】江西省丰城中学2019-2020学年高二下学期期末考试化学试题(创新班)(已下线)第04章 电化学基础(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)江西省赣州市部分重点中学2021届高三上学期期中考试化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题辽宁省沈阳市第二中学2021-2022学年高一下学期期中考试化学试题2020高考化学二轮总复习高分必备 题型专题1 选择题专练
单选题
|
较难(0.4)
名校
7. 已知:pK=-lgK,25℃时,二元酸H2A的pK1= 1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是


| A.a点所得溶液中:Vo=10mL |
| B.C点所得溶液中:c(A2- )=c(HA-) |
| C.b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-) |
| D.d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19 |
您最近一年使用:0次
2018-04-24更新
|
761次组卷
|
13卷引用:山东省泰安市2017届高三第二轮复习质量检测(二模)理科综合化学试题
山东省泰安市2017届高三第二轮复习质量检测(二模)理科综合化学试题广西北海市2018届高三第一次模拟考试理综化学试题宁夏六盘山高级中学2018届高三下学期第一次模拟考试化学试题【全国市级联考】山西省太原市2018届高三4月模拟(二)理综化学试题【全国百强校】河北省武邑中学2019届高三下学期第一次质检化学试题黑龙江省哈尔滨市尚志市尚志中学2019-2020学年高二上学期第三次月考化学试题2020届高三化学二轮冲刺新题专练——弱电解质的电离平衡夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——弱电解质的电离及影响因素 (强化练习)河北省张家口市宣化区第一中学2020届高三下学期3月月考化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二下学期期中考试化学试题宁夏贺兰县景博中学2019-2020学年高二上学期第二次月考化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题河北正定中学2020-2021学年高三上学期第四次半月考化学试题
二、解答题 添加题型下试题
8. 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
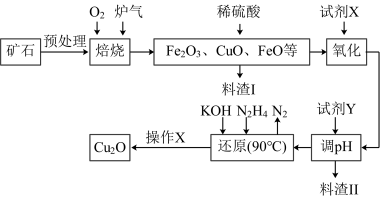
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是__________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________ 。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________ 。当试剂X是______ 时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________ 。
(4)写出用N2H4制备Cu2O的化学方程式:________ ,操作X包括_________ 、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________ 。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:
(3)加入试剂Y调pH时,pH的调控范围是
(4)写出用N2H4制备Cu2O的化学方程式:
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:
您最近一年使用:0次
2020-03-16更新
|
678次组卷
|
11卷引用:【市级联考】河南省安阳市2019届高三下学期二模考试理科综合化学试题
【市级联考】河南省安阳市2019届高三下学期二模考试理科综合化学试题重庆市云阳江口中学校2020届高三上学期第二次月考理综化学试题2019年秋高三化学复习强化练习—— 离子反应方程式及离子共存2020届人教版高三化学二轮复习非选择题专攻练——工艺流程云南省楚雄州禄丰县第一中学2020届高三下学期3月线上模拟考试理综化学试题西藏自治区拉萨市拉萨中学2020届高三第六次月考理科化学试题山东省2020届高三模拟考试化学(二)山西省运城市稷山县第二中学2020届高三上学期第三次月考化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题云南省大理州祥云四中2020届高三下学期3月线上模拟考试理综化学试题四川省内江市威远中学2021-2022学年高三上学期第三次月考化学试题
9. 二甲醚又称甲醚,熔点-141.5℃,沸点-24.9 ℃,与石油液化气相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) ΔH1=-283.6 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH1=-283.6 kJ·mol-1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) CH3OH(g) ΔH2=-90.7 kJ·mol-1
CH3OH(g) ΔH2=-90.7 kJ·mol-1
③2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH3
CH3OCH3(g)+H2O(g) ΔH3
(1)反应③中相关的化学键键能数据如表:
则ΔH3=___________ kJ·mol-1
(2)以二甲醚为燃料,以KOH溶液为电解质溶液设计燃料电池,则电池的负极反应式为___________ 。
(3)原理Ⅰ中,在体积固定的密闭容器中,将气体按n(CH4)∶n(O2)=2∶1混合,能正确反映反应①平衡时CH4的体积分数随温度变化的曲线是___________ 。

(4)有人模拟原理Ⅱ,500 K时,在2 L的密闭容器中充入2 mol CO和6 mol H2,平衡时CO的转化率为80%,c(CH3OCH3)=0.3 mol·L-1,反应③的平衡常数K3=___________ 。在500 K时,若容器中n(CH3OH)=n(CH3OCH3),某同学通过计算,得浓度商Qc的值小于K3,则此时反应③中v(正)___________ (填“大于”或“小于”)v(逆)。
(5)原理Ⅱ中,为提高二甲醚的产率,可以采取的一种措施是___________ 。
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)
 CH3OCH3(g)+H2O(g) ΔH1=-283.6 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH1=-283.6 kJ·mol-1Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.7 kJ·mol-1
CH3OH(g) ΔH2=-90.7 kJ·mol-1③2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH3
CH3OCH3(g)+H2O(g) ΔH3(1)反应③中相关的化学键键能数据如表:
| 化学键 | C—O | H—O(水) | H—O(醇) | C—H |
| E/(kJ·mol-1) | 343 | 465 | 453 | 413 |
(2)以二甲醚为燃料,以KOH溶液为电解质溶液设计燃料电池,则电池的负极反应式为
(3)原理Ⅰ中,在体积固定的密闭容器中,将气体按n(CH4)∶n(O2)=2∶1混合,能正确反映反应①平衡时CH4的体积分数随温度变化的曲线是

(4)有人模拟原理Ⅱ,500 K时,在2 L的密闭容器中充入2 mol CO和6 mol H2,平衡时CO的转化率为80%,c(CH3OCH3)=0.3 mol·L-1,反应③的平衡常数K3=
(5)原理Ⅱ中,为提高二甲醚的产率,可以采取的一种措施是
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
解题方法
10. 某化学兴趣小组设计实验制备苯甲酸异丙酯,其反应原理为
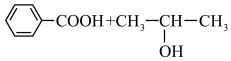
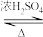
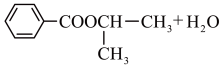
用如图所示装置进行实验:

物质的性质数据如表所示:
实验步骤:
步骤ⅰ:在图甲干燥的仪器a中加入38.1 g苯甲酸、30 mL异丙醇和15 mL浓硫酸,再加入几粒沸石;
步骤ⅱ:加热至70 ℃左右保持恒温半小时;
步骤ⅲ:将图甲的仪器a中液体进行如下操作得到粗产品:
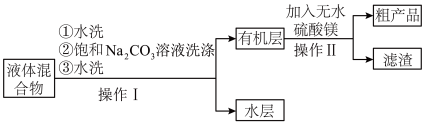
步骤ⅳ:将粗产品用图乙所示装置进行精制。
试回答下列问题:
(1)步骤ⅰ中加入三种试剂的先后顺序一定错误的是___________ (填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.浓硫酸、异丙醇、苯甲酸
C.异丙醇、浓硫酸、苯甲酸
(2)图甲中仪器a的名称为___________ ,判断酯化反应达到平衡的现象_____________ 。加入的苯甲酸和异丙醇中,需过量的是___________ ,目的是___________ 。
(3)本实验一般采用水浴加热,因为温度过高会使产率___________ (填“增大”“减小”或“不变”)。
(4)操作Ⅰ中第二次水洗的目的是___________ ,操作Ⅱ中加入无水硫酸镁的作用为___________ 。
(5)步骤ⅳ所用的装置中冷却水的进口为___________ (填字母),操作时应收集218 ℃的馏分,如果温度计水银球偏上,则收集的精制产品中可能混有的杂质为___________ (填物质名称)。
(6)如果得到的苯甲酸异丙酯的质量为40.930 g。则该实验的产率为___________ %(保留2位有效数字)。
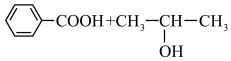
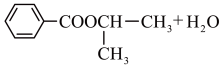
用如图所示装置进行实验:

物质的性质数据如表所示:
| 物质 | 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水溶性 |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶 |
| 异丙醇 | 60 | 0.79 | 82 | 易溶 |
| 苯甲酸异丙酯 | 164 | 1.08 | 218 | 不溶 |
步骤ⅰ:在图甲干燥的仪器a中加入38.1 g苯甲酸、30 mL异丙醇和15 mL浓硫酸,再加入几粒沸石;
步骤ⅱ:加热至70 ℃左右保持恒温半小时;
步骤ⅲ:将图甲的仪器a中液体进行如下操作得到粗产品:

步骤ⅳ:将粗产品用图乙所示装置进行精制。
试回答下列问题:
(1)步骤ⅰ中加入三种试剂的先后顺序一定错误的是
A.异丙醇、苯甲酸、浓硫酸
B.浓硫酸、异丙醇、苯甲酸
C.异丙醇、浓硫酸、苯甲酸
(2)图甲中仪器a的名称为
(3)本实验一般采用水浴加热,因为温度过高会使产率
(4)操作Ⅰ中第二次水洗的目的是
(5)步骤ⅳ所用的装置中冷却水的进口为
(6)如果得到的苯甲酸异丙酯的质量为40.930 g。则该实验的产率为
您最近一年使用:0次
2020-12-16更新
|
811次组卷
|
6卷引用:四川省成都实验中学2021届高三上学期11月月考理综化学试题
四川省成都实验中学2021届高三上学期11月月考理综化学试题(已下线)培优04 有机制备类实验 提高训练-2021年高考化学大题培优练(新高考地区专用)(已下线)大题05 有机制备类实验题-【考前抓大题】备战2021年高考化学(全国通用)(已下线)学科网2021年高三3月大联考考后强化卷(新课标Ⅱ卷)(已下线)专题05 有机实验-【微专题·大素养】备战2022年高考化学核心突破(实验综合大题)江西省景德镇一中2021-2022学年高一下学期18班期末考化学试题
解答题-结构与性质
|
适中(0.65)
解题方法
11. 青蒿素是从黄花蒿中提取的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素,请回答下列问题:

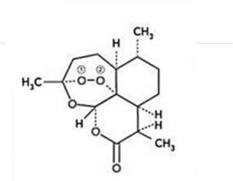
(1)组成青蒿素的三种元素电负性由大到小排序是__________ ,画出基态O原子的价电子排布图__________ 。
(2)一个青蒿素分子中含有_______ 个手性碳原子。
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有: 2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体_________ (分子、离子各写一种);
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有______ 种共价键;
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是______________ ;
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________ ;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比 =
=__________ 由此可知正负离子的半径比是决定离子晶体结构的重要因素,简称几何因素,除此之外影响离子晶体结构的因素还有_________ 、_________ 。


(1)组成青蒿素的三种元素电负性由大到小排序是
(2)一个青蒿素分子中含有
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有: 2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是
 =
=
您最近一年使用:0次
2018-05-21更新
|
252次组卷
|
2卷引用:【全国校级联考】辽宁省六校协作体2017-2018学年高二下学期期中考试化学试题
解答题-有机推断题
|
较难(0.4)
名校
12. 聚对苯二甲酸乙二酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构简式为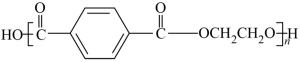 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:
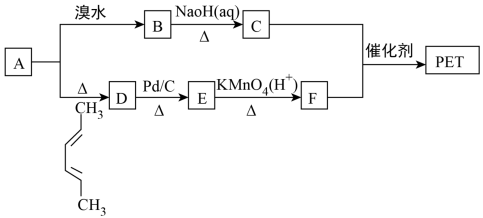
已知: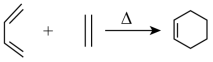
根据题意回答下列问题:
(1)B的化学名称是___________ ,C所含官能团的名称是___________ 。
(2)由1,3丁二烯可制备顺式聚1,3丁二烯,写出顺式聚1,3丁二烯的结构简式:___________ 。
(3)A→D,B→C的反应类型分别为___________ 、___________ 。
(4)写出C+F→PET的化学反应方程式:___________ 。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3∶1∶1,则符合该条件的G的同分异构体共有___________ 种,写出其中一种结构简式___________ 。
(6)参照上述合成路线,以1,3丁二烯为原料(无机试剂任选),设计制备丁苯橡胶( )。
)。___________ 。
 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:
已知:
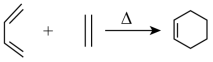
根据题意回答下列问题:
(1)B的化学名称是
(2)由1,3丁二烯可制备顺式聚1,3丁二烯,写出顺式聚1,3丁二烯的结构简式:
(3)A→D,B→C的反应类型分别为
(4)写出C+F→PET的化学反应方程式:
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3∶1∶1,则符合该条件的G的同分异构体共有
(6)参照上述合成路线,以1,3丁二烯为原料(无机试剂任选),设计制备丁苯橡胶(
 )。
)。
您最近一年使用:0次
2020-12-16更新
|
187次组卷
|
3卷引用:辽宁省大连市2018年高三第一次模拟考试理科综合试卷化学试题
试卷分析
整体难度:适中
考查范围:化学实验基础、有机化学基础、常见无机物及其应用、认识化学科学、物质结构与性质、化学反应原理
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 物质分离、提纯的常见物理方法 蒸发与结晶 蒸馏与分馏 萃取和分液 | |
| 2 | 0.4 | 有机官能团的性质及结构 有机分子中原子共面的判断 多官能团有机物的结构与性质 | |
| 3 | 0.65 | 铝的钝化 铝盐与强碱溶液反应 化学实验方案的设计与评价 物质性质实验方案的设计 | |
| 4 | 0.65 | 氧化还原反应方程式的配平 其他含卤化合物 二氧化硫的漂白性 物质的分离、提纯 | |
| 5 | 0.65 | 元素周期律、元素周期表的推断 “位构性”关系理解及应用 | |
| 6 | 0.65 | 原电池电子流向判断及应用 原电池正负极判断 | |
| 7 | 0.4 | 酸碱中和滴定原理的应用 盐溶液中离子浓度大小的比较 盐的水解常数 | |
| 二、解答题 | |||
| 8 | 0.65 | 氧化还原反应方程式的配平 电解池电极反应式及化学方程式的书写与判断 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 9 | 0.65 | 根据△H=反应物的键能之和-生成物的键能之和进行计算 化学平衡常数的有关计算 燃料电池 | 原理综合题 |
| 10 | 0.65 | 常见有机物的制备 综合实验设计与评价 | 实验探究题 |
| 11 | 0.65 | 分子的手性 元素性质与电负性的关系 等电子原理的应用 晶胞的有关计算 | 结构与性质 |
| 12 | 0.4 | 逆合成分析法 根据题给物质选择合适合成路线 有机合成综合考查 | 有机推断题 |



