河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题
河北
高二
阶段练习
2022-11-08
116次
整体难度:
适中
考查范围:
物质结构与性质
河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题
河北
高二
阶段练习
2022-11-08
116次
整体难度:
适中
考查范围:
物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
1. 下列说法正确的是
| A.电子仅从激发态跃迁到基态才产生原子光谱 |
| B.在已知元素中,基态原子的4s能级中只有1个电子且位于d区的元素共有3种 |
C.核电荷数为26的元素基态原子核外价层电子排布图为 |
| D.核外电子数为奇数的基态原子,其原子轨道中可能不含未成对电子 |
【知识点】 能层与能级 核外电子排布的表示形式 光谱解读
您最近一年使用:0次
2022-10-07更新
|
238次组卷
|
5卷引用:河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题
单选题
|
容易(0.94)
名校
2. 下列叙述中正确的是()
| A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
| D.如果某一基态原子3p能级上仅有2个电子,它们的自旋状态必然相反 |
【知识点】 基态核外电子排布规律
您最近一年使用:0次
2019-12-27更新
|
698次组卷
|
22卷引用:2011-2012学年四川省树德协进中学高二上学期期中考试化学试卷
(已下线)2011-2012学年四川省树德协进中学高二上学期期中考试化学试卷(已下线)2012-2013学年黑龙江省鹤岗一中高二下学期期末考试化学试卷(已下线)2014学年高二鲁科选修3化学训练1.2.1基态原子核外电子排布练习卷(已下线)2014年高考化学苏教版总复习 12-1 原子结构与元素的性质练习卷(已下线)2013-2014黑龙江省哈九中高二下学期期末考试化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷2016-2017学年山西省太原市外国语学校高二下学期第一次月考化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1【全国百强校】甘肃省嘉峪关市酒钢三中2017-2018学年高二下学期期中考试化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题山西省实验中学2018-2019学年高二上学期12月月考化学试题黑龙江省大庆十中2018-2019学年高二上学期期末考试化学试题辽宁省丹东市凤城市第一中学2019-2020学年高二上学期12月月考化学试题(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)吉林省松原市长岭县第三中学2021-2022学年高二上学期第三次考试化学试题山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(B卷)专题2 原子结构与元素性质 本专题复习提升第一章 本章复习提升1河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题1.1原子结构模型(课前)-鲁科版选择性必修2
单选题
|
较易(0.85)
名校
3. 下列各组元素中,电负性依次减小的是
| A.F、N、O | B.Cl、C、F | C.As、N、H | D.Cl、S、As |
您最近一年使用:0次
2022-01-21更新
|
369次组卷
|
6卷引用:北京市东城区2021-2022学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
解题方法
4. 下列说法错误的是
A.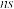 电子的能量不一定高于 电子的能量不一定高于 p电子的能量 p电子的能量 |
B.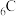 的电子排布式 的电子排布式 违反了洪特规则 违反了洪特规则 |
C.电子排布式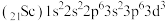 违反了构造原理 违反了构造原理 |
D.电子排布式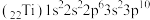 违反了泡利原理 违反了泡利原理 |
【知识点】 基态核外电子排布规律 核外电子排布的表示形式 洪特规则解读 电子排布式解读
您最近一年使用:0次
2022-10-07更新
|
580次组卷
|
3卷引用:河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题
单选题
|
较易(0.85)
5. 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是
| A.第一电离能:W>X>Y>Z | B.简单离子的还原性:Y>X>W |
| C.简单离子的半径:W>X>Y>Z | D.氢化物水溶液的酸性:Y>W |
您最近一年使用:0次
2020-07-11更新
|
10750次组卷
|
51卷引用:2020年山东省高考化学试卷(新高考)
2020年山东省高考化学试卷(新高考)(已下线)专题06 物质结构 元素周期律-2020年高考真题和模拟题化学分项汇编四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题安徽省六安市城南中学2021届高三上学期第一次月考化学试题四川绵阳南山中学双语学校2020-2021学年高二上学期10月月考化学试题辽宁省大连市沙河口区辽宁师范大学附属中学2021届高三上学期10月模块考试化学试题湖北省随州市第一中学2021届高三11月月考化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)河北省石家庄市第二十四中学2021届高三上学期月考化学试卷(人教版2019)选择性必修2 第一章 原子结构与性质 C高考挑战区高二选择性必修2(人教版2019)第一章 原子结构与性质 第一章素养检测(已下线)热点4 物质结构与性质(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)第1章 原子结构与元素性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)(已下线)热点6 物质结构与元素周期律-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记(已下线)重点6 物质结构与元素周期律-2021年高考化学【热点·重点·难点】专练(山东专用)山东省夏津第一中学2020-2021学年高二下学期3月月考化学试题福建省南平市浦城县2020-2021学年高二下学期第一次月考化学试题山东省莘州中学2020-2021学年高二下学期第一次月考化学试题(已下线)押山东卷第03题 元素周期律、元素周期表-备战2021年高考化学临考题号押题(山东卷)河北省河间市第十四中学2020-2021学年高二下学期期中考试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题06 物质结构 元素周期律-备战2022年高考化学真题及地市好题专项集训【山东专用】江苏省扬州市扬州中学2022届高三开学考试化学试题江苏省淮安市高中校协作体2021-2022学年高三上学期期中考试化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)(已下线)2020年山东卷化学高考真题变式题1-10(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)专题2 原子结构与元素性质 ★第二单元综合拔高练(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省大连市金普新区省示范性高中联合体2021-2022学年高三上学期第二阶段考试化学试题(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高三上学期第一次月考化学试题 江苏省盐城市东台创新高级中学2021-2022学年高二2月份月检测化学试题(已下线)专题07 元素周期律与元素周期表(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题山西省太原师范附属中学、太原市师苑中学校2022-2023学年高二下学期第一次月考化学(理)试题北京市第二中学2022-2023学年高二下学期3月月考化学试题湖北省武汉市新洲区部分学校2022-2023学年高二下学期期中考试化学试题陕西省西安市陕西师范大学附属中学渭北中学2022-2023学年高二下学期5月月考化学试题(已下线)专题07 元素周期表与元素周期律2.2.2元素第一电离能和电负性的周期性变化 课后福建省永春第一中学2022-2023学年高二下学期6月月考化学试题甘肃省陇南市等3地2022-2023学年高三上学期11月期中考试化学试题山东省曹县博雅中学2022-2023学年高二上学期期末考试化学试题甘肃省会宁县第四中学2023-2024学年高二下学期第一次月考化学试卷
单选题
|
适中(0.65)
名校
解题方法
6. 下列说法错误的是( )
| A.最外层电子数为2且价电子数为5的元素可能为主族元素 |
| B.外围电子构型为4f75d16s2的元素在周期表中位置应是第六周期 |
| C.最外层电子排布式为ns2的元素可能是金属元素也可能是非金属元素 |
| D.1~36号元素中,基态原子价电子层中未成对电子数最多的元素位于ⅥB族 |
您最近一年使用:0次
2020-03-07更新
|
163次组卷
|
3卷引用:山东省烟台市2019-2020学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的是
A.NH3和NO | B.SO3和NO | C.BF3 和ClO | D.H2O和PO |
【知识点】 价层电子对互斥理论的应用解读
您最近一年使用:0次
2021-01-24更新
|
265次组卷
|
8卷引用:山西省长治市第二中学校2020-2021学年高二上学期期末考试化学试题
山西省长治市第二中学校2020-2021学年高二上学期期末考试化学试题(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题山东省商河县第一中学2020-2021学年高二下学期开学考试化学试题吉林省长春市第二实验中学2020-2021学年高二下学期4月月考化学试题吉林省延边朝鲜族自治州延边二中北校区2020-2021学年高二下学期第一次月考化学试题河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)
单选题
|
适中(0.65)
8. 物质的下列性质或数据与氢键无关的是
| A.甲酸蒸气的密度在373 K时为1.335 g/L,在297 K时为2.5 g/L |
B.邻羟基苯甲酸( )的熔点为159℃,对羟基苯甲酸( )的熔点为159℃,对羟基苯甲酸(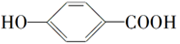 )的熔点为213℃ )的熔点为213℃ |
| C.乙醚微溶于水,而乙醇可与水以任意比混溶 |
| D.HF分解时吸收的热量比HCl分解时吸收的热量多 |
【知识点】 含有氢键的物质解读 氢键对物质性质的影响解读
您最近一年使用:0次
2018-11-27更新
|
130次组卷
|
3卷引用:云南省楚雄州南华县民族中学2018-2019学年高二上学期期中考试化学试题
云南省楚雄州南华县民族中学2018-2019学年高二上学期期中考试化学试题(已下线)2019年3月21日 《每日一题》选修3-氢键对物质性质的影响河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题
9. 有关晶体的结构如图所示,下列说法中错误的是
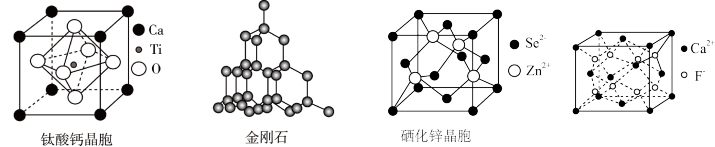
A.钛酸钙的化学式为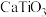 |
| B.在金刚石晶体中,碳原子与碳碳键(C-C)数目之比为1:2 |
C.硒化锌晶体中与一个 距离最近且相等的 距离最近且相等的 有8个 有8个 |
D. 中F-与距离最近的 中F-与距离最近的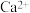 所形成的键的夹角为109.5° 所形成的键的夹角为109.5° |
【知识点】 根据晶胞结构确定晶体化学式解读 晶胞的有关计算解读
您最近一年使用:0次
2022-05-18更新
|
724次组卷
|
15卷引用:山东省烟台市2020-2021学年高二上学期期末考试化学试题
山东省烟台市2020-2021学年高二上学期期末考试化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练黑龙江省齐齐哈尔市2020-2021学年高二下学期期末考试化学试题山东省烟台市莱州第一中学2021-2022学年高二12月月考化学试题山东省济南市第一中学2021-2022学年高二下学期3月月考化学试题山西省吕梁市柳林县部分学校2021-2022学年高二下学期期中检测化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题专题强化练6 晶胞的相关计算重庆市巫山县官渡中学2021-2022学年高二下学期期末考试化学试题重庆市万州纯阳中学校2021-2022学年高二下学期期中考试化学试题河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题吉林市吉化第一高级中学校2022-2023学年高二上学期期末考试化学试题河南省灵宝市第一高级中学2022-2023学年高二下学期3月月考化学试题广东省珠海市第三中学2023-2024学年高二下学期3月月考化学试卷广西钦州市浦北中学2023-2024学年高二下学期3月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
10. 我国科研团队将Li+掺杂到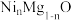 结构单元中,得到一种高性能的p型太阳能电池材料。掺杂后的晶胞属于立方晶系,边长为a nm,其结构如图所示。已知位于A点的原子坐标参数为(0,1,1),下列说法正确的是
结构单元中,得到一种高性能的p型太阳能电池材料。掺杂后的晶胞属于立方晶系,边长为a nm,其结构如图所示。已知位于A点的原子坐标参数为(0,1,1),下列说法正确的是
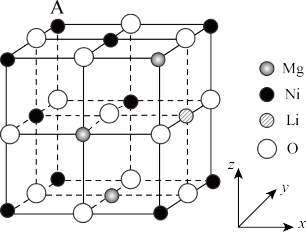
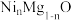 结构单元中,得到一种高性能的p型太阳能电池材料。掺杂后的晶胞属于立方晶系,边长为a nm,其结构如图所示。已知位于A点的原子坐标参数为(0,1,1),下列说法正确的是
结构单元中,得到一种高性能的p型太阳能电池材料。掺杂后的晶胞属于立方晶系,边长为a nm,其结构如图所示。已知位于A点的原子坐标参数为(0,1,1),下列说法正确的是
A.A点的原子与Li间的距离是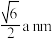 |
| B.Li的坐标参数为(1,1,0.5) |
| C.晶体中每个O原子周围都有3个等距且最近的Ni原子 |
| D.晶胞中Mg原子与Ni原子数之比为1∶2 |
【知识点】 根据晶胞结构确定晶体化学式解读 晶胞的有关计算解读
您最近一年使用:0次
2022-04-16更新
|
163次组卷
|
3卷引用:山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(A卷)
单选题
|
适中(0.65)
名校
解题方法
11. 下列描述中不正确的是
| A.CS2立体构型为V形 | B.SF6中有6对完全相同的成键电子对 |
C.ClO 的空间构型为三角锥形 的空间构型为三角锥形 | D.SiF4和SO 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
您最近一年使用:0次
2021-03-16更新
|
690次组卷
|
6卷引用:新疆维吾尔自治区新源县第二中学2019-2020学年高二上学期第一次阶段测试化学试题
新疆维吾尔自治区新源县第二中学2019-2020学年高二上学期第一次阶段测试化学试题(已下线)2.2 分子的空间结构(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)本册综合检测(A)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)黑龙江省哈尔滨市第六中学2020-2021学年高二4月月考化学试题河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
12. 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
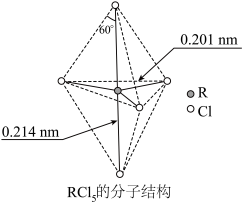

| A.并不是每个原子都达到8电子稳定结构 |
| B.键角(Cl—R—Cl)有90°、120°、180°几种 |
| C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子 |
| D.分子中5个R—Cl键键能不都相同 |
【知识点】 键能、键长、键角及应用解读 极性分子和非极性分子解读
您最近一年使用:0次
2020-04-27更新
|
75次组卷
|
2卷引用:湖北省武汉市武昌区水果湖高中 2019-2020 学年高二下学期期中考试化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
13. 图中A、B、C、D、E表示周期表中的几种短周期元素,下列说法不正确的是
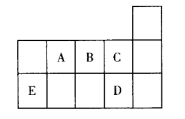

| A.C、D的简单气态氢化物稳定性强弱和沸点高低顺序均为D>C |
| B.A、B、C对应的简单氢化物的还原性:C>B>A |
C.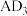 和 和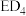 两分子的中心原子均为 两分子的中心原子均为 杂化,但两者的键角大小不同 杂化,但两者的键角大小不同 |
D.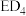 分子中各原子均达8电子稳定结构 分子中各原子均达8电子稳定结构 |
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
较易(0.85)
名校
解题方法
14. 回答下列问题:
(1) 中配体分子
中配体分子 以及分子
以及分子 的空间结构和相应的键角如图甲所示。
的空间结构和相应的键角如图甲所示。
 中P的杂化类型是
中P的杂化类型是________ 。 的沸点比
的沸点比 的
的________ ,原因是________ 。 的键角小于
的键角小于 的,分析原因:
的,分析原因:________ 。
(2)磷酸根离子的空间构型为________ ,其中P的价层电子对数为________ 、杂化轨道类型为________ 。
(3) 分子中氮原子的轨道杂化类型是
分子中氮原子的轨道杂化类型是________ ;C、N、O元素的第一电离能由大到小的顺序为________ 。
(4)乙二胺 是一种有机化合物,分子中氮、碳的杂化类型分别是
是一种有机化合物,分子中氮、碳的杂化类型分别是________ 、________ 。
(5) 中,电负性最高的元素是
中,电负性最高的元素是________ ;P的________ 杂化轨道与O的2p轨道形成________ 键。
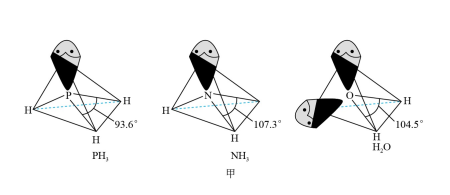
(6) 的空间构型为
的空间构型为________ (用文字描述);抗坏血酸的分子结构如图乙所示,分子中碳原子的轨道杂化类型为________ ;推测抗坏血酸在水中的溶解性:________ (填“难溶于水”或“易溶于水”)。
(1)
 中配体分子
中配体分子 以及分子
以及分子 的空间结构和相应的键角如图甲所示。
的空间结构和相应的键角如图甲所示。
 中P的杂化类型是
中P的杂化类型是 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的,分析原因:
的,分析原因:(2)磷酸根离子的空间构型为
(3)
 分子中氮原子的轨道杂化类型是
分子中氮原子的轨道杂化类型是(4)乙二胺
 是一种有机化合物,分子中氮、碳的杂化类型分别是
是一种有机化合物,分子中氮、碳的杂化类型分别是(5)
 中,电负性最高的元素是
中,电负性最高的元素是(6)
 的空间构型为
的空间构型为
您最近一年使用:0次
2022-10-07更新
|
308次组卷
|
2卷引用:河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题
四、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
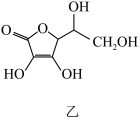
15. ⅢA族元素的单质及其化合物在生产、生活中有广泛应用。如图是几种由ⅢA族元素(或与其他族元素)形成的物质的结构,请回答下列问题:
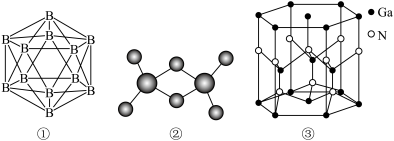
(1)已知晶体硼的基本结构单元是正二十面体(如图①),每个三角形均为正三角形,每个顶角处各有一个硼原子。则该结构单元由________ 个硼原子构成,共含有________ 个B—B键。
(2)科学家合成了一系列具有独特化学特性的氢铝化合物 。已知最简单的氢铝化合物的分子式为
。已知最简单的氢铝化合物的分子式为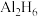 ,它的熔点为150℃,燃烧热极高。
,它的熔点为150℃,燃烧热极高。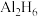 的球棍模型如图②。
的球棍模型如图②。
a.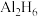 在固态时所形成的晶体是
在固态时所形成的晶体是________ 。
b.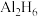 中含有的化学键类型为
中含有的化学键类型为________ 。
c.氢铝化合物________ (填“可能”或“不可能”)成为未来的储氢材料和火箭燃料。
(3)氮化镓属于第三代半导体材料,也是坚硬的高熔点材料,其某种结构如图③所示。它的化学式为________ ,属于________ 晶体。

(1)已知晶体硼的基本结构单元是正二十面体(如图①),每个三角形均为正三角形,每个顶角处各有一个硼原子。则该结构单元由
(2)科学家合成了一系列具有独特化学特性的氢铝化合物
 。已知最简单的氢铝化合物的分子式为
。已知最简单的氢铝化合物的分子式为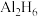 ,它的熔点为150℃,燃烧热极高。
,它的熔点为150℃,燃烧热极高。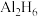 的球棍模型如图②。
的球棍模型如图②。a.
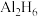 在固态时所形成的晶体是
在固态时所形成的晶体是b.
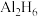 中含有的化学键类型为
中含有的化学键类型为c.氢铝化合物
(3)氮化镓属于第三代半导体材料,也是坚硬的高熔点材料,其某种结构如图③所示。它的化学式为
您最近一年使用:0次
16. 回答下列问题:
(1)第二周期元素的第一电离能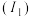 随原子序数
随原子序数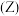 的变化情况如图。
的变化情况如图。 随Z的递增而呈增大趋势的原因是
随Z的递增而呈增大趋势的原因是________ ,原子核对外层电子的引力增大。导致 在a点出现齿峰的原因是
在a点出现齿峰的原因是________ 。

(2)① 常用于制造火柴,P和S的第一电离能较大的是
常用于制造火柴,P和S的第一电离能较大的是________ 。
② 俗称雄黄,其中基态As原子的核外电子排布式为[Ar]
俗称雄黄,其中基态As原子的核外电子排布式为[Ar] ________ ,有________ 个未成对电子。
③P、S、As电负性由大到小的顺序是________ 。
(1)第二周期元素的第一电离能
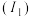 随原子序数
随原子序数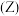 的变化情况如图。
的变化情况如图。 随Z的递增而呈增大趋势的原因是
随Z的递增而呈增大趋势的原因是 在a点出现齿峰的原因是
在a点出现齿峰的原因是
(2)①
 常用于制造火柴,P和S的第一电离能较大的是
常用于制造火柴,P和S的第一电离能较大的是②
 俗称雄黄,其中基态As原子的核外电子排布式为[Ar]
俗称雄黄,其中基态As原子的核外电子排布式为[Ar] ③P、S、As电负性由大到小的顺序是
您最近一年使用:0次
五、填空题 添加题型下试题
填空题
|
适中(0.65)
17. 回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)①在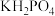 的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是
的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是________ (填离子符号)。
②原子中运动的电子有两种相反的自旋状态,若一种自旋状态用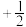 表示,与之相反的用
表示,与之相反的用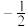 表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为________ 。
(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)①在
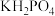 的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是
的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是②原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
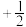 表示,与之相反的用
表示,与之相反的用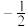 表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:物质结构与性质
试卷题型(共 17题)
题型
数量
单选题
12
多选题
1
填空题
2
解答题
2
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 能层与能级 核外电子排布的表示形式 光谱 | |
| 2 | 0.94 | 基态核外电子排布规律 | |
| 3 | 0.85 | 同周期元素性质递变规律 同主族元素性质递变规律 元素性质与电负性的关系 | |
| 4 | 0.65 | 基态核外电子排布规律 核外电子排布的表示形式 洪特规则 电子排布式 | |
| 5 | 0.85 | 同主族元素性质递变规律理解及应用 微粒半径大小的比较方法 根据原子结构进行元素种类推断 电离能变化规律 | |
| 6 | 0.65 | 核外电子排布规律 电子排布式 基态原子的电子排布的特殊性 | |
| 7 | 0.65 | 价层电子对互斥理论的应用 | |
| 8 | 0.65 | 含有氢键的物质 氢键对物质性质的影响 | |
| 9 | 0.65 | 根据晶胞结构确定晶体化学式 晶胞的有关计算 | |
| 10 | 0.65 | 根据晶胞结构确定晶体化学式 晶胞的有关计算 | |
| 11 | 0.65 | 价层电子对互斥理论 杂化轨道理论 | |
| 12 | 0.65 | 键能、键长、键角及应用 极性分子和非极性分子 | |
| 二、多选题 | |||
| 13 | 0.65 | 元素周期律、元素周期表的推断 元素非金属性强弱的比较方法 利用杂化轨道理论判断化学键杂化类型 | |
| 三、填空题 | |||
| 14 | 0.85 | 电离能变化规律 利用杂化轨道理论判断分子的空间构型 利用杂化轨道理论判断化学键杂化类型 氢键对物质性质的影响 | |
| 17 | 0.65 | 基态核外电子排布规律 核外电子排布的表示形式 元素性质与电负性的关系 | |
| 四、解答题 | |||
| 15 | 0.65 | 物质结构与性质综合考查 分子晶体的物理性质 共价晶体的物理性质 | 结构与性质 |
| 16 | 0.65 | 微粒半径大小的比较方法 电子排布式 电离能 电负性 | 结构与性质 |



