重庆市南开中学2018届高三上学期期中考试理综化学试题
重庆
高三
期中
2018-04-02
551次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学实验基础、物质结构与性质、化学反应原理
重庆市南开中学2018届高三上学期期中考试理综化学试题
重庆
高三
期中
2018-04-02
551次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学实验基础、物质结构与性质、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
1. 现代生活需要提升我们的科学素养,以下说法科学的是
| A.某护肤品广告宣称产品不含任何化学成分 |
| B.日用铝制品表面不需要刷漆防腐蚀 |
| C.汽车尾气中的氮氧化物是由汽油不完全燃烧引起的 |
| D.为了防腐保鲜,可在蔬菜表面洒少量福尔马林 |
您最近一年使用:0次
单选题
|
适中(0.65)
2. 用NA表示阿伏伽德罗常数的值,下列说法正确的是
| A.0.05 mol 熔融NaHSO4中含有的阳离子数为0.05NA |
| B.室温下,1L pH=13的NaOH溶液中,由水电离的OH—数目为0.1NA |
| C.标准状况下,22.4L H2S和SO2的混合气体中含有的分子数为NA |
| D.电解精炼铜时,若阳极质量减少64g,转移到阴极的电子数一定为2NA |
您最近一年使用:0次
3. 下列有关括号内少量杂质的检验试剂、除杂试剂、除杂方法都正确的是( )
| 物质(杂质) | 检验试剂 | 除杂试剂 | 除杂方法 | |
| A | HCl(Cl2) | 湿润的淀粉-KI试纸 | 饱和NaCl溶液 | 洗气 |
| B | Al(Fe) | 盐酸 | NaOH溶液 | 过滤 |
| C | CO(SO2) | 品红溶液 | 酸性KMnO4溶液 | 洗气 |
| D | CuCl2(FeCl3) | NaOH溶液 | Cu | 过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-08-24更新
|
944次组卷
|
8卷引用:重庆市南开中学2018届高三上学期期中考试理综化学试题
单选题
|
适中(0.65)
4. 短周期元素X、Y、Z、W、M原子序数依次增大,且原子最外层电子数之和为17,X和Y是组成化合物种类最多的元素,W是地壳中含量最高的元素。下列说法正确的是
| A.离子半径大小:M>W>Z |
| B.由X、Y、Z、W四种元素形成的化合物一定含离子键 |
| C.Z的简单氢化物比W的简单氢化物更稳定 |
| D.分子式为Y4X8W2的物质超过6种 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
5. 羟基水杨胺(Z)可以治疗胆囊炎、胆管炎等。合成羟苯水杨胺的反应如下图,下列说法正确的是


| A.X能和NaHCO3溶液反应产生CO2 |
| B.Z的分子式为C13H12O3N |
| C.X、Y、Z都能发生消去反应、取代反应、加成反应 |
| D.Z在一定条件下与NaOH溶液发生反应时,1mol Z 最多消耗3 mol NaOH |
您最近一年使用:0次
单选题
|
适中(0.65)
6. 据报道,我国钒电池研究获得重大突破,未来十年市场有望突破1000亿美元。某钒电池反应为2VCl2+BrCl2—  2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是
2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是
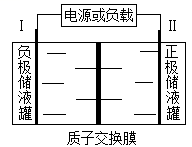
 2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是
2VCl3+Br—,电极均为惰性材料,储液罐里存有反应物和酸性电解质溶液,模拟装置如图所示。下列说法不正确的是 
| A.放电时,I极的电极反应式为VCl2—e—+Cl—= VCl3 |
| B.放电时,H+由交换膜右侧向左侧迁移 |
| C.充电时,I极与电源负极相连,发生还原反应 |
| D.充电时,Ⅱ极的电极反应式为2Cl—+Br——2e—= BrCl2— |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
7. 常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是
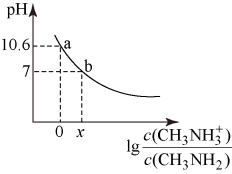

A.甲胺在水中的电离方程式CH3NH2+H2O CH3NH3++OH- CH3NH3++OH- |
| B.b点对应的加入盐酸的体积小于20mL |
| C.将等物质的量的CH3NH2和CH3NH3Cl一起溶于蒸馏水,得到对应a点的溶液 |
| D.常温下,甲胺的电离常数为Kb,则pKb=-lgKb=3.4 |
您最近一年使用:0次
2018-03-31更新
|
557次组卷
|
3卷引用:重庆市南开中学2018届高三上学期期中考试理综化学试题
二、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
8. 碲(Te)及其化合物有许多优良性能,被广泛用于冶金、化工等领域。
(1)碲(Te)在周期表中的位置为________________________ 。碲化氢的还原性比H2S的还原性__________ (填“强”或“弱”)。
(2)已知25℃时,亚碲酸(H2TeO3)的电离平衡常数:Ka1=1×10—3,Ka2=2×10—8。
①0.1mol/L H2TeO3溶液中H2TeO3的电离度约为__________ ;
②已知NaHTeO3的水溶液呈酸性,溶液中所有离子浓度大小顺序为____________________ 。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥 (主要含Cu2Te,还含少量Ag、Au)为原料制备单质碲,其工艺流程如图:
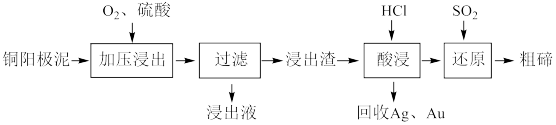
①已知浸出渣的主要成分是TeO2。写出“加压浸出”过程中的离子方程式________________________ ,该过程中,应控制溶液的pH为4.5~5.0,酸性不能太强的原因是__________________________ 。
②“酸浸”后将SO2通入浸出液即可制得单质碲,写出生成单质碲的化学方程式______________________ 。
③工业上还可以将铜阳极泥煅烧生成TeO2,然后碱浸,过滤,再对滤液进行电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为_______________________ 。
(1)碲(Te)在周期表中的位置为
(2)已知25℃时,亚碲酸(H2TeO3)的电离平衡常数:Ka1=1×10—3,Ka2=2×10—8。
①0.1mol/L H2TeO3溶液中H2TeO3的电离度约为
②已知NaHTeO3的水溶液呈酸性,溶液中所有离子浓度大小顺序为
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜

①已知浸出渣的主要成分是TeO2。写出“加压浸出”过程中的离子方程式
②“酸浸”后将SO2通入浸出液即可制得单质碲,写出生成单质碲的化学方程式
③工业上还可以将铜阳极泥煅烧生成TeO2,然后碱浸,过滤,再对滤液进行电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
9. Ⅰ、甲醇既是重要的化工原料,又可作为燃料,利用CO和H2在催化剂作用下可合成甲醇(g)。
(1)已知相关的化学键键能数据如下:
合成甲醇(g)的热化学方程式为______________________________________________ 。
(2)500K、101KPa条件下,反应过程中测得n(CO)、n(H2)、n(CH3OH)随时间t变化的关系如图甲所示。现保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,此时n(H2)比图象中的值大,那么该温度可能是________ 。
A、700K B、373K C、以上均不对

(3)在一容积可变的密闭容器中充入1 mol CO和2 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)和压强(P)的变化曲线如图乙所示。P1、P2的大小关系为________ ;A、B、C三点的平衡常数(K)大小关系为______________________ 。
Ⅱ、可逆反应:①X(g)+2Y(g)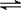 2Z(g);②2M(g)
2Z(g);②2M(g) N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
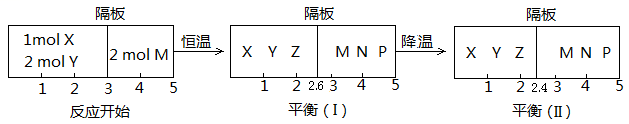
(4)反应①的正反应ΔH______ 0(填“>”或“<”)。
(5)反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为_________ (用分数表示)。
(6)在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数(Ⅰ)______ (Ⅱ)。
A、大于B、小于C、等于D、无法确定
(1)已知相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
合成甲醇(g)的热化学方程式为
(2)500K、101KPa条件下,反应过程中测得n(CO)、n(H2)、n(CH3OH)随时间t变化的关系如图甲所示。现保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,此时n(H2)比图象中的值大,那么该温度可能是
A、700K B、373K C、以上均不对

(3)在一容积可变的密闭容器中充入1 mol CO和2 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)和压强(P)的变化曲线如图乙所示。P1、P2的大小关系为
Ⅱ、可逆反应:①X(g)+2Y(g)
 2Z(g);②2M(g)
2Z(g);②2M(g) N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
(4)反应①的正反应ΔH
(5)反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为
(6)在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数(Ⅰ)
A、大于B、小于C、等于D、无法确定
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
10. 硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜晶体的性质,并测定其结晶水含量。
实验(一):探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量固体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)Y的电子式为___________ 。
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为______________ 。
实验(二):探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。

已知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有________________________________ 。
(4)B、C装置的位置不能互换的原因是____________________________ 。
(5)D中的反应分两步进行,写出第一步反应的离子方程式___________________________ 。
实验(三):测定硫酸铜晶体中结晶水的含量。
取wg硫酸铜晶体(CuSO4·xH2O)配成250 mL 溶液,取25.00 mL 溶液用c mol∙L−1 EDTA溶液(简写成Y4−)滴定至终点,消耗EDTA标准液V mL。
已知:滴定方程式为:Cu2++ Y4−=CuY2−。
(6)x=___________________ (用代数式表示)。
(7)下列情况会使测得的x偏小的是_______ (填番号)
a、样品失去部分结晶水
b、量取待测液前未用待测液润洗滴定管
c、开始读数时滴定管尖嘴有气泡而终点时无气泡
d、滴定开始时平视、滴定终点时俯视
实验(一):探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量固体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)Y的电子式为
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为
实验(二):探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。

已知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有
(4)B、C装置的位置不能互换的原因是
(5)D中的反应分两步进行,写出第一步反应的离子方程式
实验(三):测定硫酸铜晶体中结晶水的含量。
取wg硫酸铜晶体(CuSO4·xH2O)配成250 mL 溶液,取25.00 mL 溶液用c mol∙L−1 EDTA溶液(简写成Y4−)滴定至终点,消耗EDTA标准液V mL。
已知:滴定方程式为:Cu2++ Y4−=CuY2−。
(6)x=
(7)下列情况会使测得的x偏小的是
a、样品失去部分结晶水
b、量取待测液前未用待测液润洗滴定管
c、开始读数时滴定管尖嘴有气泡而终点时无气泡
d、滴定开始时平视、滴定终点时俯视
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
解题方法
11. 合金在生活、生产、国防等领域有广泛应用。镍是重要的合金元素,例如镧镍合金、白铜(铜镍合金)、铝镍合金等。
(1)基态镍原子的外围电子排布式为_____________ 。
(2)在NiSO4溶液中滴加稀氨水能形成配位化合物[Ni(NH3)4]SO4。
①H、N、O、Ni的电负性大小顺序为______________________ 。
②与SO42—互为等电子体的分子(写出一种即可)______________ 。
③SO32—、SO42—中S的杂化类型都是___________ ;但它们的实际空间构型却不同,其主要原因是________________________________________________________________ 。
(3)工业上,采用反应Ni(s)+4CO(g)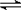 Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有
Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有__________ 。
a、范德华力 b、配位键 c、非极性键 d、极性键 e、离子键
(4)镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镍原子和镧原子的个数比为________ 。
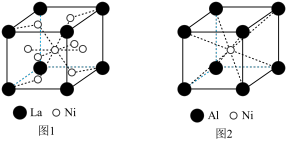
(5)铝镍合金的晶胞如图2所示。已知:铝镍合金的密度为ρg/cm3,NA代表阿伏伽德罗常数的数值,则镍、铝的最短核间距(d)为________________ pm。
(1)基态镍原子的外围电子排布式为
(2)在NiSO4溶液中滴加稀氨水能形成配位化合物[Ni(NH3)4]SO4。
①H、N、O、Ni的电负性大小顺序为
②与SO42—互为等电子体的分子(写出一种即可)
③SO32—、SO42—中S的杂化类型都是
(3)工业上,采用反应Ni(s)+4CO(g)
 Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有
Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有a、范德华力 b、配位键 c、非极性键 d、极性键 e、离子键
(4)镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镍原子和镧原子的个数比为

(5)铝镍合金的晶胞如图2所示。已知:铝镍合金的密度为ρg/cm3,NA代表阿伏伽德罗常数的数值,则镍、铝的最短核间距(d)为
您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
解题方法
12. 资料显示联苯双酯能增强肝脏解毒功能,减轻肝脏的病理损伤,促进肝细胞再生并保护肝细胞,从而改善肝功能。合成联苯双酯的工艺路线如下:
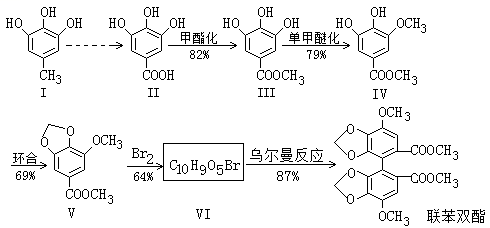
已知:
回答下列问题:
(1)化合物Ⅲ中的官能团名称为______________ ,该化合物的核磁共振氢谱中有_____ 组峰。
(2)Ⅴ→Ⅵ的反应类型为______________ 。写出一定条件下Ⅴ→Ⅵ的化学方程式:____________________ 。
(3)写出比Ⅴ多2个H原子,且符合下列条件的任意两种同分异构体的结构简式:_________________
①苯环上的一氯代物只有1种;
②能发生银镜反应;
③水解产物之一能与FeCl3溶液发生显色反应;
(4)根据题目中的相关信息并结合已学知识,写出Ⅰ→Ⅱ的合成路线:_________________ ,该合成路线为何要经过多步而不是一步完成,目的是__________________ 。

已知:

回答下列问题:
(1)化合物Ⅲ中的官能团名称为
(2)Ⅴ→Ⅵ的反应类型为
(3)写出比Ⅴ多2个H原子,且符合下列条件的任意两种同分异构体的结构简式:
①苯环上的一氯代物只有1种;
②能发生银镜反应;
③水解产物之一能与FeCl3溶液发生显色反应;
(4)根据题目中的相关信息并结合已学知识,写出Ⅰ→Ⅱ的合成路线:
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学实验基础、物质结构与性质、化学反应原理
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 铝合金及其制品 甲醛的毒性 食品添加剂 大气污染来源及危害 | |
| 2 | 0.65 | 阿伏加德罗常数 阿伏加德罗常数的求算 阿伏加德罗常数的应用 结合物质结构基础知识与NA相关推算 | |
| 3 | 0.4 | 物质分离、提纯的常见化学方法 物质检验和鉴别的基本方法选择及应用 | |
| 4 | 0.65 | 元素周期律、元素周期表的推断 元素金属性与非金属性递变规律的理解及应用 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 5 | 0.65 | 含有酚羟基的物质性质的推断 多官能团有机物的结构与性质 | |
| 6 | 0.65 | 原电池 原电池原理理解 原电池电极反应式书写 新型电池 | |
| 7 | 0.65 | 弱电解质的电离方程式 弱电解质在水溶液中的电离平衡 电离平衡常数及影响因素 | |
| 二、解答题 | |||
| 8 | 0.65 | 电离平衡常数及影响因素 盐溶液中离子浓度大小的比较 物质分离、提纯综合应用 物质制备的探究 | 原理综合题 |
| 9 | 0.65 | 根据△H=反应物的键能之和-生成物的键能之和进行计算 化学平衡的移动及其影响因素 化学平衡常数 化学平衡图像分析 | 原理综合题 |
| 10 | 0.65 | 二氧化硫的化学性质 酸碱中和滴定原理的应用 物质含量的测定 探究物质组成或测量物质的含量 | 实验探究题 |
| 11 | 0.65 | 物质结构与性质综合考查 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 根据要求书写同分异构体 根据题给物质选择合适合成路线 有机合成过程中官能团的保护 有机推断综合考查 | 有机推断题 |



