福建省莆田八中2020-2021学年高三下学期5月月考化学(A卷) 试题
福建
高三
阶段练习
2021-06-06
331次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础、有机化学基础、物质结构与性质
福建省莆田八中2020-2021学年高三下学期5月月考化学(A卷) 试题
福建
高三
阶段练习
2021-06-06
331次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础、有机化学基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 化学与科技、生产、生活、环境等密切相关。下列说法错误的是
| A.燃烧化石燃料排放的废气中含有大量SO2,易形成酸雨 |
| B.为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理 |
| C.含氮、磷化合物的生活污水大量排放会使水体富营养化 |
| D.PM2.5指大气中直径小于或等于2.5微米的颗粒物,它对空气质量和能见度等有重要的影响 |
您最近一年使用:0次
2021-04-24更新
|
149次组卷
|
2卷引用:四川省北大成都附属实验中学2020-2021学年高三下学期4月月考理综化学试题
单选题
|
适中(0.65)
2. 设阿伏加德罗常数的值为NA,下列说法正确的是
| A.12.0gNaHSO4与MgSO4的固体混合物中含有离子总数为0.2NA |
| B.0.1molCl2溶于水制成饱和氯水,转移电子数目为0.1NA |
| C.标准状况下,11.2LCH2Cl2所含氢原子数为NA |
| D.常温下,pH=10的CH3COONa溶液中,由水电离出的H+的数目为10−4NA |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
3. 用如图所示装置(夹持装置省略)进行实验,能达到目的的是


A.甲装置可用于由 溶液制备 溶液制备 | B.乙装置可验证浓硫酸的脱水性 |
C.丙装置可制备无水 | D.丁装置可制取并收集干燥、纯净的 |
您最近一年使用:0次
2021-05-01更新
|
655次组卷
|
4卷引用:广东省2021届普通高中学业水平选择考模拟测试(二)化学试题
广东省2021届普通高中学业水平选择考模拟测试(二)化学试题福建省莆田八中2020-2021学年高三下学期5月月考化学(A卷) 试题(已下线)考向33 从实验到化学-备战2022年高考化学一轮复习考点微专题广东省汕头市第一中学2022届高三下学期4月月考化学试题
单选题
|
较易(0.85)
名校
解题方法
4. 化学家找到一种抗癌药物喜树碱,其结构简式如图所示,下列说法不正确的是
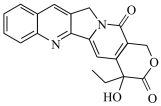

A.分子式为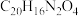 | B.所有原子不可能在同一平面内 |
| C.该物质可以发生水解反应和消去反应 | D.1mol该物质最多可以与9molH2发生加成反应 |
您最近一年使用:0次
2021-05-04更新
|
441次组卷
|
4卷引用:山东省菏泽市2021届4月高三联考(二模)化学试题
山东省菏泽市2021届4月高三联考(二模)化学试题福建省莆田八中2020-2021学年高三下学期5月月考化学(A卷) 试题(已下线)专题14 有机化合物基础-备战2022年高考化学真题及地市好题专项集训【山东专用】湖北省武汉市新洲区部分学校2022-2023学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的K层电子数与最外层电子数之比为2∶7,X与W同主族,Y与Z均处于元素周期表的偶数族,Z与W的原子序数相差3。下列说法正确的是
| A.原子半径:X<Y<Z<W |
| B.常温下,Y、W形成的化合物的水溶液的pH<7 |
| C.X氢化物的水溶液用带玻璃塞的试剂瓶保存 |
| D.lmol X、Y形成的化合物中含有2mol极性键 |
您最近一年使用:0次
2020-05-26更新
|
96次组卷
|
4卷引用:河北省沧州市普通高中2018届高三教学质量监测化学试题
单选题
|
较难(0.4)
名校
解题方法
6. 常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。已知Ksp(AgCl)数量级为10−10。下列叙述正确的是
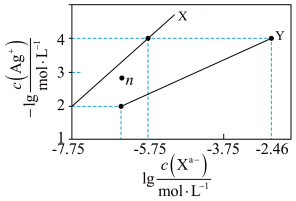

| A.图中X线代表的Ag2C2O4 |
| B.n点表示Ag2C2O4的过饱和溶液 |
| C.向c(Cl−)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀 |
| D.Ag2C2O4+2Cl−=2AgCl+ C2O42-的平衡常数为10−0.71 |
【知识点】 难溶电解质的溶解平衡 溶度积常数相关计算解读
您最近一年使用:0次
2020-05-26更新
|
195次组卷
|
2卷引用:江西省都昌蔡岭慈济中学2020届高三5月月考理综化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 利用原电池原理,各种化学电池应运而生。某单液二次电池(如图所示),其反应原理为H2+2AgCl 2Ag+2HCl。下列说法正确的是
2Ag+2HCl。下列说法正确的是
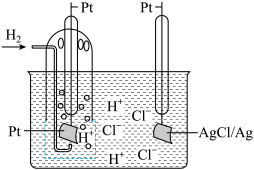
 2Ag+2HCl。下列说法正确的是
2Ag+2HCl。下列说法正确的是
| A.放电时,正极的电极反应为AgCl+e−=Ag+Cl− |
| B.放电时,电子从左边电极经溶液移向右边电极 |
| C.充电时,右边电极与电源的负极相连 |
| D.充电时,每生成1molH2,溶液质量增加216g |
【知识点】 原电池电极反应式书写解读 原电池原理的综合应用解读 其他二次电池解读
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
8. 以盐湖锂精矿(主要成分为Li2CO3,还含有少量的CaCO3)和盐湖卤水(含一定浓度LiCl和MgCl2)为原料均能制备高纯Li2CO3。
(1) 以锂精矿为原料制取碳酸锂的流程如下,其中“碳化溶解”的装置如图所示。
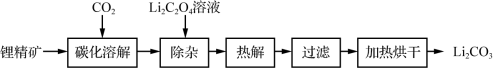
已知:Ⅰ.20 ℃时LiOH的溶解度为12.8 g。
Ⅱ.Li2CO3在不同温度下的溶解度:0 ℃ 1.54 g,20 ℃ 1.33 g,80 ℃ 0.85 g。
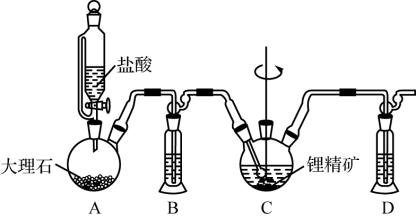
①装置C中主要反应的化学方程式为______ 。
②装置C中的反应需在常温下进行,温度越高锂精矿转化速率越小的原因可能是______ 。保持温度、反应时间、反应物和溶剂的量不变,实验中提高锂精矿转化率的操作有______ 。
③热解、过滤获得Li2CO3的表面有少量Li2C2O4,未经洗涤也不会影响最终Li2CO3产品的纯度,其原因是______ 。
(2)设计由盐湖卤水制取Li2CO3的实验方案:向浓缩后的盐湖卤水______ 。[已知:pH=10时Mg(OH)2完全沉淀,实验中必须用的试剂:NaOH溶液、Na2CO3溶液]。
(1) 以锂精矿为原料制取碳酸锂的流程如下,其中“碳化溶解”的装置如图所示。

已知:Ⅰ.20 ℃时LiOH的溶解度为12.8 g。
Ⅱ.Li2CO3在不同温度下的溶解度:0 ℃ 1.54 g,20 ℃ 1.33 g,80 ℃ 0.85 g。

①装置C中主要反应的化学方程式为
②装置C中的反应需在常温下进行,温度越高锂精矿转化速率越小的原因可能是
③热解、过滤获得Li2CO3的表面有少量Li2C2O4,未经洗涤也不会影响最终Li2CO3产品的纯度,其原因是
(2)设计由盐湖卤水制取Li2CO3的实验方案:向浓缩后的盐湖卤水
【知识点】 物质分离、提纯综合应用解读 常见无机物的制备解读
您最近一年使用:0次
2021-03-03更新
|
379次组卷
|
5卷引用:江苏苏州市2021届高三下学期期初学业质量阳光指标调研化学试题
江苏苏州市2021届高三下学期期初学业质量阳光指标调研化学试题江苏省苏州市2021届高三月考化学试卷福建省莆田八中2020-2021学年高三下学期5月月考化学(A卷) 试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)
解答题-工业流程题
|
适中(0.65)
名校
解题方法
9. 碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料MnxZn(1-x)Fe2O4,其工艺流程如图所示:
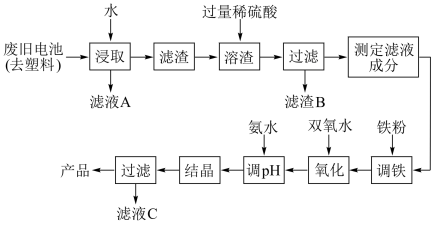
(1)滤液A中溶质的电子式为____________ 。
(2)已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为_________ 。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_____________________________ 。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-X)Fe2O4相符合。
①写出“调铁"工序中发生反应的离子方程式:_________________ ,___________________ 。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=amol.L-1,c(Fe2+)+c(Fe3+)=bmol.L-1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为________ kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化"工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是_______________ 。
(6)用氨水“调pH"后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为_____________________ 。

(1)滤液A中溶质的电子式为
(2)已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-X)Fe2O4相符合。
①写出“调铁"工序中发生反应的离子方程式:
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=amol.L-1,c(Fe2+)+c(Fe3+)=bmol.L-1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为
(5)在“氧化"工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是
(6)用氨水“调pH"后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为
您最近一年使用:0次
2020-04-24更新
|
207次组卷
|
3卷引用:重庆市江津中学、綦江中学等六校2020届高三4月复学联合诊断性考试(全国III)理综化学试题
10. MoS2(辉钼矿的主要成分)可用于制取钼的化合物润滑添加剂氢化反应和异构化反应的催化剂等。回答下列问题:
(1)反应3MoS2+18HNO3+12HCl=3H2[MoO2Cl4]+18NO↑+6H2SO4+6H2O中,每溶解1mol MoS2,转移电子的物质的量为___ 。
(2)已知:MoS2(s)=Mo(s)+S2(g) ΔH1
S2(g)+2O2(g)=2SO2(g) ΔH2
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
反应2Mo(s)+3O2(g)=2MoO3(s)的ΔH=___ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(3)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液(装置如图所示)。

①阴极的电极反应式为________ 。
②一段时间后,电解液的pH________ (填“增大”“减小”或“不变”),MoO 在电极
在电极________ (填“A”或“B”)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是________ 。
(4)用辉钼矿冶炼Mo的反应为MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH。
①该反应的ΔH________ (填“>”或“<”)0;p1、p2、p3按从小到大的顺序为________ 。
②在某恒容密闭容器中加入0.1mol MoS2、0.2mol Na2CO3、0.4mol H2,一定温度下发生上述反应,下列叙述说明反应已达到平衡状态的是________ (填标号)。
a.v正(H2)=v逆(CO)
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d.单位时间内断裂H-H键与断裂H-O键的数目相等
③在2L的恒温恒容密闭容器中加入0.1mol MoS2、0.2mol Na2CO3、0.4mol H2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为________ 。

(1)反应3MoS2+18HNO3+12HCl=3H2[MoO2Cl4]+18NO↑+6H2SO4+6H2O中,每溶解1mol MoS2,转移电子的物质的量为
(2)已知:MoS2(s)=Mo(s)+S2(g) ΔH1
S2(g)+2O2(g)=2SO2(g) ΔH2
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
反应2Mo(s)+3O2(g)=2MoO3(s)的ΔH=
(3)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液(装置如图所示)。

①阴极的电极反应式为
②一段时间后,电解液的pH
 在电极
在电极③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是
(4)用辉钼矿冶炼Mo的反应为MoS2(s)+4H2(g)+2Na2CO3(s)
 Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH。①该反应的ΔH
②在某恒容密闭容器中加入0.1mol MoS2、0.2mol Na2CO3、0.4mol H2,一定温度下发生上述反应,下列叙述说明反应已达到平衡状态的是
a.v正(H2)=v逆(CO)
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d.单位时间内断裂H-H键与断裂H-O键的数目相等
③在2L的恒温恒容密闭容器中加入0.1mol MoS2、0.2mol Na2CO3、0.4mol H2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为

您最近一年使用:0次
2020-08-16更新
|
259次组卷
|
8卷引用:【校级联考】陕西省汉中市重点中学2019届高三下学期3月联考理科综合化学试题
解答题-结构与性质
|
适中(0.65)
名校
解题方法
11. X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子的核外电子排布式为____________________ 。R单质晶体晶胞的堆积方式_______________ ,晶胞的空间利用率为___________________ 。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________ 。该分子的空间构型为_________________ 。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为____________ 。

(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π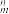 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________ ,其中σ键与π数目之比为______________ 。
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________ cm (NA表示阿伏伽德罗常数的值)。

(1)基态R原子的核外电子排布式为
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为
(3)YF3分子中Y的杂化类型为
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为

(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π
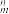 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是

【知识点】 物质结构与性质综合考查解读
您最近一年使用:0次
2017-11-24更新
|
561次组卷
|
6卷引用:河南省豫南豫北名校2018届高三精英联赛化学试题1
解答题-有机推断题
|
适中(0.65)
名校
解题方法
12. 化合物G(萘丁美酮)是一种解热、镇痛药,其合成路线如下:

(1) 可以鉴别B、C两种物质的试剂为______ 。
(2) 1 mol E分子中,碳原子与氧原子形成的σ键的数目为______ 。
(3) D→E的反应类型为______ 。
(4) C的一种同分异构体同时满足下列条件,该同分异构体的结构简式为______ 。
①分子中含苯环,能使Br2的CCl4溶液褪色;
②分子中不同化学环境的氢原子数目之比为2∶3。
(5) 写出以 、
、 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备 的合成路线流程图
的合成路线流程图______ (无机试剂任用,合成路线流程图示例见本题题干)。

(1) 可以鉴别B、C两种物质的试剂为
(2) 1 mol E分子中,碳原子与氧原子形成的σ键的数目为
(3) D→E的反应类型为
(4) C的一种同分异构体同时满足下列条件,该同分异构体的结构简式为
①分子中含苯环,能使Br2的CCl4溶液褪色;
②分子中不同化学环境的氢原子数目之比为2∶3。
(5) 写出以
 、
、 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
2021-03-03更新
|
150次组卷
|
2卷引用:江苏苏州市2021届高三下学期期初学业质量阳光指标调研化学试题
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础、有机化学基础、物质结构与性质
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 固体废弃物的处理 大气污染来源及危害 大气污染的治理原理及方法 水体污染来源及保护措施 | |
| 2 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 水溶液中水的电离程度及的计算 | |
| 3 | 0.65 | 浓硫酸的吸水性 制备与水解有关的物质 常见气体的制备与收集 | |
| 4 | 0.85 | 有机官能团的性质及结构 有机分子中原子共面的判断 醇的消去反应 多官能团有机物的结构与性质 | |
| 5 | 0.65 | 盐类水解的原理 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 化学键概念理解及判断 | |
| 6 | 0.4 | 难溶电解质的溶解平衡 溶度积常数相关计算 | |
| 7 | 0.65 | 原电池电极反应式书写 原电池原理的综合应用 其他二次电池 | |
| 二、解答题 | |||
| 8 | 0.65 | 物质分离、提纯综合应用 常见无机物的制备 | 实验探究题 |
| 9 | 0.65 | 铁与铁离子反应 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 10 | 0.4 | 盖斯定律与热化学方程式 化学平衡状态的判断方法 转化率的相关计算及判断 电解原理 | 原理综合题 |
| 11 | 0.65 | 物质结构与性质综合考查 | 结构与性质 |
| 12 | 0.65 | 同分异构体书写 醇的催化氧化 醛类性质 根据题给物质选择合适合成路线 | 有机推断题 |



