A、B、C、D 为原子序数依次增大的短周期主族元素,E 是一种过渡元素。A 基态原子 L 层中 p 轨道电子数是 s 轨道电子数的 2 倍,B 是同周期元素中最活泼的金属元素, C 和 A 形成的一种化合物是引起酸雨的主要大气污染物之一,E 的基态原子 4s 轨道半充满 和 3d 轨道全充满。请回答下列问题:
(1)B 基态原子的电子排布式是___________ ,C 和 D 中电负性较大的是______ 填元素符号)。
(2)C 的氢化物的沸点低于与其组成相似的 A 的氢化物,其原因是___________ 。
(3)C 与 A 形成的 CA3分子的空间构型是___________ 。
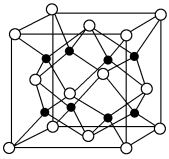
(4)A 和 B 所形成的一种离子化合物 B2A 晶体的晶胞如图所示,则图中黑球代表的离子是_____ (填离子符号)。
(5)在过量的氨水中,E 的阳离子与氨分子通过___________ 形成一种显深蓝色的离子, 该离子的符号为___________ 。
(1)B 基态原子的电子排布式是
(2)C 的氢化物的沸点低于与其组成相似的 A 的氢化物,其原因是
(3)C 与 A 形成的 CA3分子的空间构型是
(4)A 和 B 所形成的一种离子化合物 B2A 晶体的晶胞如图所示,则图中黑球代表的离子是

(5)在过量的氨水中,E 的阳离子与氨分子通过
19-20高三·天津河北·阶段练习 查看更多[3]
内蒙古通辽市奈曼旗实验中学2020届高三下学期模拟考试化学试题(已下线)2020年高考化学押题预测卷02(新课标Ⅲ卷)--《2020年高考押题预测卷》天津市河北区2020届高三年级“停课不停学”期间线上测试化学试题
更新时间:2020-04-15 10:19:45
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
【推荐1】中国较早时期就有炼铜、炼锌技术的记录,铜、锌元素也是人体必需的微量元素之一。回答下列问题:
(1)基态Cu原子核外的最高能层符号是___ ,基态Zn价电子排布式为___ 。
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为___ 。
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是___ 。
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是___ 。
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是___ 。
②与H2O分子互为等电子体的阴离子为___ 。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为___ 。
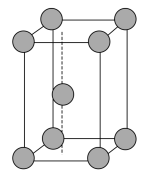
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是___ (用含π的代数式表示)。
(1)基态Cu原子核外的最高能层符号是
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是
②与H2O分子互为等电子体的阴离子为
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是

您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】[化学-选修3:物质结构与性质]硼元素有“金属材料的维生素”之称,其单质及其化合物的研究在无机化学的发展中占有独特的地位。请回答下列问题:
(1)基态硼原子的电子排布式为:___________ 。
(2)硼的化合物 中氢元素化合价为-1,故而被称为“万能还原剂”,广泛用于有机合成。
中氢元素化合价为-1,故而被称为“万能还原剂”,广泛用于有机合成。 中所含元素电负性由大到小的顺序为:
中所含元素电负性由大到小的顺序为:___________ 。
(3) 与
与 可以通过配位键形成
可以通过配位键形成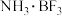 。
。
① 的空间构型为:
的空间构型为:___________ ,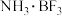 中硼原子的杂化方式为
中硼原子的杂化方式为___________ 。
② 的键角
的键角___________  的键角(填“大于”、“小于”或“等于”)。
的键角(填“大于”、“小于”或“等于”)。
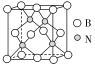
(4)硼酸 晶体中单元结构如图1所示。各单元中的氧原子通过氢键连结成层状结构如图2所示,层与层之间以微弱的分子间力相结合构成整个硼酸晶体。
晶体中单元结构如图1所示。各单元中的氧原子通过氢键连结成层状结构如图2所示,层与层之间以微弱的分子间力相结合构成整个硼酸晶体。___________ 。
②1mol硼酸中含有氢键的数目为___________ 。
③ 在加热过程中会形成链状多硼酸根,其结构如图3所示。已知链状多硼酸根所有氧原子都达到8电子稳定结构,则含n个硼原子的多硼酸根可表示为
在加热过程中会形成链状多硼酸根,其结构如图3所示。已知链状多硼酸根所有氧原子都达到8电子稳定结构,则含n个硼原子的多硼酸根可表示为___________ 。
(5)科学家合成了一种含硼高温超导材料,其立方晶胞结构如图4所示。___________ 个面。
②已知晶胞边长为apm,阿伏加德罗常数为 ,则该晶体密度为
,则该晶体密度为___________  (用含
(用含 、a的式子表示,写出表达式即可)。
、a的式子表示,写出表达式即可)。
(1)基态硼原子的电子排布式为:
(2)硼的化合物
 中氢元素化合价为-1,故而被称为“万能还原剂”,广泛用于有机合成。
中氢元素化合价为-1,故而被称为“万能还原剂”,广泛用于有机合成。 中所含元素电负性由大到小的顺序为:
中所含元素电负性由大到小的顺序为:(3)
 与
与 可以通过配位键形成
可以通过配位键形成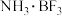 。
。①
 的空间构型为:
的空间构型为: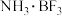 中硼原子的杂化方式为
中硼原子的杂化方式为②
 的键角
的键角 的键角(填“大于”、“小于”或“等于”)。
的键角(填“大于”、“小于”或“等于”)。(4)硼酸
 晶体中单元结构如图1所示。各单元中的氧原子通过氢键连结成层状结构如图2所示,层与层之间以微弱的分子间力相结合构成整个硼酸晶体。
晶体中单元结构如图1所示。各单元中的氧原子通过氢键连结成层状结构如图2所示,层与层之间以微弱的分子间力相结合构成整个硼酸晶体。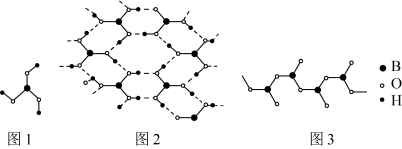
②1mol硼酸中含有氢键的数目为
③
 在加热过程中会形成链状多硼酸根,其结构如图3所示。已知链状多硼酸根所有氧原子都达到8电子稳定结构,则含n个硼原子的多硼酸根可表示为
在加热过程中会形成链状多硼酸根,其结构如图3所示。已知链状多硼酸根所有氧原子都达到8电子稳定结构,则含n个硼原子的多硼酸根可表示为(5)科学家合成了一种含硼高温超导材料,其立方晶胞结构如图4所示。
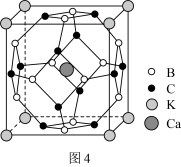
②已知晶胞边长为apm,阿伏加德罗常数为
 ,则该晶体密度为
,则该晶体密度为 (用含
(用含 、a的式子表示,写出表达式即可)。
、a的式子表示,写出表达式即可)。
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】铬是人体必需的微量元素,对维持人体正常的生理功能有着重要的作用。铬是胰岛素不可缺少的辅助成分,它参与糖代谢过程,能够促进脂肪和蛋白质的合成,对于人体的生长发育起着积极的促进作用。虽然铬对维护人体健康有着十分重要的作用,但食用不当也会带来很大的危害。由于无机铬很不容易被人体所吸收,铬只有以有机化合物的形式进入人体内才能被吸收。而在铬的化合物中,六价铬具有很强的毒性,尤以铬酸盐和重铬酸盐的毒性最为突出。
(1)铬原子的基态电子排布式为_______ ,该元素在周期表中的位置是_______ 。
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5°C、 沸点117°C,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为_______ ;
②CS2属于_______ (填“极性”或“非极性”)分子。
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为_______ (填化学式)。 下列是暗绿色晶体配离子的空间结构(中心原子位于正八面体的中心,已省去),其中B与_______ 具有完全相同的结构。(填字母)
A.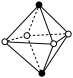 B.
B. C.
C. 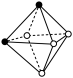 D.
D.  E.
E.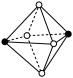
(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O(M=278g ·mol-1 )加入含CrO3的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III), 调节溶液pH达8~10,使溶液中的Fe(II)、 Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①根据上述结果可确定铁氧磁体中x=_______ ;
②根据①的结果,在pH<4时,加入FeSO4·7H2O的质量至少是废水中CrO3质量的_______ 倍。
(1)铬原子的基态电子排布式为
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5°C、 沸点117°C,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为
②CS2属于
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为
A.
 B.
B. C.
C.  D.
D.  E.
E.
(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O(M=278g ·mol-1 )加入含CrO3的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III), 调节溶液pH达8~10,使溶液中的Fe(II)、 Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①根据上述结果可确定铁氧磁体中x=
②根据①的结果,在pH<4时,加入FeSO4·7H2O的质量至少是废水中CrO3质量的
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】我国科学家及其合作团队研究发现,六方相(hep)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:
(1)基态铁原子最外层电子所在能级的电子云轮廓图为_______ 形。
(2)H、C、O三种元素的电负性由大到小的排序为_______ (填元素符号)。
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
请解释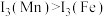 的主要原因:
的主要原因:_______ 。
(4)H、C、O三种元素可以组成很多种物质。
① 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有_______ (填化学式)。
②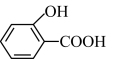 的沸点
的沸点_______ (填“大于”、“小于”或“等于”)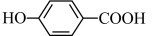 的沸点。
的沸点。
(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
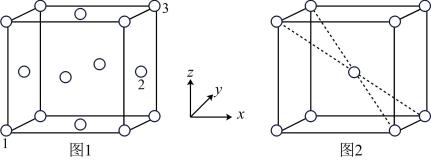
①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为_______ 。
②若图2中晶胞参数为apm,则该晶胞的空间利用率(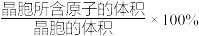 )为
)为_______ (用含π的式子表示)%。
(1)基态铁原子最外层电子所在能级的电子云轮廓图为
(2)H、C、O三种元素的电负性由大到小的排序为
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
| 元素 | 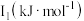 |  | 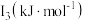 |
| Mn | 717.3 | 1509.9 | 3248 |
| Fe | 762.5 | 1561.9 | 2953 |
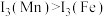 的主要原因:
的主要原因:(4)H、C、O三种元素可以组成很多种物质。
①
 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有②
 的沸点
的沸点 的沸点。
的沸点。(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。

①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为
②若图2中晶胞参数为apm,则该晶胞的空间利用率(
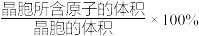 )为
)为
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】铜及其化合物具有广泛的应用。请回答:
(1)Cu元素位于周期表___________ 区。
(2)下列说法不正确 的是___________。
(3)高温下固体中 比
比 稳定,常温下水溶液中
稳定,常温下水溶液中 离子比
离子比 离子稳定(水溶液中
离子稳定(水溶液中 易发生歧化反应生成
易发生歧化反应生成 ),原因是
),原因是___________ 。(已知:金属阳离子在水溶液中易与水分子发生络合形成水合离子,对应的热效应称为水合能, 的水合能为
的水合能为 ,
, 的水合能为
的水合能为 ,Cu的第二电离能为
,Cu的第二电离能为 。)
。)
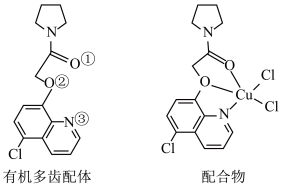
(4) 可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶(
可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶( )、苯酚(
)、苯酚( )含有与苯类似的
)含有与苯类似的 、
、 大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是
大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是___________ (填标号);1mol配合物中含配位键个数为___________ 。
(5)某磷青铜的晶胞结构如图所示。
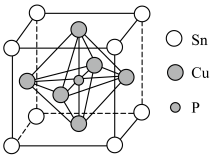
①该晶体中距离Sn原子最近的Cu原子有___________ 个。
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为___________  (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
(1)Cu元素位于周期表
(2)下列说法
| A.基态铜原子的核外电子有29种不同的空间运动状态 |
B.铜催化烯烃硝化反应时会产生 , , 的键角比 的键角比 大 大 |
C. 中非金属元素电负性: 中非金属元素电负性: |
D.配位键的强度: 大于 大于 |
(3)高温下固体中
 比
比 稳定,常温下水溶液中
稳定,常温下水溶液中 离子比
离子比 离子稳定(水溶液中
离子稳定(水溶液中 易发生歧化反应生成
易发生歧化反应生成 ),原因是
),原因是 的水合能为
的水合能为 ,
, 的水合能为
的水合能为 ,Cu的第二电离能为
,Cu的第二电离能为 。)
。)(4)
 可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶(
可与某有机多齿配体形成具有较强荧光性能的配合物,其结构如图所示。已知:吡啶( )、苯酚(
)、苯酚( )含有与苯类似的
)含有与苯类似的 、
、 大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是
大π键,所有原子共平面。有机多齿配体中p轨道能提供一对电子的原子是
(5)某磷青铜的晶胞结构如图所示。

①该晶体中距离Sn原子最近的Cu原子有
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为
 (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】我国科学家在铁基超导研究方面取得了一系列的重大突破,标志着我国在凝聚态物理领域已经成为一个强国。LiZnAs 是研究铁基超导材料的重要前体。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为_____ 。
(2)AsF3分子的空间构型为_____ ,As 原子的杂化轨道类型为_____ 。
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为_____ ,配原子为_____ 。
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为__________ ,阴离子的平均配位数与纯粹的 NiO 晶体相比____________ (填“增大”“减小”或“不变””,写出能体现镍元素化合价的该晶体的化学式________ 示例:Fe3O4写作 Fe2+Fe23+O4)。
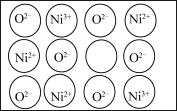
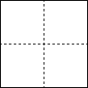
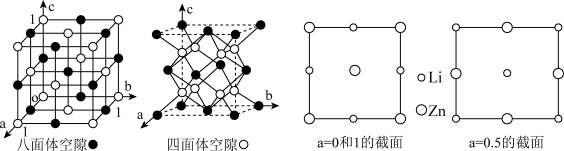
(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,______________ 并说明 a=__________ 。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为
(2)AsF3分子的空间构型为
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为

(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,


您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
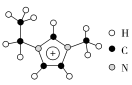
(1)碳原子价层电子的轨道表达式为___________ 。
(2)根据价层电子对互斥理论,NH3、NO 、NO
、NO 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是___________ 。NH3比PH3的沸点高,原因是___________ 。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是___________ 。
(4)EMIM+中,碳原子的杂化轨道类型为___________ 。
(5)立方氮化硼属于原子晶体,其晶胞结构如图所示。其中硼原子的配位数为___________ 。已知立方氮化硼密度为d g/cm3,B原子半径为x pm,N原子半径为y pm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为___________ (列出化简后的计算式)。

(1)碳原子价层电子的轨道表达式为
(2)根据价层电子对互斥理论,NH3、NO
 、NO
、NO 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是(3)氮元素的第一电离能比同周期相邻元素都大的原因是
(4)EMIM+中,碳原子的杂化轨道类型为
(5)立方氮化硼属于原子晶体,其晶胞结构如图所示。其中硼原子的配位数为

您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】H、C、N、O、S是重要的非金属元素,请按要求回答下列问题:
(1)C元素的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,有关该氢化物分子的说法正确的是___________ 。(填序号)。
a.该氢化物分子中C原子采用sp2杂化 b.6个原子不在同一平面上
c.只含有4个sp2-sσ键和1个p-pπ键 d.分子既含有极性键又含有非极性键
(2)相同条件下CO2与SO2分子在水中的溶解度较大的是___________ (写分子式),理由是___________ ; 中的O-C-O键角
中的O-C-O键角___________ (填“>”“<”或“=”) 中的O-S-O键角。
中的O-S-O键角。
(3)已知(CN)2空间构型是直线形分子,且有对称性,则(CN)2分子的结构式为___________ ,其中π键与σ键的个数比为___________ 。
(4)金刚石和碳化硅的部分物理性质数据如表:碳化硅的熔点和硬度比金刚石的小,原因是___________ 。
(5)互为同分异构体的两种有机物形成氢键如图所示:
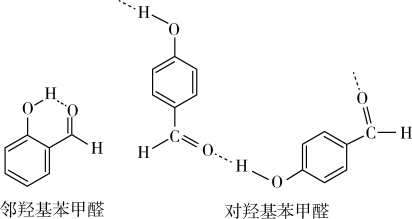
沸点:邻羟基苯甲醛___________ 对羟基苯甲醛(填“>”、“=”或“<”),主要原因是___________ 。
(1)C元素的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,有关该氢化物分子的说法正确的是
a.该氢化物分子中C原子采用sp2杂化 b.6个原子不在同一平面上
c.只含有4个sp2-sσ键和1个p-pπ键 d.分子既含有极性键又含有非极性键
(2)相同条件下CO2与SO2分子在水中的溶解度较大的是
 中的O-C-O键角
中的O-C-O键角 中的O-S-O键角。
中的O-S-O键角。(3)已知(CN)2空间构型是直线形分子,且有对称性,则(CN)2分子的结构式为
(4)金刚石和碳化硅的部分物理性质数据如表:碳化硅的熔点和硬度比金刚石的小,原因是
| 物质 | 金刚石 | 碳化硅 |
| 熔点/℃ | 3550 | 2700 |
| 硬度 | 10 | 9.5 |

沸点:邻羟基苯甲醛
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。LiFePO4、聚乙二酶、LiPF6、LiAsF6,和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Li、F、P、As四种元素的第一电离能由大到小的顺序为___ 。
(2)乙二醇(HCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点:丙醇97.2℃,乙二醇197.3%℃,原因是___ 。
(3)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。
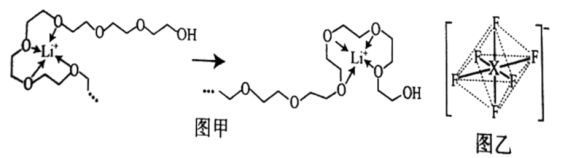
①聚乙二醇分子中,碳、氧的杂化类型分别是___ 、___ 。
②从化学键角度看,Li+迁移过程发生___ (填“物理变化”或“化学变化”)。
③PF 中P的配位数为
中P的配位数为___ 。
④相同条件,Li+在LiAsF6中迁移较快,原因是___ 。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿Z轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为___ 。LiCl•3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则LiCl•3H2O晶体的密度为___ g·cm-3(列出计算表达式)。

(1)Li、F、P、As四种元素的第一电离能由大到小的顺序为
(2)乙二醇(HCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点:丙醇97.2℃,乙二醇197.3%℃,原因是
(3)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①聚乙二醇分子中,碳、氧的杂化类型分别是
②从化学键角度看,Li+迁移过程发生
③PF
 中P的配位数为
中P的配位数为④相同条件,Li+在LiAsF6中迁移较快,原因是
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿Z轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为

您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】C、N、F、Cu及其化合物在医药化工领域应用十分广泛。请回答:
(1)基态铜原子的价层电子排布式为___________ ;C、N、F、Cu四种元素第一电离能从小到大的顺序为___________ 。
(2)化合物 、
、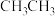 常温下均为气体,沸点较高的是
常温下均为气体,沸点较高的是___________ ; 中氮原子的杂化方式是
中氮原子的杂化方式是___________ 。
(3)将无水硫酸铜溶解在一定量的水中,再加入过量氨水,溶液变为深蓝色,该深蓝色离子 内存在的化学键有
内存在的化学键有___________ 。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)氮、铜形成的某一种化合物,为立方晶系晶体,晶胞参数为apm,沿体对角线投影如图所示。已知该晶胞中原子的分数坐标如下:Cu: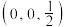 ;
;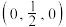 ;
;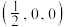 ;N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
;N:(0,0,0),其中与Cu原子等距且最近的Cu原子有___________ 个,则该化合物的化学式为___________ 。
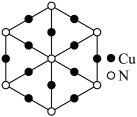
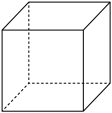
请画出该晶胞的结构示意图:___________ 。
(1)基态铜原子的价层电子排布式为
(2)化合物
 、
、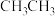 常温下均为气体,沸点较高的是
常温下均为气体,沸点较高的是 中氮原子的杂化方式是
中氮原子的杂化方式是(3)将无水硫酸铜溶解在一定量的水中,再加入过量氨水,溶液变为深蓝色,该深蓝色离子
 内存在的化学键有
内存在的化学键有A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)氮、铜形成的某一种化合物,为立方晶系晶体,晶胞参数为apm,沿体对角线投影如图所示。已知该晶胞中原子的分数坐标如下:Cu:
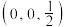 ;
;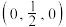 ;
;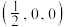 ;N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
;N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
请画出该晶胞的结构示意图:

您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】中科院大连化物所化学研究团队在化学链合成NH3研究方面取得新进展,该研究中涉及的物质有Ni-BaH2/Al2O3、Fe-K2O-Al2O3、Cs-Ru/MgO等,相关研究成果发表于《自然》上。
请回答下列问题:
(1)基态Fe原子核外电子占据最高能层的符号为___________ ,Ni位于周期表中的___________ 区。
(2)元素的第一电离能:Mg___________ (填“>”或“<”)Al。H、N、O的电负性由大到小的顺序为___________ 。
(3)NH3分子中中心原子的杂化方式为___________ 。
(4)已知MgO的熔点为2852℃,CaO的熔点为2614℃,二者的晶体类型为___________ ,MgO的熔点高于CaO的原因是___________ 。
(5)研究发现,只含Ni、Mg和C三种元素的晶体竟然也具有超导性,该晶体的晶胞结构如图所示:

①与C原子紧邻的Ni原子有___________ 个。
②已知该晶胞中a原子的坐标参数为(1,0,0),b原子的坐标参数为( ,
, ,0),则c原子的坐标参数为
,0),则c原子的坐标参数为___________ 。
③已知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ni原子、Mg原子之间的最短距离为___________ pm(用含d、NA的代数式表示)。
请回答下列问题:
(1)基态Fe原子核外电子占据最高能层的符号为
(2)元素的第一电离能:Mg
(3)NH3分子中中心原子的杂化方式为
(4)已知MgO的熔点为2852℃,CaO的熔点为2614℃,二者的晶体类型为
(5)研究发现,只含Ni、Mg和C三种元素的晶体竟然也具有超导性,该晶体的晶胞结构如图所示:

①与C原子紧邻的Ni原子有
②已知该晶胞中a原子的坐标参数为(1,0,0),b原子的坐标参数为(
 ,
, ,0),则c原子的坐标参数为
,0),则c原子的坐标参数为③已知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ni原子、Mg原子之间的最短距离为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
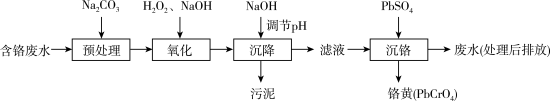
【推荐3】含铬电镀废水的主要成分如表,常用“Pb2+沉淀法”和“药剂还原沉淀法”进行处理。
I. “Pb2+沉淀法”工艺流程如图。 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。
(1)铬元素的价电子排布式:_______ 。已知金属铬为体心立方晶体,密度为7.2g/cm3,求两个Cr原子的最小核间距_______ nm。(只写表达式,不计算)
(2)“氧化”过程中Cr(OH)3转化为 的离子方程式为
的离子方程式为_______ 。
(3)“沉降”过程中应调节pH范围是_______ ~10.5。
(4)已知25℃是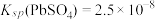 ;
;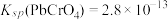 ;
; 。“沉铬”过程中:
。“沉铬”过程中:
①生成铬黄的离子方程式为_______ 。
②从平衡角度分析pH对沉铬率的影响_______ 。
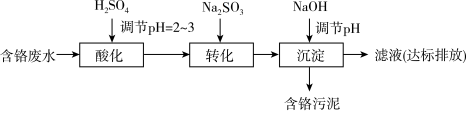
II. “药剂还原沉淀法”工艺流程如图。 被Cr(VI)氧化为
被Cr(VI)氧化为_______ 。
(6)“沉淀”过程中,当溶液pH为8.6时,
_______  。
。
| 离子 | Cr(VI) | Cr3+ | Cu2+ | Fe2+ | Zn2+ |
| 含量mg/L | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |
 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Zn2+ | Cr3+ | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | — | 13.5 | 14.0 | 10.5 | 12.0 | |
(2)“氧化”过程中Cr(OH)3转化为
 的离子方程式为
的离子方程式为(3)“沉降”过程中应调节pH范围是
(4)已知25℃是
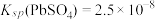 ;
;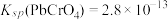 ;
; 。“沉铬”过程中:
。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉铬率的影响
II. “药剂还原沉淀法”工艺流程如图。
 被Cr(VI)氧化为
被Cr(VI)氧化为(6)“沉淀”过程中,当溶液pH为8.6时,

 。
。
您最近半年使用:0次



