在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________ 0(填“大于”或“小于”);
(2)100 ℃时,体系中各物质浓度随时间变化如图所示。
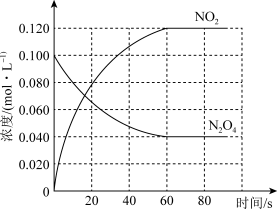
在0~60 s时段,反应速率v(N2O4)为___________________ mol·L-1·s-1;反应的平衡常数K的数值为_________________________ (保留两位小数)。
(3)100 ℃时,反应达平衡后,将反应容器的容积减少一半。平衡向________ (填“正反应”或“逆反应”)方向移动。
(4)100 ℃时达平衡后,改变反应温度为T,c(N2O4) 以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T________ 100 ℃(填“大于”或“小于”)。
(1)反应的ΔH
(2)100 ℃时,体系中各物质浓度随时间变化如图所示。

在0~60 s时段,反应速率v(N2O4)为
(3)100 ℃时,反应达平衡后,将反应容器的容积减少一半。平衡向
(4)100 ℃时达平衡后,改变反应温度为T,c(N2O4) 以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T
更新时间:2020-05-27 22:58:34
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
(1)ΔH__ 0(填“>”、“<”或“=”)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是__ 。
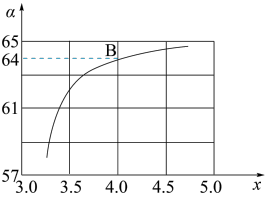
(3)图中的B点对应的NH3的平衡转化率为__ 。
 CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是

(3)图中的B点对应的NH3的平衡转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为_________________________ ;该反应在________ 条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g) CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
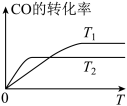
①T1________ T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1________ (填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________ (填字母)。
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___________________ ;
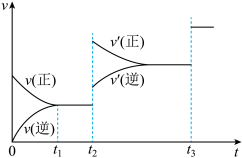
t3时采取的措施可能是_________________ 。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是________ ;正极的电极反应为_______________________ 。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)
 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
①T1
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是

t3时采取的措施可能是
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3⇌N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
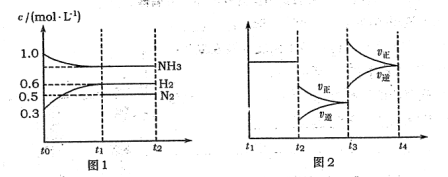
(1)能证明反应达到平衡状态的是_______ (填标号,下同)。
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl="15" s,则t0-t1阶段以H2浓度变化表示的反应速率为_______ 。
(3)t3-t4阶段改变的条件为_______ 。
(4)上述反应的平衡常数K=_______ (保留两位小数);向容器中再通入1.4molNH3、0.8 molH2,平衡_______ 移动(填“向右”、“向左”或“不移动”)。
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c( )<c(Cl-)时,则反应的情况可能为
)<c(Cl-)时,则反应的情况可能为_______
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c( )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb= _______ 。

(1)能证明反应达到平衡状态的是
A.容器内压强不再发生变化 B.N2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)若tl="15" s,则t0-t1阶段以H2浓度变化表示的反应速率为
(3)t3-t4阶段改变的条件为
(4)上述反应的平衡常数K=
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(
 )<c(Cl-)时,则反应的情况可能为
)<c(Cl-)时,则反应的情况可能为a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(
 )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在一定条件下,xA+yB⇌zC的反应达到平衡.
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是___ 。
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则向____ 移动.(填“正向”、“逆向”、“无法判断”)
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是_____ 态.(填“气”、“液”、“固”)
(4)加热后C的质量分数减少,则正反应是_____ 热反应。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则向
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是
(4)加热后C的质量分数减少,则正反应是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H_____ 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为_____ mol•L﹣1•s﹣1。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L﹣1•s﹣1的平均速率降低,经10s又达到平衡。T_____ 100℃(填“大于”或“小于”),判断理由是_____________ 。
(1)反应的△H
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L﹣1•s﹣1的平均速率降低,经10s又达到平衡。T

(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________ ,4 min末CO的浓度为_____________ mol•L-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________ 。

 N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)某温度下,在2L密闭容器中,充入2.4mol CO2和4.4molH2,发生合成甲醇的反应,CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得甲醇的物质的量浓度随时间的变化图象如图(1)中的曲线I,则前4分钟ν(CO2)=
CH3OH(g)+H2O(g),测得甲醇的物质的量浓度随时间的变化图象如图(1)中的曲线I,则前4分钟ν(CO2)=___ ;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___ ;该温度下反应的化学平衡常数为___ 。
(2)在另一温度下发生合成甲醇的反应,如图(2)关闭K,向A容器中充入1molCO2和4molH2,向B容器中充入1.2molCO2和4.8molH2,两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为0.9aL,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为___ L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。

 CH3OH(g)+H2O(g),测得甲醇的物质的量浓度随时间的变化图象如图(1)中的曲线I,则前4分钟ν(CO2)=
CH3OH(g)+H2O(g),测得甲醇的物质的量浓度随时间的变化图象如图(1)中的曲线I,则前4分钟ν(CO2)=(2)在另一温度下发生合成甲醇的反应,如图(2)关闭K,向A容器中充入1molCO2和4molH2,向B容器中充入1.2molCO2和4.8molH2,两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为0.9aL,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氮气转化为氮的化合物对于工业制备硝酸有着重要的意义。回答下列问题。
(1)
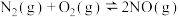

某反应(假设只涉及气体)的平衡常数表达式为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为___________ 。
(2)已知反应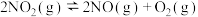
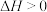 的速率方程为
的速率方程为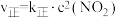 ,
,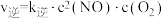 ,其中
,其中 、
、 是正、逆反应的速率常数,只与温度有关,且随温度升高而增大。
是正、逆反应的速率常数,只与温度有关,且随温度升高而增大。 温度下,在2L恒容密闭容器中充入一定量
温度下,在2L恒容密闭容器中充入一定量 气体发生上述反应,测得容器中不同时刻
气体发生上述反应,测得容器中不同时刻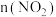 如表所示:
如表所示:
①1~4s内该反应的平均反应速率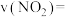
___________ 。
② 温度下达到化学平衡时,
温度下达到化学平衡时,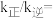
___________ 。
③若将容器的温度改为 ,其他条件不变,
,其他条件不变,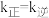 ,则
,则
___________  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(3)对于反应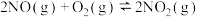
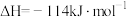 。保持其他初始条件不变,反应相同时间内测得NO转化率与温度的关系如图所示。
。保持其他初始条件不变,反应相同时间内测得NO转化率与温度的关系如图所示。
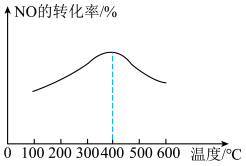
随温度的升高,NO的转化率先增大后减小的原因是___________ 。
(1)
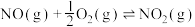
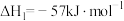
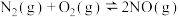

某反应(假设只涉及气体)的平衡常数表达式为
 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)已知反应
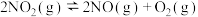
 的速率方程为
的速率方程为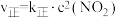 ,
,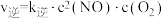 ,其中
,其中 、
、 是正、逆反应的速率常数,只与温度有关,且随温度升高而增大。
是正、逆反应的速率常数,只与温度有关,且随温度升高而增大。 温度下,在2L恒容密闭容器中充入一定量
温度下,在2L恒容密闭容器中充入一定量 气体发生上述反应,测得容器中不同时刻
气体发生上述反应,测得容器中不同时刻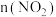 如表所示:
如表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
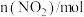 | 2.00 | 1.60 | 1.32 | 1.14 | 1.00 | 1.00 |
①1~4s内该反应的平均反应速率
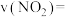
②
 温度下达到化学平衡时,
温度下达到化学平衡时,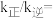
③若将容器的温度改为
 ,其他条件不变,
,其他条件不变,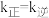 ,则
,则
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(3)对于反应
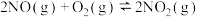
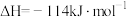 。保持其他初始条件不变,反应相同时间内测得NO转化率与温度的关系如图所示。
。保持其他初始条件不变,反应相同时间内测得NO转化率与温度的关系如图所示。
随温度的升高,NO的转化率先增大后减小的原因是
您最近一年使用:0次
【推荐3】I.反应 Fe2O3(s)+CO(g)⇌
Fe2O3(s)+CO(g)⇌ Fe(s)+CO2(g)∆H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
Fe(s)+CO2(g)∆H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=______ 。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是______
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
II.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)⇌CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=______ 。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
则下列关系正确的是______ .
A c1=c2B 2Q1=Q3C 2a1=a3D a1+a2=1 E该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量。
 Fe2O3(s)+CO(g)⇌
Fe2O3(s)+CO(g)⇌ Fe(s)+CO2(g)∆H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
Fe(s)+CO2(g)∆H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.(1)CO的平衡转化率=
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
II.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)⇌CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是
A c1=c2B 2Q1=Q3C 2a1=a3D a1+a2=1 E该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】反应为CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
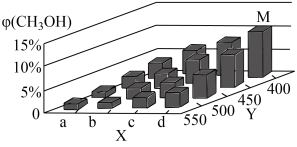
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________ 。
②X轴上a点的数值比b点________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是____________________________________________ 。

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上a点的数值比b点
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在三个容积均为1.0L的在恒容密闭容器中充入物质,发生反应:A(g)+B(g) 2D(g)所得实验数据如下表:
2D(g)所得实验数据如下表:
请回答下列问题:
(1)该反应的正反应是吸热反应。判断的理由是_____________________________________________ 。
(2)在容器Ⅱ中,平衡时D物质的量浓度a=______________ mol/L
(3)在保持容器Ⅲ的实验条件下,若起始时,A为0.40mol/L、B为0.20mol/L、D为0.40mol/L,则达平衡时A的物质的量浓度为多少?(请写出解题过程)_______________
 2D(g)所得实验数据如下表:
2D(g)所得实验数据如下表:| 容器 | 温度/K | 物质的起始浓度/mol.L-1 | 平衡时物质的量浓度/mol.L-1 | ||
| c(A) | c(B) | c(D) | c(D) | ||
| Ⅰ | 400 | 0.20 | 0.20 | 0 | 0.080 |
| Ⅱ | 600 | 0.40 | 0.10 | 0 | a |
| Ⅲ | 600 | 0 | 0 | 0.40 | 0.20 |
请回答下列问题:
(1)该反应的正反应是吸热反应。判断的理由是
(2)在容器Ⅱ中,平衡时D物质的量浓度a=
(3)在保持容器Ⅲ的实验条件下,若起始时,A为0.40mol/L、B为0.20mol/L、D为0.40mol/L,则达平衡时A的物质的量浓度为多少?(请写出解题过程)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】 的减排和综合利用是解决温室及能源问题的有效途径。
的减排和综合利用是解决温室及能源问题的有效途径。
(1)工业中, 和
和 在催化剂
在催化剂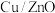 作用下可发生两个平行反应,分别生成
作用下可发生两个平行反应,分别生成 和
和 。
。
反应A:
反应B:
控制 和
和 初始投料比为
初始投料比为 时,温度对
时,温度对 平衡转化率及甲醇和
平衡转化率及甲醇和 产率的影响如图所示。
产率的影响如图所示。
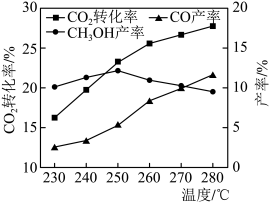
①由图可知温度升高 的产率上升,其主要原因可能是
的产率上升,其主要原因可能是_______ 。
②由图可知获取 最适宜的温度是
最适宜的温度是_______ 。下列措施有利于提高 转化为
转化为 的平衡转化率的有
的平衡转化率的有_______ (填字母)。
A.使用催化剂
B.增大体系压强
C.增大 和
和 的初始投料比
的初始投料比
D.投料比不变和容器体积不变,增加反应物的浓度
(2)250℃下 物质的量随时间的变化曲线如图所示。画出280℃下
物质的量随时间的变化曲线如图所示。画出280℃下 时刻
时刻 物质的量随时间的变化曲线示意图
物质的量随时间的变化曲线示意图_______ 。

(3)汽车尾气里含有的 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: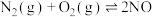
 ,已知该反应在2404℃,平衡常数
,已知该反应在2404℃,平衡常数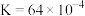 。请回答:
。请回答:
①将 、
、 混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是
混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_______ (填字母序号)。
A. B.
B.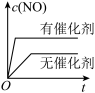 C.
C.
②该温度下,某时刻测得容器内 、
、 、
、 的浓度分别为
的浓度分别为 、
、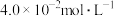 和
和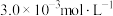 ,此时反应
,此时反应_______ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_______ 。
 的减排和综合利用是解决温室及能源问题的有效途径。
的减排和综合利用是解决温室及能源问题的有效途径。(1)工业中,
 和
和 在催化剂
在催化剂 作用下可发生两个平行反应,分别生成
作用下可发生两个平行反应,分别生成 和
和 。
。反应A:

反应B:

控制
 和
和 初始投料比为
初始投料比为 时,温度对
时,温度对 平衡转化率及甲醇和
平衡转化率及甲醇和 产率的影响如图所示。
产率的影响如图所示。
①由图可知温度升高
 的产率上升,其主要原因可能是
的产率上升,其主要原因可能是②由图可知获取
 最适宜的温度是
最适宜的温度是 转化为
转化为 的平衡转化率的有
的平衡转化率的有A.使用催化剂
B.增大体系压强
C.增大
 和
和 的初始投料比
的初始投料比D.投料比不变和容器体积不变,增加反应物的浓度
(2)250℃下
 物质的量随时间的变化曲线如图所示。画出280℃下
物质的量随时间的变化曲线如图所示。画出280℃下 时刻
时刻 物质的量随时间的变化曲线示意图
物质的量随时间的变化曲线示意图
(3)汽车尾气里含有的
 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: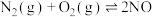
 ,已知该反应在2404℃,平衡常数
,已知该反应在2404℃,平衡常数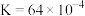 。请回答:
。请回答:①将
 、
、 混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是
混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是A.
 B.
B. C.
C.
②该温度下,某时刻测得容器内
 、
、 、
、 的浓度分别为
的浓度分别为 、
、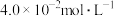 和
和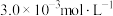 ,此时反应
,此时反应
您最近一年使用:0次



