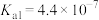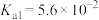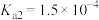电离常数是电离平衡的平衡常数,描述了一定温度下,弱电解质的电离能力。25 ℃,几种弱电解质的电离常数如下表:
(1) 的电离常数表达式 K =
的电离常数表达式 K =_____ 。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_____ 。
(3)25 ℃,氨水的浓度为 2.0 mol·L-1,溶液中的 c(OH-) =_____ mol·L-1。将 SO2通入该氨水中,当溶液中 c(OH-)降至 1.0×10-7 mol·L-1时,溶液中 =
=______ 。
(4)25 ℃,向 0.10 mol·L-1 二元弱酸H2A 溶液中逐滴滴入 NaOH 溶液(忽略溶液体积的变化),溶液中的 H2A、HA-、A2-的物质的量分数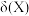 随 pH 的变化如图所示。 [已知:
随 pH 的变化如图所示。 [已知: ]
]
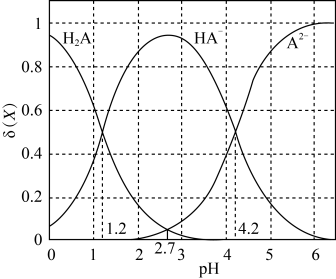
①下列叙述不正确的是_____ (填字母序号)。
A.pH = 1.2 时,c(H2A) = c(HA-)
B.pH = 2.7 时,c(HA-) > c(H2A) = c(A2-)
C.pH = 4.2 时,c(HA-) = c(A2-) = c(H+)
D.H2A 和A2-在溶液中不能大量共存
②25 ℃时,H2A 的电离常数 Ka1 =_____ ,Ka2 =_____ 。
| Ka或 Kb | |
| H2SO3 | Ka1 = 1.3×10-2;Ka2 = 6.2×10-8 |
| H2CO3 | Ka1 = 4.2×10-7;Ka2 = 5.6×10-11 |
| NH3·H2O | Kb = 1.8×10-5 |
 的电离常数表达式 K =
的电离常数表达式 K =(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
(3)25 ℃,氨水的浓度为 2.0 mol·L-1,溶液中的 c(OH-) =
 =
=(4)25 ℃,向 0.10 mol·L-1 二元弱酸H2A 溶液中逐滴滴入 NaOH 溶液(忽略溶液体积的变化),溶液中的 H2A、HA-、A2-的物质的量分数
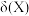 随 pH 的变化如图所示。 [已知:
随 pH 的变化如图所示。 [已知: ]
]
①下列叙述不正确的是
A.pH = 1.2 时,c(H2A) = c(HA-)
B.pH = 2.7 时,c(HA-) > c(H2A) = c(A2-)
C.pH = 4.2 时,c(HA-) = c(A2-) = c(H+)
D.H2A 和A2-在溶液中不能大量共存
②25 ℃时,H2A 的电离常数 Ka1 =
更新时间:2020-10-27 19:21:04
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】已知常见的酸的电离平衡常数如下(均为常温下的数据):
回答下列问题。
(1)下列事实能证明草酸是弱电解质的是______(填标号)。
(2)同浓度的 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是______ 。
(3)常温下 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
(4)物质的浓度相同的① ②
② ③
③ ④
④ 四种稀溶液中,
四种稀溶液中, 浓度由大到小的顺序是
浓度由大到小的顺序是______ (填序号)。
(5)向 溶液中加入少量
溶液中加入少量 溶液,反应的离子方程式为
溶液,反应的离子方程式为____________ 。
(6)常温下,向 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,溶液中
,溶液中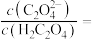
______ 。
(7) 的
的 溶液和
溶液和 的
的 溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:____________ 。
化学式 |
| HClO |
|
|
电离平衡常数 |
|
|
|
|
(1)下列事实能证明草酸是弱电解质的是______(填标号)。
A.草酸能使酸性 溶液褪色 溶液褪色 |
B.常温下, 的 的 溶液的 溶液的 |
C.相同条件下,浓度均为 的 的 溶液的导电能力比硫酸的导电能力弱 溶液的导电能力比硫酸的导电能力弱 |
D. 溶液中存在 溶液中存在 分子,呈酸性 分子,呈酸性 |
 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是(3)常温下
 的
的 溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是______(填标号)。A. | B. | C. | D. |
 ②
② ③
③ ④
④ 四种稀溶液中,
四种稀溶液中, 浓度由大到小的顺序是
浓度由大到小的顺序是(5)向
 溶液中加入少量
溶液中加入少量 溶液,反应的离子方程式为
溶液,反应的离子方程式为(6)常温下,向
 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,溶液中
,溶液中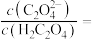
(7)
 的
的 溶液和
溶液和 的
的 溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
溶液等体积混合,写出混合后溶液中离子浓度由大到小的排序:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。请回答下列问题:
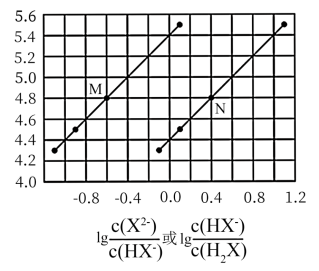
(1)曲线N表示了pH与lg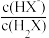 变化的关系,做出此判断的理由是
变化的关系,做出此判断的理由是___________ 。
(2)己二酸发生一级电离的电离常数Ka1大约是___________ 。
(3)HX-的电离程度___________ (填“大于”“小于”或“等于”)X2-的水解程度。其理由是___________ 。当反应进行到混合溶液呈中性时,溶液中各种离子的浓度由大到小的顺序是___________ 。

(1)曲线N表示了pH与lg
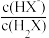 变化的关系,做出此判断的理由是
变化的关系,做出此判断的理由是(2)己二酸发生一级电离的电离常数Ka1大约是
(3)HX-的电离程度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)下列事实一定能说明CH3COOH是弱电解质的是____________ (填字母)。
A.相同温度下,浓度均为1 mol/L的盐酸和醋酸的导电性对比:盐酸>醋酸
B.1 mol/L CH3COOH溶液能使紫色石蕊试液变红
C.25℃时,1 mol/L CH3COOH溶液的pH约为2
D.10 mL 1 mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应
(2)常温下,在25 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图。
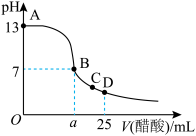
①该氢氧化钠溶液的物质的量浓度为________ mol/L。
②在B点,a________ 12.5 mL(填“大于”、“小于”或“等于”)。醋酸和NaOH恰好完全反应后溶液呈______ (填“酸”或“碱”)性,原因是_______ (用离子方程式表示)。
③A、B、C、D几点中,水的电离程度最大的是____________ 。
(3)25℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为__________
A.相同温度下,浓度均为1 mol/L的盐酸和醋酸的导电性对比:盐酸>醋酸
B.1 mol/L CH3COOH溶液能使紫色石蕊试液变红
C.25℃时,1 mol/L CH3COOH溶液的pH约为2
D.10 mL 1 mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应
(2)常温下,在25 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图。

①该氢氧化钠溶液的物质的量浓度为
②在B点,a
③A、B、C、D几点中,水的电离程度最大的是
(3)25℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】水溶液中离子平衡是自然界中各类物质相互依存、相互制约的复杂平衡体系之一。请回答下列问题:
(1)已知25℃时部分弱电解质的电离平衡常数如表:
①同温度下,pH相等的a.NaCN溶液 b.HCOONa溶液 c.Na2CO3溶液的物质的量浓度由大到小的顺序为_______ (用字母标号表示)。
②25℃时,HCOONH4溶液显_______ 性(填“酸”“中”或“碱”);计算反应NH3•H2O+HCOOH=NH +HCOO-+H2O的平衡常数K=
+HCOO-+H2O的平衡常数K=_______ 。
(2)某温度下,0.1mol/L的盐酸中由水电离出的c(H+)=1.0×10-11mol/L,该温度下将pH=11的NaOH溶液与pH=1的H2SO4溶液等体积混合,混合后溶液的pH=_______ 。
(3)25℃时,向0.1mol/L的二元弱酸H2A溶液中滴加0.1mol/L的NaOH溶液,溶液中的H2A、HA-、A2-的δ(X)随pH的变化如图所示[已知:δ(X)=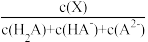 ]。
]。
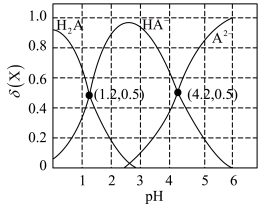
①pH由3~5时,发生反应的离子方程式为_______ 。
②pH=2.2时,溶液中c(H2A):c(HA-)=_______ 。
③所加NaOH溶液体积与H2A溶液体积相同时,溶液中各离子的物质的量浓度由大到小的顺序为_______ (用离子符号表示)。
(1)已知25℃时部分弱电解质的电离平衡常数如表:
| 化学式 | HCN | HCOOH | H2CO3 | NH3•H2O |
| 电离平衡常数 | 6.2×10-10 | 1.8×10-4 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Kb=1.8×10-5 |
①同温度下,pH相等的a.NaCN溶液 b.HCOONa溶液 c.Na2CO3溶液的物质的量浓度由大到小的顺序为
②25℃时,HCOONH4溶液显
 +HCOO-+H2O的平衡常数K=
+HCOO-+H2O的平衡常数K=(2)某温度下,0.1mol/L的盐酸中由水电离出的c(H+)=1.0×10-11mol/L,该温度下将pH=11的NaOH溶液与pH=1的H2SO4溶液等体积混合,混合后溶液的pH=
(3)25℃时,向0.1mol/L的二元弱酸H2A溶液中滴加0.1mol/L的NaOH溶液,溶液中的H2A、HA-、A2-的δ(X)随pH的变化如图所示[已知:δ(X)=
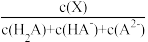 ]。
]。
①pH由3~5时,发生反应的离子方程式为
②pH=2.2时,溶液中c(H2A):c(HA-)=
③所加NaOH溶液体积与H2A溶液体积相同时,溶液中各离子的物质的量浓度由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是___________ (用离子方程式说明)。
(2)几种均为0.1mol•L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol•L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字),导致NH4HSO4溶液的pH随温度变化的原因是_________ 。
②20℃时,0.1mol•L-1NH4Al(SO4)2溶液中2c( )-C(
)-C( )-3c(Al3+)
)-3c(Al3+)_____ mol•L-1(列计算式不必化简)
(3)室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。

①试分析图中a、b、c、d四个点,水的电离程度最大的是___________ 点。
②在b点,溶液中各离子浓度由大到小的排列顺序是___________ 。
③由b到c发生反应的离子方程式为___________ 。
④a点之前发生反应的离子方程式为___________ 。
(1)NH4Al(SO4)2可作净水剂,其原理是
(2)几种均为0.1mol•L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol•L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20℃时,0.1mol•L-1NH4Al(SO4)2溶液中2c(
 )-C(
)-C( )-3c(Al3+)
)-3c(Al3+)(3)室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。

①试分析图中a、b、c、d四个点,水的电离程度最大的是
②在b点,溶液中各离子浓度由大到小的排列顺序是
③由b到c发生反应的离子方程式为
④a点之前发生反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和。
①写出该溶液中的原子守恒(物料守恒)关系___________ 。
②则混合液中下列关系正确的是___________ 。
A. c(HA)<c(A-) B. c(HA)一定大于0.1mol/L
C. c(Na+)>c(A-) D. c(A-)+2c (OH-)=2c(H+)+c(HA)
(2)常温下在20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:

①在同一溶液中,H2CO3、 、
、 三者(填“能”或“不能”)
三者(填“能”或“不能”)___________ 大量共存。
②当pH值由8下降为7时,溶液中主要发生反应的离子方程式为___________ ;当 pH<7时,溶液中H2CO3含量没有继续增大的原因___________ 。
③当pH=7时,溶液中各种离子其物质的量浓度之间的守恒关系是:___________ 。
④已知在25℃时, 水解反应的平衡常数即水解常数K=
水解反应的平衡常数即水解常数K=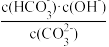 =2×10-4,当溶液中
=2×10-4,当溶液中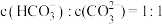 时溶液的pH=
时溶液的pH=___________ 。
(1)常温下,将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和。
①写出该溶液中的原子守恒(物料守恒)关系
②则混合液中下列关系正确的是
A. c(HA)<c(A-) B. c(HA)一定大于0.1mol/L
C. c(Na+)>c(A-) D. c(A-)+2c (OH-)=2c(H+)+c(HA)
(2)常温下在20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:

①在同一溶液中,H2CO3、
 、
、 三者(填“能”或“不能”)
三者(填“能”或“不能”)②当pH值由8下降为7时,溶液中主要发生反应的离子方程式为
③当pH=7时,溶液中各种离子其物质的量浓度之间的守恒关系是:
④已知在25℃时,
 水解反应的平衡常数即水解常数K=
水解反应的平衡常数即水解常数K=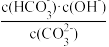 =2×10-4,当溶液中
=2×10-4,当溶液中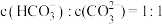 时溶液的pH=
时溶液的pH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物在工农业生产、生活中有着重要应用。
(1)氯胺[NH2Cl(g)]是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,试写出其杀菌过程中与水反应的化学方程式________________ 。
(2)羟胺(NH2OH)是有机合成的常见还原剂。工业上可用硝酸.硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为________________ 。
(3)银氨溶液是检验醛基的重要试剂,其溶液中存在Ag(NH3)2+(aq) Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)
Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________ 。
(4)水合肼(N2H4·H2O)常用作锅炉水的除氧剂。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为
N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________ ,溶液中离子浓度由大到小的排列顺序为________________ 。
(5)氨是一种重要的氮肥。工业合成氨反应为: N2(g)+
N2(g)+  H2(g)
H2(g) NH3(g),该反应的活化能Ea1=254kJ/mol。
NH3(g),该反应的活化能Ea1=254kJ/mol。
①查阅文献,相关化学键键能数据如下:
则反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的活化能Ea2=
H2(g)的活化能Ea2=________________ 。
②一定条件下,1molN2与3.6molH2在密闭容器中充分反应,测得放出的热量为13.8kJ,则H2的转化率为________________ ,为提高原料的利用率,工业合成氨应该采取的措施是=________________ 。
(1)氯胺[NH2Cl(g)]是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,试写出其杀菌过程中与水反应的化学方程式
(2)羟胺(NH2OH)是有机合成的常见还原剂。工业上可用硝酸.硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为
(3)银氨溶液是检验醛基的重要试剂,其溶液中存在Ag(NH3)2+(aq)
 Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)
Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=(4)水合肼(N2H4·H2O)常用作锅炉水的除氧剂。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O
 N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为
N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为(5)氨是一种重要的氮肥。工业合成氨反应为:
 N2(g)+
N2(g)+  H2(g)
H2(g) NH3(g),该反应的活化能Ea1=254kJ/mol。
NH3(g),该反应的活化能Ea1=254kJ/mol。①查阅文献,相关化学键键能数据如下:
| 化学键 | H-H | N N N | N-H |
| E/kJ·mol-1 | 436 | 946 | 391 |
则反应NH3(g)

 N2(g)+
N2(g)+  H2(g)的活化能Ea2=
H2(g)的活化能Ea2=②一定条件下,1molN2与3.6molH2在密闭容器中充分反应,测得放出的热量为13.8kJ,则H2的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】亚硝酸(HNO2)是一元弱酸,不稳定,只能存在于较低温度的稀溶液中。室温时,亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,H2CO3的电离平衡常数Ka1=4.2×10-7、Ka2=5.61×10-11。亚硝酸及其盐在实验和工业生产中有重要应用。请回答:
(1)在酸性条件下,NaNO2与KI按物质的量1︰1恰好完全反应,I-被氧化为I2,写出该反应的离子方程式________________ 。
(2)NaNO2溶液呈_____ 性(填“酸”“碱”或“中”),原因是________ (用离子方程式表示)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用______ (填序号)。
a.稀H2SO4 b.CO2 c.SO2
(3)若用电解法将废水中NO2-转换为N2除去,N2将在__________ (填电极名称)生成。
(4)向含1 mol Na2CO3的溶液中加入1 mol HNO2后,c(CO32-)、c(HCO3-)、c(NO2-)由大到小的顺序为________________ 。
(5)25℃时,用0.100mol•L-1NaOH溶液滴定20.0mL某浓度的HNO2溶液,溶液的pH与NaOH溶液体积(V)的关系如图所示,(在该条件下HNO2不分解)

已知:M点对应溶液中,c(OH-)=c(H+)+c(HNO2)。则:
①原溶液中c(HNO2)为_________ 。
②下列关于N点对应溶液的说法正确的是______ (填选项字母)。
A.溶质只有NaNO2
B.水电离出来的c(H+)=1×10-7 mol•L-1
C.溶液中:c(Na+)<c(OH-)
D.溶液中离子浓度:c(Na+)= c(NO2-)
(1)在酸性条件下,NaNO2与KI按物质的量1︰1恰好完全反应,I-被氧化为I2,写出该反应的离子方程式
(2)NaNO2溶液呈
a.稀H2SO4 b.CO2 c.SO2
(3)若用电解法将废水中NO2-转换为N2除去,N2将在
(4)向含1 mol Na2CO3的溶液中加入1 mol HNO2后,c(CO32-)、c(HCO3-)、c(NO2-)由大到小的顺序为
(5)25℃时,用0.100mol•L-1NaOH溶液滴定20.0mL某浓度的HNO2溶液,溶液的pH与NaOH溶液体积(V)的关系如图所示,(在该条件下HNO2不分解)

已知:M点对应溶液中,c(OH-)=c(H+)+c(HNO2)。则:
①原溶液中c(HNO2)为
②下列关于N点对应溶液的说法正确的是
A.溶质只有NaNO2
B.水电离出来的c(H+)=1×10-7 mol•L-1
C.溶液中:c(Na+)<c(OH-)
D.溶液中离子浓度:c(Na+)= c(NO2-)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇、甲醛(HCHO)等一碳化合物在化工、医药、能源等方面都有广泛的应用。甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1mol HCHO过程中能量变化如图所示:

(1)过程中正反应的活化能为_______ kJ/mol。已知: CO2(g)+2H2(g) HCHO(g)+H2O(g) ∆H=-26kJ/mol,则反应CO2(g) +3H2(g)
HCHO(g)+H2O(g) ∆H=-26kJ/mol,则反应CO2(g) +3H2(g)  CH3OH(g)+H2O(g) ∆H=
CH3OH(g)+H2O(g) ∆H=_______ kJ/mol。
(2)甲醇脱氢法制备甲醛(反应体系中各物质均为气态)过程中会发生副反应:CH3OH(g) CO(g) +2H2(g) △H>0。在体积为2L的刚性容器中,投入1mol气态CH3OH,在一定催化剂作用下,反应时间为10min时,分别测得甲醇的转化率和甲醛的选择性与温度的关系如图所示:(甲醛的选择性:转化的CH3OH中生成HCHO的百分比)
CO(g) +2H2(g) △H>0。在体积为2L的刚性容器中,投入1mol气态CH3OH,在一定催化剂作用下,反应时间为10min时,分别测得甲醇的转化率和甲醛的选择性与温度的关系如图所示:(甲醛的选择性:转化的CH3OH中生成HCHO的百分比)
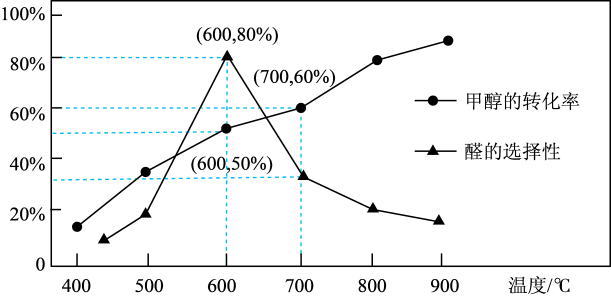
①下列选项中,能说明制备甲醛的反应达到平衡状态的是_______ (填序号)。
a. n(CH3OH)= n( HCHO) b. H2的体积分数不再变化
c.混合气体密度不变 d.容器内气体总压不变。
②600℃时10min内生成甲醛的平均反应速率是_______ 。
③若700℃时,反应在10min时恰好平衡,容器的初始压强为p0,甲醇的转化率为60%,甲醛的选择性为 ,主反应CH3OH(g)
,主反应CH3OH(g)  HCHO(g) +H2(g)的压强平衡常数Kp =
HCHO(g) +H2(g)的压强平衡常数Kp =_______ 。
④600℃以后,甲醛的选择性下降的可能原因为_______ 。
(3)用甲醇可以制备甲胺(CH3NH2), 甲胺的性质与氨相似,写出甲胺在水中的电离方程式:_______ 。等物质的量的甲胺与盐酸反应生成的CH3NH3Cl溶液中微粒浓度大小顺序为_______ 。

(1)过程中正反应的活化能为
 HCHO(g)+H2O(g) ∆H=-26kJ/mol,则反应CO2(g) +3H2(g)
HCHO(g)+H2O(g) ∆H=-26kJ/mol,则反应CO2(g) +3H2(g)  CH3OH(g)+H2O(g) ∆H=
CH3OH(g)+H2O(g) ∆H=(2)甲醇脱氢法制备甲醛(反应体系中各物质均为气态)过程中会发生副反应:CH3OH(g)
 CO(g) +2H2(g) △H>0。在体积为2L的刚性容器中,投入1mol气态CH3OH,在一定催化剂作用下,反应时间为10min时,分别测得甲醇的转化率和甲醛的选择性与温度的关系如图所示:(甲醛的选择性:转化的CH3OH中生成HCHO的百分比)
CO(g) +2H2(g) △H>0。在体积为2L的刚性容器中,投入1mol气态CH3OH,在一定催化剂作用下,反应时间为10min时,分别测得甲醇的转化率和甲醛的选择性与温度的关系如图所示:(甲醛的选择性:转化的CH3OH中生成HCHO的百分比)
①下列选项中,能说明制备甲醛的反应达到平衡状态的是
a. n(CH3OH)= n( HCHO) b. H2的体积分数不再变化
c.混合气体密度不变 d.容器内气体总压不变。
②600℃时10min内生成甲醛的平均反应速率是
③若700℃时,反应在10min时恰好平衡,容器的初始压强为p0,甲醇的转化率为60%,甲醛的选择性为
 ,主反应CH3OH(g)
,主反应CH3OH(g)  HCHO(g) +H2(g)的压强平衡常数Kp =
HCHO(g) +H2(g)的压强平衡常数Kp =④600℃以后,甲醛的选择性下降的可能原因为
(3)用甲醇可以制备甲胺(CH3NH2), 甲胺的性质与氨相似,写出甲胺在水中的电离方程式:
您最近一年使用:0次