随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l)△H<0
5N2(g)+6H2O(l)△H<0
(1)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO)=2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是__ 。
A.c(NH3)︰c(NO)=2︰3
B.n(NH3)︰n(N2)不变
C.容器内压强不变
D.容器内混合气体的密度不变
E.1molN—H键断裂的同时,生成1molO—H键
(2)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示。
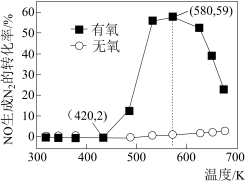
①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=__ ;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是__ 。
 5N2(g)+6H2O(l)△H<0
5N2(g)+6H2O(l)△H<0(1)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO)=2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是
A.c(NH3)︰c(NO)=2︰3
B.n(NH3)︰n(N2)不变
C.容器内压强不变
D.容器内混合气体的密度不变
E.1molN—H键断裂的同时,生成1molO—H键
(2)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示。

①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是
更新时间:2020-11-14 21:31:17
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氨在人类的生产生活中有着非常重要的作用,请回答下列有关问题:
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1,查阅文献资料,化学键键能如表:
①氨分解反应NH3(g)
 N2(g)+
N2(g)+ H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应
H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应 N2(g)+
N2(g)+  H2(g)
H2(g) NH3(g)的活化能Ea1=
NH3(g)的活化能Ea1=___ 。
②氨气完全燃烧生成氮气和气态水的热化学方程式为___ 。
(2)已知NH3·H2O为一元弱碱。N2H4·H2O为二元弱玻,在水溶液中的一级电离方程式表示为:N2H4·H2O+H2O N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为
N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为___ ;溶液中离子浓度由大到小的排列顺序为___ 。
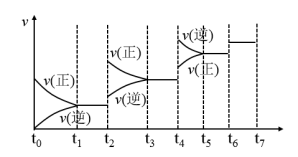
(3)某实验小组模拟工业合成氨:N2(g)+3H2(g) 2NH3(g)ΔH<0,在一恒温恒容的密闭容器中充入氮气和氢气。
2NH3(g)ΔH<0,在一恒温恒容的密闭容器中充入氮气和氢气。
①t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是___ 。
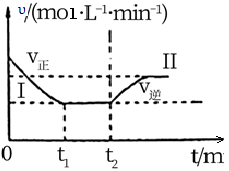
A.I、II两过程到达平衡时,平衡常数:KI<KII
B.I、II两过程到达平衡时,NH3的体积分数:I<II
C.I、II两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
②若向恒容的密闭容器中投入5molN2、15molH2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示。

温度T1、T2、T3大小关系是__ 。M点的平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算表达式)。
(4)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①导线中电子移动方向是___ 。
②固氮酶区域发生反应的离子方程式是___ 。
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1,查阅文献资料,化学键键能如表:
| 化学键 | H—H | N N N | N—H |
| E/kJ·mol-1 | 436 | 946 | 391 |
①氨分解反应NH3(g)

 N2(g)+
N2(g)+ H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应
H2(g)的活化能Ea1=300kJ·mol-1,则合成氨反应 N2(g)+
N2(g)+  H2(g)
H2(g) NH3(g)的活化能Ea1=
NH3(g)的活化能Ea1=②氨气完全燃烧生成氮气和气态水的热化学方程式为
(2)已知NH3·H2O为一元弱碱。N2H4·H2O为二元弱玻,在水溶液中的一级电离方程式表示为:N2H4·H2O+H2O
 N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为
N2H5·H2O++OH-。则可溶性盐盐酸肼(N2H6Cl2)第一步水解的离子方程式为(3)某实验小组模拟工业合成氨:N2(g)+3H2(g)
 2NH3(g)ΔH<0,在一恒温恒容的密闭容器中充入氮气和氢气。
2NH3(g)ΔH<0,在一恒温恒容的密闭容器中充入氮气和氢气。①t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是

A.I、II两过程到达平衡时,平衡常数:KI<KII
B.I、II两过程到达平衡时,NH3的体积分数:I<II
C.I、II两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
②若向恒容的密闭容器中投入5molN2、15molH2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示。

温度T1、T2、T3大小关系是
(4)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①导线中电子移动方向是
②固氮酶区域发生反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】科学家开发高效多功能催化剂,高选择性利用CO2和H2制备CH4,实现废旧物资循环利用。反应原理是CO2(g)+4H2(g) CH4(g)+2H2O。
CH4(g)+2H2O。
(1)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
①已知 ,则a=
,则a=___________ ;
②已知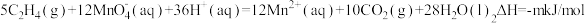 ,当放出的热量为nkJ时,该反应转移的电子数为
,当放出的热量为nkJ时,该反应转移的电子数为___________ (用含m、n、NA的代数式表示,NA表示阿代加德罗常数)。
(2)在恒温恒容条件下充入CO2(g)和H2(g)发生反应CO2(g)+4H2(g) CH4(g)+2H2O。
CH4(g)+2H2O。
①下列情况表明该反应已达到平衡状态的是___________ (填标号)。
a.混合气体的密度不再随时间变化
b.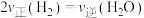
c.混合气体的平均摩尔质量不随时间变化D.CO2(g)和H2(g)的浓度之比不随时间变化
②其他条件相同,只改变下列一个条件,能提高CH4(g)生成速率的是___________ (填标号)。
a.降低温度 b.再充入H2 c.充入N2 d.及时移走部分H2
(3)在恒温条件下,向一容积为2L的恒容密闭容器中充入1molCO2和4molH2,发生上述反应,测得气体总压强变化如图。0~10min内,
___________  ;0~5min内v(H2)
;0~5min内v(H2)___________ (填“大于”“小于”或“等于”)5~10min内v(H2)。

(4)下图是甲烷燃料电池的原理示意图:

①负极的电极反应式为___________ 。
②电池工作一段时间后,电解质溶液的pH___________ (填“增大”、“减小”或“不变”)。
 CH4(g)+2H2O。
CH4(g)+2H2O。(1)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
| 化学键 | H-H | C=C | C-C | C-H |
| E/(kJmol1) | 436 | A | 348 | 413 |
 ,则a=
,则a=②已知
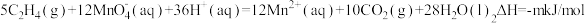 ,当放出的热量为nkJ时,该反应转移的电子数为
,当放出的热量为nkJ时,该反应转移的电子数为(2)在恒温恒容条件下充入CO2(g)和H2(g)发生反应CO2(g)+4H2(g)
 CH4(g)+2H2O。
CH4(g)+2H2O。①下列情况表明该反应已达到平衡状态的是
a.混合气体的密度不再随时间变化
b.
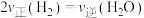
c.混合气体的平均摩尔质量不随时间变化D.CO2(g)和H2(g)的浓度之比不随时间变化
②其他条件相同,只改变下列一个条件,能提高CH4(g)生成速率的是
a.降低温度 b.再充入H2 c.充入N2 d.及时移走部分H2
(3)在恒温条件下,向一容积为2L的恒容密闭容器中充入1molCO2和4molH2,发生上述反应,测得气体总压强变化如图。0~10min内,

 ;0~5min内v(H2)
;0~5min内v(H2)
(4)下图是甲烷燃料电池的原理示意图:

①负极的电极反应式为
②电池工作一段时间后,电解质溶液的pH
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】化学平衡是最重要的化学反应原理之一。
(1)现有容积为1L的恒温恒容密闭容器,向其中加入1molA气体和1molB气体后发生反应:A(g)+B(g) C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
①在题干条件下,说明该反应已经达到平衡状态的有__ (填序号)。
A.消耗0.1molA的同时生成0.1molC
B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化
D.A的转化率为50%
②保持容器温度和容积不变,若开始时向容器中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1、Q2与q的数值关系正确的是___ (填序号)。
A.Q1+Q2=q B.Q1+2Q2<q C.Q1+2Q2>q D.Q1+Q2<q
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入amolA气体,重新达平衡后,B气体的转化率为75%,则a=__ 。
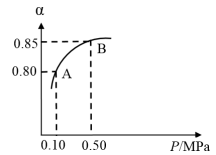
(2)在一容积可变的密闭容器中充有10molCO和20molH2,发生CO(g)+2H2(g) CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C三点的平衡常数KA、KB、KC的大小关系为___ 。
②若达到平衡状态A时,容器的体积为8L,则在平衡状态B时容器的体积为___ L。
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的正极为___ (填“A”或“B”),写出阳极的电极反应式___ 。

(1)现有容积为1L的恒温恒容密闭容器,向其中加入1molA气体和1molB气体后发生反应:A(g)+B(g)
 C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:①在题干条件下,说明该反应已经达到平衡状态的有
A.消耗0.1molA的同时生成0.1molC
B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化
D.A的转化率为50%
②保持容器温度和容积不变,若开始时向容器中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1、Q2与q的数值关系正确的是
A.Q1+Q2=q B.Q1+2Q2<q C.Q1+2Q2>q D.Q1+Q2<q
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入amolA气体,重新达平衡后,B气体的转化率为75%,则a=
(2)在一容积可变的密闭容器中充有10molCO和20molH2,发生CO(g)+2H2(g)
 CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
①A、B、C三点的平衡常数KA、KB、KC的大小关系为
②若达到平衡状态A时,容器的体积为8L,则在平衡状态B时容器的体积为
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的正极为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】为有效控制雾霾,各地积极采取措施改善大气质量。其中,控制空气中氮氧化物和硫氧化物的含量尤为重要。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
则CH4催化还原NO的热化学方程式为_______________________________ 。
(2)将0.20mol NO和0.10mol CO充入一个温度恒定、容积恒为2L的密闭容器中发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现氮氧化物的转化,反应过程中部分物质的物质的量变化如图所示。

①N2在0~9min内的平均反应速率v(N2)=________ mol/(L·min)(保留两位有效数字)。
②第12min时改变的反应条件可能为________ (填字母代号)。
A.充入水蒸气稀释反应物 B.加入NO C.加催化剂 D.增大压强 E.降低温度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中 =
=_________ (已知:常温下H2SO3的电离平衡常数Ka1=1.0×10−2,Ka2=6.0×10−8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32−):n(HSO3−)变化关系如下表:
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):___________
a.c(Na+)=2c(SO32−)+c(HSO3−)
b.c(Na+)>c(HSO3−)>c(SO32−)>c(H+)=c(OH−)
c.c(Na+)+c(H+) =c(SO32−)+c(HSO3−)+c(OH−)
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
则CH4催化还原NO的热化学方程式为
(2)将0.20mol NO和0.10mol CO充入一个温度恒定、容积恒为2L的密闭容器中发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现氮氧化物的转化,反应过程中部分物质的物质的量变化如图所示。

①N2在0~9min内的平均反应速率v(N2)=
②第12min时改变的反应条件可能为
A.充入水蒸气稀释反应物 B.加入NO C.加催化剂 D.增大压强 E.降低温度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中
 =
=(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32−):n(HSO3−)变化关系如下表:
| n(SO32−):n(HSO3−) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+)=2c(SO32−)+c(HSO3−)
b.c(Na+)>c(HSO3−)>c(SO32−)>c(H+)=c(OH−)
c.c(Na+)+c(H+) =c(SO32−)+c(HSO3−)+c(OH−)
您最近一年使用:0次
【推荐2】氢能是极具发展潜力的清洁能源,2021年我国制氢量位居世界第一、请回答:
(1)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)= Na3AlH6(s)+
Na3AlH6(s)+ Al(s)+H2(g),△H=+37kJ•mol-1
Al(s)+H2(g),△H=+37kJ•mol-1
Na3AlH6(s)=3NaH(s)+Al(s)+ H2(g),△H=+70.5kJ•mol-1
H2(g),△H=+70.5kJ•mol-1
则NaAlH4(s)=NaH(s)+Al(s)+ H2(g),△H=
H2(g),△H=___________ 。
(2)工业上,常用 与
与 重整制备
重整制备 。500℃时,主要发生下列反应:
。500℃时,主要发生下列反应:
Ⅰ.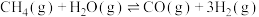 Ⅱ.
Ⅱ.
①已知: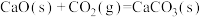
 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是___________ 。
②下列操作中,能提高CH4(g)平衡转化率的是___________ (填标号)。
A.加催化剂 B.增加CH4(g)用量 C.移除H2(g) D.恒温恒压,通入惰性气体
③500℃、恒压(Po)条件下,1 mol CH4(g)和1 mol H2O(g)反应达平衡时,CH4(g)的转化率为0.5,CO2(g)的物质的量为0.25 mol,则反应Ⅱ的平衡常数KP=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点。可用氢气和二氧化碳在催化剂作用下合成甲醇: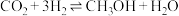 。
。
恒压下,CO2和H2的起始物质的量之比为1∶3时,该反应甲醇的平衡产率随温度的变化如图所示。该反应的
___________ 0,甲醇的产率P点高于T点的原因为___________ 。
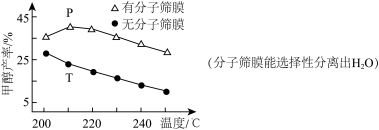
(4)利用电催化可将CO2同时转化为多种燃料,装置如图:铜电极上产生CH4的电极反应式为___________ 。
(1)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=
 Na3AlH6(s)+
Na3AlH6(s)+ Al(s)+H2(g),△H=+37kJ•mol-1
Al(s)+H2(g),△H=+37kJ•mol-1Na3AlH6(s)=3NaH(s)+Al(s)+
 H2(g),△H=+70.5kJ•mol-1
H2(g),△H=+70.5kJ•mol-1则NaAlH4(s)=NaH(s)+Al(s)+
 H2(g),△H=
H2(g),△H=(2)工业上,常用
 与
与 重整制备
重整制备 。500℃时,主要发生下列反应:
。500℃时,主要发生下列反应:Ⅰ.
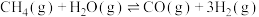 Ⅱ.
Ⅱ.
①已知:
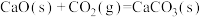
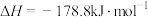 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是②下列操作中,能提高CH4(g)平衡转化率的是
A.加催化剂 B.增加CH4(g)用量 C.移除H2(g) D.恒温恒压,通入惰性气体
③500℃、恒压(Po)条件下,1 mol CH4(g)和1 mol H2O(g)反应达平衡时,CH4(g)的转化率为0.5,CO2(g)的物质的量为0.25 mol,则反应Ⅱ的平衡常数KP=
(3)实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点。可用氢气和二氧化碳在催化剂作用下合成甲醇:
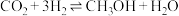 。
。恒压下,CO2和H2的起始物质的量之比为1∶3时,该反应甲醇的平衡产率随温度的变化如图所示。该反应的


(4)利用电催化可将CO2同时转化为多种燃料,装置如图:铜电极上产生CH4的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】铜基催化剂催化甲醇水蒸气重整制氢是液体燃料制氢的重要方向,主要包含甲醇水蒸气重整反应。甲醇分解反应和水气变换反应,具体反应方程式如下:
Ⅰ.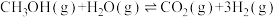
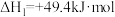
Ⅱ.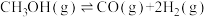

Ⅲ.
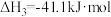
回答下列问题:
(1)则
_______ kJ⋅mol 。
。
(2)有利于提高甲醇平衡转化率的是_______ (填标号)。
A.增加 的用量
的用量
B.恒温恒压条件下通入Ar
C.升高温度
D.选择更高效的催化剂
E.及时分离出
(3)一定条件下,向压强为 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中
物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中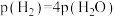 ,
,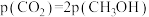 ,此时
,此时 的产率为
的产率为_______ ,反应Ⅱ的以分压表示的化学平衡常数 为
为_____ (用含 的代数式表示)。
的代数式表示)。
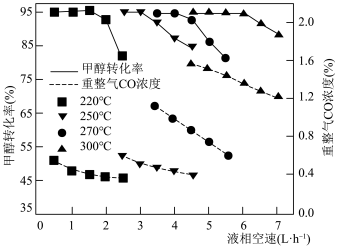
(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是_______ ,制氢产物可以用于车载燃料电池,CO含量太高会对电池产生巨大危害。甲醇水蒸气重整制氢的适宜条件是_______ ℃,_______ L·h 。
。 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。_______ 。
Ⅰ.
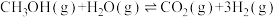
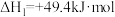
Ⅱ.
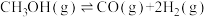

Ⅲ.

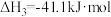
回答下列问题:
(1)则

 。
。(2)有利于提高甲醇平衡转化率的是
A.增加
 的用量
的用量B.恒温恒压条件下通入Ar
C.升高温度
D.选择更高效的催化剂
E.及时分离出

(3)一定条件下,向压强为
 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中
物质的量比为1∶1的混合气体,发生上述反应,达到平衡时,容器中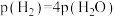 ,
,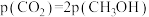 ,此时
,此时 的产率为
的产率为 为
为 的代数式表示)。
的代数式表示)。(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是
 。
。
 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。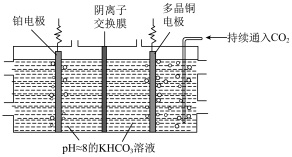
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】一碳化学是指以分子中只含一个碳原子的化合物(如一氧化碳、二氧化碳、甲烷、甲醇等)为原料,用化工的方法制造产品的化学体系的总称。我国能源比较丰富,煤的储量6000亿吨,居世界第三位,因此,发展一碳化学有着优越的条件和光明的前途。请回答下列有关问题。
(1)已知在一定温度下有如下反应:
Ⅰ.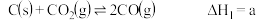 kJ/mol
kJ/mol
Ⅱ.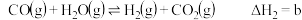 kJ/mol
kJ/mol
Ⅲ.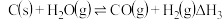 则
则
___________ kJ/mol。
(2)在一体积为2L的恒容密闭容器中,加入1mol 、2mol
、2mol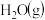 ,发生反应
,发生反应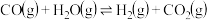 ,CO的平衡转化率随温度的变化如图所示:
,CO的平衡转化率随温度的变化如图所示:

①反应△H___ 0(填“”或“”)。
②在某温度下,能判断该反应是否达到化学平衡状态的依据是______ 。
a.混合气体中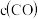 不再改变b.
不再改变b.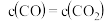
c.v正(H2O)=v逆(H2)d.混合气体的平均相对分子质量不再改变
③A点时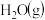 的转化率为
的转化率为___________ 。
④在体积不变时,要增大该反应的正反应速率可采取的措施是:___________ (写两条)。
⑤A点时该反应的平衡常数为___________ (保留到小数点后两位)。
(1)已知在一定温度下有如下反应:
Ⅰ.
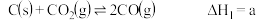 kJ/mol
kJ/molⅡ.
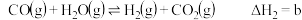 kJ/mol
kJ/molⅢ.
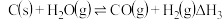 则
则
(2)在一体积为2L的恒容密闭容器中,加入1mol
 、2mol
、2mol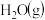 ,发生反应
,发生反应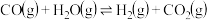 ,CO的平衡转化率随温度的变化如图所示:
,CO的平衡转化率随温度的变化如图所示:
①反应△H
②在某温度下,能判断该反应是否达到化学平衡状态的依据是
a.混合气体中
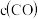 不再改变b.
不再改变b.
c.v正(H2O)=v逆(H2)d.混合气体的平均相对分子质量不再改变
③A点时
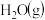 的转化率为
的转化率为④在体积不变时,要增大该反应的正反应速率可采取的措施是:
⑤A点时该反应的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.NH3(g)+3Cl2(g)=NCl3(1)+3HCl(g) ΔH回答下列问题:
(1)已知:Ⅱ.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH1
Ⅲ.N2(g)+3Cl2(g)=2NCl3(1) ΔH2
则ΔH=___  用含ΔH1和ΔH2的代数式表示
用含ΔH1和ΔH2的代数式表示 。
。
(2)向容积均为2L的甲、乙两个恒温密闭容器中分别加入4molNH3和4molCl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如表所示:
①0—80min内,容器甲中v(NH3)=___ (保留两位有效数字)。
②反应Ⅰ的ΔH___ 0(填“>”或“<”)。
③关于反应Ⅰ,下列说法正确的是___  填选项字母
填选项字母 。
。
A.容器内 =
= ,说明反应达到平衡状态
,说明反应达到平衡状态
B.容器内气体密度不变,说明反应达到平衡状态
C.达平衡后,加入一定量NCl3(l),平衡逆向移动
D.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④反应Ⅰ的平衡常数表达式K=__ 。温度为T2时,该反应的平衡常数K=__ 。
Ⅰ.NH3(g)+3Cl2(g)=NCl3(1)+3HCl(g) ΔH回答下列问题:
(1)已知:Ⅱ.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH1
Ⅲ.N2(g)+3Cl2(g)=2NCl3(1) ΔH2
则ΔH=
 用含ΔH1和ΔH2的代数式表示
用含ΔH1和ΔH2的代数式表示 。
。(2)向容积均为2L的甲、乙两个恒温密闭容器中分别加入4molNH3和4molCl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如表所示:
| 时间 | 0 | 40 | 80 | 120 | 160 |
| 容器甲(T1) | 4.0 | 3.0 | 2.0 | 1.6 | 1.6 |
| 容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0—80min内,容器甲中v(NH3)=
②反应Ⅰ的ΔH
③关于反应Ⅰ,下列说法正确的是
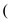 填选项字母
填选项字母 。
。A.容器内
 =
= ,说明反应达到平衡状态
,说明反应达到平衡状态B.容器内气体密度不变,说明反应达到平衡状态
C.达平衡后,加入一定量NCl3(l),平衡逆向移动
D.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④反应Ⅰ的平衡常数表达式K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】汽车等交通工具为出行、物流带来了舒适和方便。然而,这些燃油车排放的尾气中含有大量的氮氧化物,也会对人体健康和环境产生危害。
(1)汽车尾气中NO生成过程的能量变化如下图所示。1molN2和1molO2完全反应生成NO_______ (填“吸收”或“放出”)的能量为_______ 。

(2)某课题小组利用活性炭对NO进行吸附: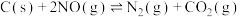 ,向恒压密闭容器中加入足量活性炭和一定量NO气体,能说明该反应已达平衡状态的是_______。
,向恒压密闭容器中加入足量活性炭和一定量NO气体,能说明该反应已达平衡状态的是_______。
(3)在上述实验条件下,反应相同时间,测得NO的转化率随温度的变化曲线如下图所示,1050K前,NO的转化率随温度升高而增大的原因是_______ 。由该曲线的变化趋势可推知NO的吸附反应是_______ (填“吸热”或“放热”)反应。

(4)在上述实验条件下,1100K时,平衡时CO2的体积分数是_______ 。
(1)汽车尾气中NO生成过程的能量变化如下图所示。1molN2和1molO2完全反应生成NO

(2)某课题小组利用活性炭对NO进行吸附:
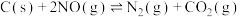 ,向恒压密闭容器中加入足量活性炭和一定量NO气体,能说明该反应已达平衡状态的是_______。
,向恒压密闭容器中加入足量活性炭和一定量NO气体,能说明该反应已达平衡状态的是_______。| A.体系的压强不再变化 |
B.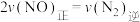 |
| C.混合气体的平均相对分子质量不变 |
| D.体系中活性炭的质量不再变化 |
(3)在上述实验条件下,反应相同时间,测得NO的转化率随温度的变化曲线如下图所示,1050K前,NO的转化率随温度升高而增大的原因是

(4)在上述实验条件下,1100K时,平衡时CO2的体积分数是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】二甲醚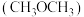 是含氢量高、廉价易得、无毒的优良制氢原料,二甲醚水蒸气重整制氢体系中发生如下反应:
是含氢量高、廉价易得、无毒的优良制氢原料,二甲醚水蒸气重整制氢体系中发生如下反应:
主反应: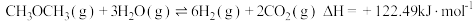
副反应: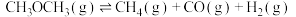
回答下列问题:
(1)上述两反应涉及的六种分子中,是非极性分子的是___________ (写出分子式)。CH4分子中的碳元素位于周期表的___________ 区。
(2)主反应在___________ (填“高温”或“低温”)下能自发进行。根据主反应,从平衡角度考虑能提高H2产率的措施有___________ (任写一种)。
(3)以水煤气作为原料制取H2可以减少副反应带来的损耗并提高H2的产量,如图是CO与水反应的历程图(附着在催化剂表面上的用·标识)。
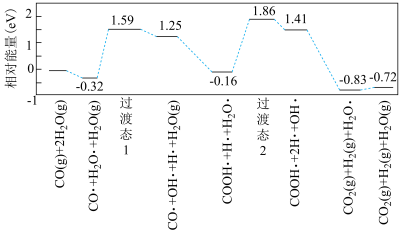
该反应历程决速步的反应方程式为___________ 。总反应的焓变___________ (填“<”或“>”)0。
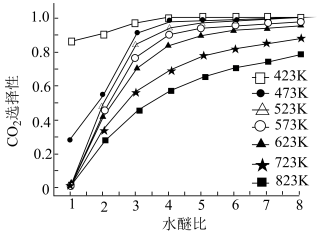
(4)如图是CO2选择性随水醚比变化的曲线,由图可知,工业上一般在___________ 条件下进行二甲醚制氢(考虑水醚比和温度两个角度)。
(5)向恒压为p的体系中充入物质的量之比为1:3的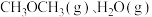 发生二甲醚水蒸气重整制氢反应,达到平衡时,二甲醚转化率为25%,且产物中
发生二甲醚水蒸气重整制氢反应,达到平衡时,二甲醚转化率为25%,且产物中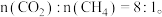
①以下说法不能判断该反应达到平衡状态的是___________ (填字母)。
A.混合气体中各物质分压保持不变 B.混合气体的密度保持不变
C.混合气体平均摩尔质量保持不变 D.消耗 时,有
时,有 生成
生成
②该温度下达到平衡时,H2O的转化率为___________ 。
 是含氢量高、廉价易得、无毒的优良制氢原料,二甲醚水蒸气重整制氢体系中发生如下反应:
是含氢量高、廉价易得、无毒的优良制氢原料,二甲醚水蒸气重整制氢体系中发生如下反应:主反应:
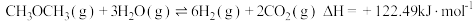
副反应:
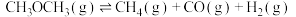
回答下列问题:
(1)上述两反应涉及的六种分子中,是非极性分子的是
(2)主反应在
(3)以水煤气作为原料制取H2可以减少副反应带来的损耗并提高H2的产量,如图是CO与水反应的历程图(附着在催化剂表面上的用·标识)。

该反应历程决速步的反应方程式为
(4)如图是CO2选择性随水醚比变化的曲线,由图可知,工业上一般在

(5)向恒压为p的体系中充入物质的量之比为1:3的
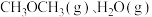 发生二甲醚水蒸气重整制氢反应,达到平衡时,二甲醚转化率为25%,且产物中
发生二甲醚水蒸气重整制氢反应,达到平衡时,二甲醚转化率为25%,且产物中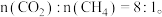
①以下说法不能判断该反应达到平衡状态的是
A.混合气体中各物质分压保持不变 B.混合气体的密度保持不变
C.混合气体平均摩尔质量保持不变 D.消耗
 时,有
时,有 生成
生成②该温度下达到平衡时,H2O的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一、
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
(1)写出该反应的化学平衡常数表达式:___________ 。
(2)将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于___________ 。
(3)平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”)。
(4)Ⅱ.用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH =-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2整个过程中转移的电子总数为___________ ,放出的热量为:___________ kJ。
(5)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是
Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是___________ ;图中表示平衡混合物中CO的含量最高的一段时间是___________ 。
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
 2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
(1)写出该反应的化学平衡常数表达式:
(2)将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于
(3)平衡状态由A变到B时,平衡常数K(A)
(4)Ⅱ.用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH =-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2整个过程中转移的电子总数为
(5)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是
Si3N4(s)+6CO(g)。达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如图。图中t4时引起平衡移动的条件可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】随着经济全球化,我国已于2020年全面脱贫,家用汽车普及,有效处理汽车排放的尾气是需要进行研究的一项重要课题。利用催化技术可将尾气中的NO和CO转化成CO2和N2,为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究:
(1)资料查阅①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。完成以下实验设计表格
(图象分析与结论)利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如图:
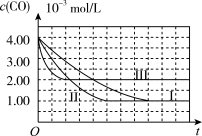
(2)计算第II组实验中,达平衡时NO的浓度为________ ;
(3)由曲线I、II可知,增大催化剂比表面积,汽车尾气转化速率____________________ (填“增大”、“减小”、“无影响”)。
(1)资料查阅①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。完成以下实验设计表格
| 实验编号 | 实验目的 | T /℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| I | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| II | ① | 280 | 6.50×10-3 | 4.00×10-3 | 120 |
| III | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | ② |

(2)计算第II组实验中,达平衡时NO的浓度为
(3)由曲线I、II可知,增大催化剂比表面积,汽车尾气转化速率
您最近一年使用:0次



