下列对化学平衡移动的分析中,不正确的是
①有气体参加的反应平衡时,若减小反应器容积时,平衡则向气体体积增大的方向移动
②有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
③已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
④已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,H2的转化率一定升高
①有气体参加的反应平衡时,若减小反应器容积时,平衡则向气体体积增大的方向移动
②有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
③已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
④已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,H2的转化率一定升高
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
更新时间:2020-11-17 19:13:24
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】新制氯水中加入下列物质后,能增强漂白性的是
| A.稀硫酸 | B. | C. | D. |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料。在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH→CO(OCH3)2+ H2O 。某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON ) 的影响来评价催化剂的催化效果,计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量。根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是
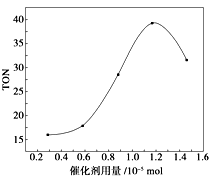

| A.由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 |
| B.在反应体系中添加合适的吸水剂,将提高该反应的TON |
| C.当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点 |
| D.当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】重铬酸钾溶液中存在的平衡:H2O+Cr2O (aq,橙色)
(aq,橙色) 2CrO
2CrO (aq,黄色)+2H+(aq),下列说法正确的是
(aq,黄色)+2H+(aq),下列说法正确的是
 (aq,橙色)
(aq,橙色) 2CrO
2CrO (aq,黄色)+2H+(aq),下列说法正确的是
(aq,黄色)+2H+(aq),下列说法正确的是A.该反应的平衡常数的表达式为K=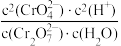 |
| B.加水稀释重铬酸钾溶液,所有离子浓度均减小 |
| C.向橙黄色的重铬酸钾溶液中滴加少量的浓盐酸,溶液橙色加深 |
| D.由于Ag2CrO4难溶于水,向重铬酸钾溶液中滴加AgNO3溶液,溶液的pH值增大 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列选项中的操作及现象与原因或结论不对应的是
| 选项 | 操作及现象 | 原因或结论 |
| A | 向 中加入 中加入 ,产生气泡的速率加快 ,产生气泡的速率加快 |  降低了反应所需的活化能 降低了反应所需的活化能 |
| B | 向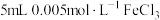 溶液中加入 溶液中加入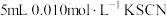 溶液,溶液呈红色,再滴加几滴 溶液,溶液呈红色,再滴加几滴 的 的 溶液,溶液颜色变浅 溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
| C | 将盛有 气体的密闭容器浸泡在热水中,容器内气体颜色变深 气体的密闭容器浸泡在热水中,容器内气体颜色变深 |   ,平衡向生成 ,平衡向生成 方向移动 方向移动 |
| D | 在密闭容器中发生反应: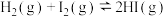 ,加压,气体颜色变深 ,加压,气体颜色变深 | 增大压强,平衡不移动,但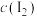 增大 增大 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】在一定温度下的密闭容器中发生反应: ,平衡时测得A的浓度为
,平衡时测得A的浓度为 。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为
。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为 。下列有关判断错误的是
。下列有关判断错误的是
 ,平衡时测得A的浓度为
,平衡时测得A的浓度为 。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为
。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为 。下列有关判断错误的是
。下列有关判断错误的是A.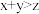 | B.平衡向逆反应方向移动 |
| C.A的转化率降低 | D.C的体积分数增大 |
您最近半年使用:0次
【推荐2】以甲烷为原料合成甲醇的反应如下:
反应I:CH4(g)+CO2(g) ⇌2CO(g) + 2H2(g) ∆H1= +247 kJ/mol
反应II:CO(g)+2H2(g)⇌CH3OH(g) ∆H2= -90kJ/mol
已知:T1℃时,反应II的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法正确的是
反应I:CH4(g)+CO2(g) ⇌2CO(g) + 2H2(g) ∆H1= +247 kJ/mol
反应II:CO(g)+2H2(g)⇌CH3OH(g) ∆H2= -90kJ/mol
已知:T1℃时,反应II的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法正确的是
| A.反应I中,使用催化剂可以减小∆H1,提高反应速率 |
| B.反应II中,加热或加压均可提高原料气的反应速率及平衡转化率 |
| C.由数据可判断反应II 的温度:T1> T2 |
| D.CO(g)+CH3OH(g)⇌CH4(g) +CO2(g) ∆H= -157 kJ |
您最近半年使用:0次

 Cr2O
Cr2O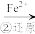 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3 的值增大
的值增大
 bB(g)+cC(g),向密闭容器中充入1molA,达平衡时,体系中B的体积分数随温度、压强的变化关系如图所示,下列判断正确的是
bB(g)+cC(g),向密闭容器中充入1molA,达平衡时,体系中B的体积分数随温度、压强的变化关系如图所示,下列判断正确的是


