硫代硫酸钠(Na2S2O3,M=158g/mol)又称大苏打,可用作定影剂、还原剂。某兴趣小组拟制备硫代硫酸钠晶体并测定其产品的纯度。查阅资料知:
①Na2S2O3·5H2O是无色透明晶体,易溶于水,遇酸易分解
②向Na2CO3和Na2S的混合溶液中通入SO2可制得Na2S2O3
Ⅰ.制备硫代硫酸钠。实验装置如图所示(省略夹持装置)
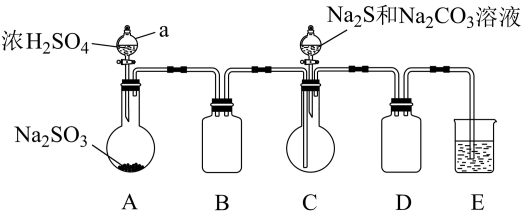
(1)检查装置气密性,然后按图示加入试剂。装置D的作用是_______ ;装置E中应盛放的试剂是_______ 。
(2)装置A中发生反应的化学方程式为_______
(3)装置C中发生反应的化学方程式为_______
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤装置C中混合物,滤液经蒸发浓缩,冷却结晶、过滤、洗涤、干燥,得到产品。洗涤时为尽可能避免产品损失,应选用的试剂是_______ (填字母序号)
A.水 B.乙醇 C、氢氧化钠溶液 D.稀盐酸
Ⅱ.测定硫代硫酸钠产品的纯度。称取10.0g产品配成100mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:向锥形瓶中加入0.10mol/LK2Cr2O7(硫酸酸化)标准溶液20.0mL,再加入过量的KI溶液,发生反应:Cr2O +6I-+14H+=3I2+2Cr3++7H2O,然后加入淀粉溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应:I2+2S2O
+6I-+14H+=3I2+2Cr3++7H2O,然后加入淀粉溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应:I2+2S2O =S4O
=S4O +2I-,重复实验,平均消耗Na2S2O3样品溶液的体积为20.0mL。
+2I-,重复实验,平均消耗Na2S2O3样品溶液的体积为20.0mL。
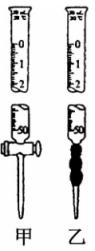
(5)取用硫酸酸化的K2Cr2O7标准溶液可选用的仪器是_______ (填“甲”或“乙”)
(6)滴定终点时溶液的颜色变化是_______
(7)根据上述有关数据,该样品中Na2S2O3的质量分数为_______
(8)下列操作可能使测量结果偏低的是_______ (填字母)
A.盛装硫代硫酸钠样品溶液的滴定管没有润洗
B.锥形瓶中残留少量水
C.读数时滴定前仰视,滴定后俯视
①Na2S2O3·5H2O是无色透明晶体,易溶于水,遇酸易分解
②向Na2CO3和Na2S的混合溶液中通入SO2可制得Na2S2O3
Ⅰ.制备硫代硫酸钠。实验装置如图所示(省略夹持装置)

(1)检查装置气密性,然后按图示加入试剂。装置D的作用是
(2)装置A中发生反应的化学方程式为
(3)装置C中发生反应的化学方程式为
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤装置C中混合物,滤液经蒸发浓缩,冷却结晶、过滤、洗涤、干燥,得到产品。洗涤时为尽可能避免产品损失,应选用的试剂是
A.水 B.乙醇 C、氢氧化钠溶液 D.稀盐酸
Ⅱ.测定硫代硫酸钠产品的纯度。称取10.0g产品配成100mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:向锥形瓶中加入0.10mol/LK2Cr2O7(硫酸酸化)标准溶液20.0mL,再加入过量的KI溶液,发生反应:Cr2O
 +6I-+14H+=3I2+2Cr3++7H2O,然后加入淀粉溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应:I2+2S2O
+6I-+14H+=3I2+2Cr3++7H2O,然后加入淀粉溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应:I2+2S2O =S4O
=S4O +2I-,重复实验,平均消耗Na2S2O3样品溶液的体积为20.0mL。
+2I-,重复实验,平均消耗Na2S2O3样品溶液的体积为20.0mL。(5)取用硫酸酸化的K2Cr2O7标准溶液可选用的仪器是

(6)滴定终点时溶液的颜色变化是
(7)根据上述有关数据,该样品中Na2S2O3的质量分数为
(8)下列操作可能使测量结果偏低的是
A.盛装硫代硫酸钠样品溶液的滴定管没有润洗
B.锥形瓶中残留少量水
C.读数时滴定前仰视,滴定后俯视
更新时间:2020-12-23 14:36:51
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】人们借助数字传感器可以进行更精准的定量实验研究。利用pH传感器研究CO2、SO2与水的反应,实验装置如图所示。
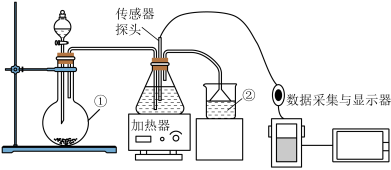
(1)CO2的电子式为___________ 。
(2)装置①的名称为___________ ,装置②中所装液体为___________ 。
(3)写出用以上装置制备SO2的化学方程式___________ 。
(4)通过pH传感器测定CO2和SO2分别溶于水后pH的变化,得到如图1;分别加热两溶液,测得pH随时间变化曲线如图2(已知在30°C101kPa下,CO2溶液度为1.26g/L;SO2溶解度为78g/L。)

①请解释图1中两溶液的pH不同的原因___________ 。
②请结合方程式解释图2中曲线④下降的原因:___________ 。
(5)利用SO2传感器来检测空气中SO2的含量,工作原理如下图所示,该装置的阴极电极反应式为:_________ 。
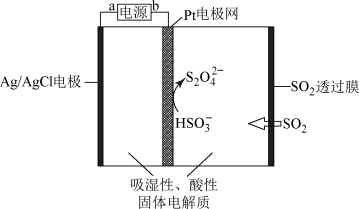
已知SO2穿过透过膜后能完全转化为 。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为
。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为___________ g/L。(用含V、a的式子表示) 。

(1)CO2的电子式为
(2)装置①的名称为
(3)写出用以上装置制备SO2的化学方程式
(4)通过pH传感器测定CO2和SO2分别溶于水后pH的变化,得到如图1;分别加热两溶液,测得pH随时间变化曲线如图2(已知在30°C101kPa下,CO2溶液度为1.26g/L;SO2溶解度为78g/L。)

①请解释图1中两溶液的pH不同的原因
②请结合方程式解释图2中曲线④下降的原因:
(5)利用SO2传感器来检测空气中SO2的含量,工作原理如下图所示,该装置的阴极电极反应式为:

已知SO2穿过透过膜后能完全转化为
 。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为
。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】下图为某同学制备并探究SO2的性质的实验装置图。回答下列问题。
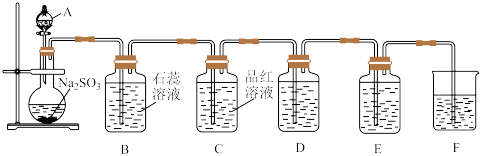
(1)仪器A的名称是________________ 。
(2)为实验安全,如何检查该装置的气密性:__________________ 。
(3)仪器A中所盛试剂最好是____________ (填标号)。
a. 70%的硫酸 b. 10%的硫酸 c.浓盐酸 d.稀硝酸
(4)B装置中的现象是____________________ 。
(5)C装置是为了验证SO2的_______________ 性。
(6)D装置中盛的是Na2S溶液,当SO2过量时,其反应的离子方程式为___________ 。
(7)E装置很好地证明了SO2的还原性,所盛试剂可以是______________ (填标号)。
①酸性KMnO4溶液 ②碘水 ③H2O2溶液 ④澄清石灰水
(8)F装置中盛装过量的NaOH溶液,其作用是________________ 。

(1)仪器A的名称是
(2)为实验安全,如何检查该装置的气密性:
(3)仪器A中所盛试剂最好是
a. 70%的硫酸 b. 10%的硫酸 c.浓盐酸 d.稀硝酸
(4)B装置中的现象是
(5)C装置是为了验证SO2的
(6)D装置中盛的是Na2S溶液,当SO2过量时,其反应的离子方程式为
(7)E装置很好地证明了SO2的还原性,所盛试剂可以是
①酸性KMnO4溶液 ②碘水 ③H2O2溶液 ④澄清石灰水
(8)F装置中盛装过量的NaOH溶液,其作用是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】下表是甲城市某日空气质量报告的部分内容:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
[探究实验]:用下图所示装置进行实验。
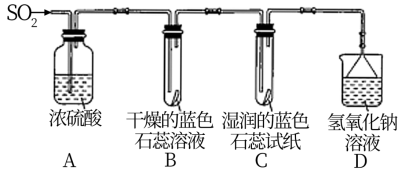
(1)写出实验室由铜和浓硫酸反应制取 的化学方程式
的化学方程式_______ ;
(2)A装置的作用是______ (填“干燥”或“氧化”) 气体。
气体。
(3)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变红。说明 与水反应生成一种酸,该酸的化学式是
与水反应生成一种酸,该酸的化学式是______ ;
(4)写出D装置发生反应的离子方程式________ ;D中扣上一个倒置漏斗的作用是________ 。
[查阅资料]
(5) 形成酸雨的另一途径;
形成酸雨的另一途径; 与空气中
与空气中 的在飘尘的作用下反应生成
的在飘尘的作用下反应生成 ,
, 溶于降水生成
溶于降水生成 。在此过程中飘尘作
。在此过程中飘尘作_____ ,写出第一步反应生成 的化学方程式
的化学方程式________ ;
[探究结论] 与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
[知识联想]
(6)酸雨造成的危害是:_______ (举一例)。
(7)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为________ ,是造成酸雨的另一主要原因。
[提出建议]
(8)本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加入_________ (填“水”或“乙醇”)。
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 |  | Ⅱ | 良 |
[探究实验]:用下图所示装置进行实验。

(1)写出实验室由铜和浓硫酸反应制取
 的化学方程式
的化学方程式(2)A装置的作用是
 气体。
气体。(3)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变红。说明
 与水反应生成一种酸,该酸的化学式是
与水反应生成一种酸,该酸的化学式是(4)写出D装置发生反应的离子方程式
[查阅资料]
(5)
 形成酸雨的另一途径;
形成酸雨的另一途径; 与空气中
与空气中 的在飘尘的作用下反应生成
的在飘尘的作用下反应生成 ,
, 溶于降水生成
溶于降水生成 。在此过程中飘尘作
。在此过程中飘尘作 的化学方程式
的化学方程式[探究结论]
 与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。[知识联想]
(6)酸雨造成的危害是:
(7)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为
[提出建议]
(8)本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加入
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】用低品铜矿(主要含CuS、FeO)制备Cu2O的一种流程如下:
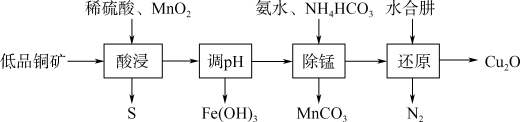
(1)“酸浸”中CuS发生反应的化学方程式为_______ 。
(2)写出基态Mn2+的核外电子排布式_______ 。
(3)“调pH”后溶液pH约4,此时溶液Fe3+物质的量浓度为_______ 。[Ksp[Fe(OH)3]=1×10-38]
(4)“除锰”时的离子方程式为_______ 。
(5)“还原”前需测定铜氨离子{[Cu(NH3)4]2+}的浓度来确定水合肼的用量。20.0mL除去Mn2+的铜氨溶液于100mL容量瓶中,加水稀释至刻度;准确量取25.00mL稀释后的溶液于锥形瓶中,滴加3mol·L-1H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000mol·L-1Na2S2O3标准溶液滴定至终点(反应为2Cu2++4I-=2CuI+I2,I2+2S2O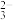 =2I-+S4O
=2I-+S4O ),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度
),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度_______ 。
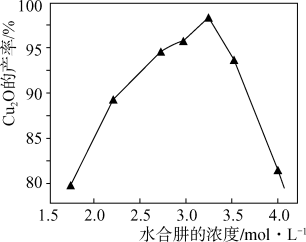
(6)保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。水合肼浓度大于3.25mol·L-1时Cu2O的产率下降,[Cu(NH3)4]2+的转化率仍增大,可能的原因是_______ 。

(1)“酸浸”中CuS发生反应的化学方程式为
(2)写出基态Mn2+的核外电子排布式
(3)“调pH”后溶液pH约4,此时溶液Fe3+物质的量浓度为
(4)“除锰”时的离子方程式为
(5)“还原”前需测定铜氨离子{[Cu(NH3)4]2+}的浓度来确定水合肼的用量。20.0mL除去Mn2+的铜氨溶液于100mL容量瓶中,加水稀释至刻度;准确量取25.00mL稀释后的溶液于锥形瓶中,滴加3mol·L-1H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000mol·L-1Na2S2O3标准溶液滴定至终点(反应为2Cu2++4I-=2CuI+I2,I2+2S2O
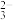 =2I-+S4O
=2I-+S4O ),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度
),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度(6)保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。水合肼浓度大于3.25mol·L-1时Cu2O的产率下降,[Cu(NH3)4]2+的转化率仍增大,可能的原因是

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】生活中常用一定浓度的过氧乙酸(CH3COOOH)溶液作消毒液。某化学小组对过氧乙酸的制备和性质进行如图探究(夹持、加热及搅拌装置均未画出)。
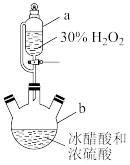
I.在磁力搅拌作用下,向仪器b中加入一定量的冰醋酸和浓硫酸,打开开关K,缓缓滴入适量30%的H2O2溶液,控制温度在20~30℃。
已知:过氧乙酸的氧化性强于高锰酸钾的。
(1)仪器b的名称为___ 。
(2)仪器a与分液漏斗相比,其优点是____ 。
(3)控制温度在20~30℃的目的是____ 。
Ⅱ.过氧乙酸样品中常含有残留的H2O2。样品中过氧乙酸的浓度为c0mol·L-1时,发生如下反应:
①CH3COOOH+2I-+2H+=CH3COOH+I2+H2O;
②H2O2+2I-+2H+=I2+2H2O;
③2S2O +I2=2I-+S4O
+I2=2I-+S4O 。
。
ⅰ.取V0mL待测液并用硫酸酸化,再用c1mol·L-1的KMnO4标准溶液滴定待测液至溶液呈粉红色,消耗V1mLKMnO4标准溶液。
ii.另取V2mL(V2≠V0)待测液,加入过量的KI溶液和几滴淀粉,并用硫酸酸化,再用c2mol·L-1的Na2S2O3标准溶液滴定,达到滴定终点时消耗V3mLNa2S2O3标准溶液。
(4)i中发生反应的离子方程式为___ 。ii中用Na2S2O3标准溶液进行滴定时,达到滴定终点的标志是___ ,过氧乙酸的浓度c0mol·L-1=___ mol·L-1(用含V0、c1、V1、c2、V2、V3的代数式表示)。

I.在磁力搅拌作用下,向仪器b中加入一定量的冰醋酸和浓硫酸,打开开关K,缓缓滴入适量30%的H2O2溶液,控制温度在20~30℃。
已知:过氧乙酸的氧化性强于高锰酸钾的。
(1)仪器b的名称为
(2)仪器a与分液漏斗相比,其优点是
(3)控制温度在20~30℃的目的是
Ⅱ.过氧乙酸样品中常含有残留的H2O2。样品中过氧乙酸的浓度为c0mol·L-1时,发生如下反应:
①CH3COOOH+2I-+2H+=CH3COOH+I2+H2O;
②H2O2+2I-+2H+=I2+2H2O;
③2S2O
 +I2=2I-+S4O
+I2=2I-+S4O 。
。ⅰ.取V0mL待测液并用硫酸酸化,再用c1mol·L-1的KMnO4标准溶液滴定待测液至溶液呈粉红色,消耗V1mLKMnO4标准溶液。
ii.另取V2mL(V2≠V0)待测液,加入过量的KI溶液和几滴淀粉,并用硫酸酸化,再用c2mol·L-1的Na2S2O3标准溶液滴定,达到滴定终点时消耗V3mLNa2S2O3标准溶液。
(4)i中发生反应的离子方程式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】草酸及其化合物在工业中有重要作用,例如:草酸可用于除铁锈,反应的离子方程式为: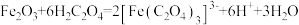 ;草酸铁铵
;草酸铁铵 是一种常用的金属着色剂。
是一种常用的金属着色剂。
(1)草酸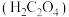 是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示

① 时,装置A中生成
时,装置A中生成 ,同时生成
,同时生成 。写出该反应的化学方程式
。写出该反应的化学方程式_____________ 。
②该实验中催化剂浓硫酸用量不宜过量的原因是_____________ 。
(2)草酸铁铵晶体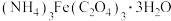 易溶于水,常温下其水溶
易溶于水,常温下其水溶 为4.0~5.0。制备草酸铁铵晶体的实验方案为:边搅拌边向
为4.0~5.0。制备草酸铁铵晶体的实验方案为:边搅拌边向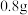 氧化铁中
氧化铁中_____________ 。(须用的试剂为 、
、 氨水、无水乙醇)
氨水、无水乙醇)
(3)为测定草酸铁铵晶体 的纯度,进行下列实验:称取样品
的纯度,进行下列实验:称取样品 ,加稀硫酸溶解后,配成
,加稀硫酸溶解后,配成 溶液。取
溶液。取 配制的溶液,用浓度为
配制的溶液,用浓度为 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知: (未配平)
(未配平)
通过计算,确定样品中 的质量分数
的质量分数_____________ (写出计算过程)。
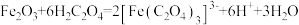 ;草酸铁铵
;草酸铁铵 是一种常用的金属着色剂。
是一种常用的金属着色剂。(1)草酸
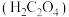 是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
①
 时,装置A中生成
时,装置A中生成 ,同时生成
,同时生成 。写出该反应的化学方程式
。写出该反应的化学方程式②该实验中催化剂浓硫酸用量不宜过量的原因是
(2)草酸铁铵晶体
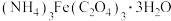 易溶于水,常温下其水溶
易溶于水,常温下其水溶 为4.0~5.0。制备草酸铁铵晶体的实验方案为:边搅拌边向
为4.0~5.0。制备草酸铁铵晶体的实验方案为:边搅拌边向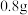 氧化铁中
氧化铁中 、
、 氨水、无水乙醇)
氨水、无水乙醇)(3)为测定草酸铁铵晶体
 的纯度,进行下列实验:称取样品
的纯度,进行下列实验:称取样品 ,加稀硫酸溶解后,配成
,加稀硫酸溶解后,配成 溶液。取
溶液。取 配制的溶液,用浓度为
配制的溶液,用浓度为 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:
 (未配平)
(未配平)通过计算,确定样品中
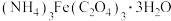 的质量分数
的质量分数
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】高铁酸钾( )是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
)是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
资料:①高铁酸钾在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定,易分解生成氧气;
②高铁酸钾易溶于水,不溶于乙醇等有机溶剂;
③高铁酸钾具有强氧化性,且氧化性强于高锰酸钾。
实验室常用次氯酸钠氧化法制备高铁酸钾,具体实验步骤如下:
Ⅰ.用托盘天平称取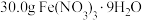 ,另取25.5g NaClO配成100mL溶液;
,另取25.5g NaClO配成100mL溶液;
Ⅱ.在冰水冷却的环境中向NaClO溶液中加入足量NaOH固体,直至无法溶解,得到NaClO的强碱性饱和溶液,缓慢少量分批加入 ,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
Ⅲ.继续充分搅拌,向上述反应液中加入固体NaOH至饱和,直至溶液成粘稠状,过滤,得到滤液;
Ⅳ.向上述滤液中加入KOH固体至饱和,过滤、用乙醇洗涤所得固体,在80℃真空条件下烘干得到产品。
回答下列问题:
(1)配制Ⅰ中的NaClO溶液,下列仪器不需要的是___________ (填仪器名称)。
(2)Ⅱ中反应生成高铁酸盐的离子方程式为___________ 。实验中若以 代替
代替 作铁源,
作铁源, 的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比
的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比 大,使得NaCl结晶去除率较低;另一个原因是
大,使得NaCl结晶去除率较低;另一个原因是___________ 。
(3)Ⅳ中加入KOH固体至饱和的作用是___________ ,说明此温度下
___________ 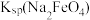 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)高铁酸钾溶液在中性条件下不稳定的原因是___________ (用离子方程式解释)。
(5)滴定法测定高铁酸钾样品的纯度,其方法是:称取2.0g产品溶于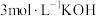 溶液中,加入足量
溶液中,加入足量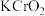 ,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用
,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用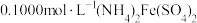 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00mL。
溶液的体积为24.00mL。
①定容后,加入稀硫酸酸化的目的是___________ ;
②该 产品的纯度为
产品的纯度为___________ (保留三位有效数字)。
 )是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
)是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。资料:①高铁酸钾在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定,易分解生成氧气;
②高铁酸钾易溶于水,不溶于乙醇等有机溶剂;
③高铁酸钾具有强氧化性,且氧化性强于高锰酸钾。
实验室常用次氯酸钠氧化法制备高铁酸钾,具体实验步骤如下:
Ⅰ.用托盘天平称取
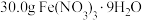 ,另取25.5g NaClO配成100mL溶液;
,另取25.5g NaClO配成100mL溶液;Ⅱ.在冰水冷却的环境中向NaClO溶液中加入足量NaOH固体,直至无法溶解,得到NaClO的强碱性饱和溶液,缓慢少量分批加入
 ,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;Ⅲ.继续充分搅拌,向上述反应液中加入固体NaOH至饱和,直至溶液成粘稠状,过滤,得到滤液;
Ⅳ.向上述滤液中加入KOH固体至饱和,过滤、用乙醇洗涤所得固体,在80℃真空条件下烘干得到产品。
回答下列问题:
(1)配制Ⅰ中的NaClO溶液,下列仪器不需要的是

(2)Ⅱ中反应生成高铁酸盐的离子方程式为
 代替
代替 作铁源,
作铁源, 的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比
的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比 大,使得NaCl结晶去除率较低;另一个原因是
大,使得NaCl结晶去除率较低;另一个原因是(3)Ⅳ中加入KOH固体至饱和的作用是

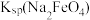 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)高铁酸钾溶液在中性条件下不稳定的原因是
(5)滴定法测定高铁酸钾样品的纯度,其方法是:称取2.0g产品溶于
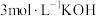 溶液中,加入足量
溶液中,加入足量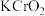 ,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用
,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用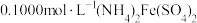 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00mL。
溶液的体积为24.00mL。①定容后,加入稀硫酸酸化的目的是
②该
 产品的纯度为
产品的纯度为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
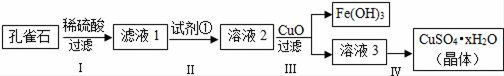
(1)步骤Ⅰ中涉及的主要反应用离子方程式表示为_____ .
(2)步骤Ⅱ中试剂①是_____ (填代号).
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO的目的是_____ .
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____ 、_____ 、过滤等操作.
(5)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式_____ .
(6)测定硫酸铜晶体(CuSO4•xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在____ (填实验仪器名称)中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=_____ (计算结果精确到0.1).

(1)步骤Ⅰ中涉及的主要反应用离子方程式表示为
(2)步骤Ⅱ中试剂①是
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅲ加入CuO的目的是
(4)步骤Ⅳ获得硫酸铜晶体,需要经过
(5)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式
(6)测定硫酸铜晶体(CuSO4•xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】立德粉 (也称锌钡白),是一种常用白色颜料。以重晶石(
(也称锌钡白),是一种常用白色颜料。以重晶石( )为原料,可按如下工艺生产立德粉:
)为原料,可按如下工艺生产立德粉:
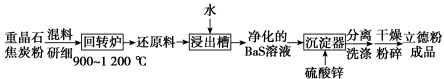
(1)在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,同时生成一种有毒的气体,该过程的化学方程式为_______ 。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 和一种清洁能源气体,该反应的化学方程式为
和一种清洁能源气体,该反应的化学方程式为_______ 。
(2)在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的_______ (填化学式)。
(3)沉淀器中反应的离子方程式为_______ 。
(4)成品中 的含量可以用“碘量法”测得。称取
的含量可以用“碘量法”测得。称取 样品,置于碘量瓶中,移取
样品,置于碘量瓶中,移取 的
的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应
溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。过量的
,有单质硫析出。过量的 用
用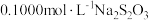 溶液滴定,反应式为
溶液滴定,反应式为 。测定时消耗
。测定时消耗 溶液体积
溶液体积 。样品中
。样品中 的含量为
的含量为_______ (写出表达式)。
(5) 还原性较强,在溶液中易被
还原性较强,在溶液中易被 氧化成
氧化成 。用过量的
。用过量的 作脱氯剂,该反应的离子方程式为
作脱氯剂,该反应的离子方程式为_______ 。
 (也称锌钡白),是一种常用白色颜料。以重晶石(
(也称锌钡白),是一种常用白色颜料。以重晶石( )为原料,可按如下工艺生产立德粉:
)为原料,可按如下工艺生产立德粉:
(1)在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,同时生成一种有毒的气体,该过程的化学方程式为
 和一种清洁能源气体,该反应的化学方程式为
和一种清洁能源气体,该反应的化学方程式为(2)在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的
(3)沉淀器中反应的离子方程式为
(4)成品中
 的含量可以用“碘量法”测得。称取
的含量可以用“碘量法”测得。称取 样品,置于碘量瓶中,移取
样品,置于碘量瓶中,移取 的
的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应
溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。过量的
,有单质硫析出。过量的 用
用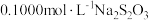 溶液滴定,反应式为
溶液滴定,反应式为 。测定时消耗
。测定时消耗 溶液体积
溶液体积 。样品中
。样品中 的含量为
的含量为(5)
 还原性较强,在溶液中易被
还原性较强,在溶液中易被 氧化成
氧化成 。用过量的
。用过量的 作脱氯剂,该反应的离子方程式为
作脱氯剂,该反应的离子方程式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由一氧化氮与氯气在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点是-64.5℃,沸点是-5.5℃,遇水易水解。回答下列问题:
(1)实验室制备原料气NO和Cl2的装置如下图所示。
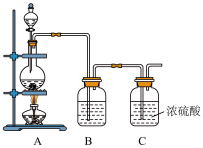
①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为______________ 。
②实验室制Cl2时,装置B的作用是______________________ 。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_____________ 。
②装置D中的现象为_____________________________________________ 。
③装置E中无水氯化钙的作用为_______________________________ 。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是______________ 。
(1)实验室制备原料气NO和Cl2的装置如下图所示。

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为
②实验室制Cl2时,装置B的作用是
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为
②装置D中的现象为
③装置E中无水氯化钙的作用为
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】氯化铁(FeCl3)是一种易潮解、易升华的无机化工产品。某同学在实验室通过制备氯气(Cl2),并用干燥纯净的氯气与 Fe 反应制备 FeCl3,装置如图所示(部分夹持仪器已省略):
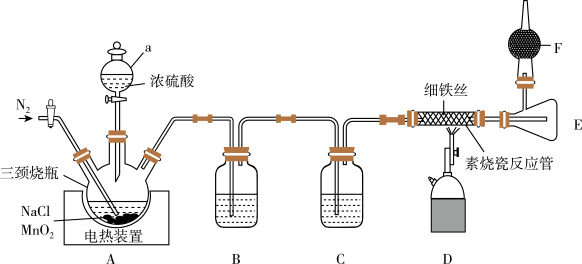
回答下列问题:
(1)仪器 a 的名称是_______ 。
(2)写出三颈烧瓶中反应的化学方程式_______ 。
(3)实验开始前需要通入一段时间 N2,其目的是_______ 。
(4)装置 B、C 盛放的试剂依次是_______ 、_______ 。
(5)选择下面合适的试剂_______ (填字母)放入装置 F 中。去掉装置 F,会造成的后果是_______ 。
A.浓硫酸 B.CaCl2 C.无水硫酸铜 D.碱石灰
(6)FeCl3可做净水剂,其原理是:_______ (用离子反应方程式表示)。

回答下列问题:
(1)仪器 a 的名称是
(2)写出三颈烧瓶中反应的化学方程式
(3)实验开始前需要通入一段时间 N2,其目的是
(4)装置 B、C 盛放的试剂依次是
(5)选择下面合适的试剂
A.浓硫酸 B.CaCl2 C.无水硫酸铜 D.碱石灰
(6)FeCl3可做净水剂,其原理是:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某以硼镁石[主要含MgB3O3(OH)5,还含少量Fe2O3、Al2O3]为原料制Mg(OH)2·4MgCO3·5H2O的工艺流程如下:___________ 。
(2)(NH4)2SO4焙烧分解得到NH3、H2O、SO2和N2四种物质,其中SO2和N2的体积比为___________ 。
(3)B2O3易溶于水,溶于水后生成硼酸H3BO3,硼酸在冷水中溶解度小,溶于水的硼酸可发生电离: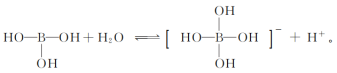 ,硼酸属于
,硼酸属于___________ 元酸。
(4)用氨水调pH的目的是沉淀Fe3+和Al3+,已知实验条件下,部分金属离子开始沉淀的pH和对应氢氧化物的Ksp如下表所示;溶液中金属离子浓度<1×10-5 mol·L-1,可以认为沉淀完全。
Fe3+刚好完全沉淀时溶液的pH为___________ ,调pH除去Fe3+和Al3+需控制的范围是___________ 。
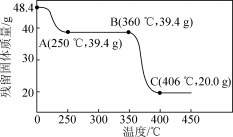
(5)取48.4 g Mg(OH)2·4MgCO3·5H2O加热分解,所得残留固体的质量与温度的关系如图所示。250℃时所得固体的成分为___________ 。
(2)(NH4)2SO4焙烧分解得到NH3、H2O、SO2和N2四种物质,其中SO2和N2的体积比为
(3)B2O3易溶于水,溶于水后生成硼酸H3BO3,硼酸在冷水中溶解度小,溶于水的硼酸可发生电离:
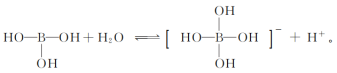 ,硼酸属于
,硼酸属于(4)用氨水调pH的目的是沉淀Fe3+和Al3+,已知实验条件下,部分金属离子开始沉淀的pH和对应氢氧化物的Ksp如下表所示;溶液中金属离子浓度<1×10-5 mol·L-1,可以认为沉淀完全。
| Mg2+ | Al3+ | Fe3+ | |
| 开始沉淀的pH | 8.6 | 3.7 | 2.2 |
| 氢氧化物的Ksp | 1×10-10.7 | 1×10-33 | 1×10-38 |
(5)取48.4 g Mg(OH)2·4MgCO3·5H2O加热分解,所得残留固体的质量与温度的关系如图所示。250℃时所得固体的成分为
您最近半年使用:0次



