室温下: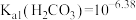 、
、 。Na2CO3和NaHCO3混合溶液具有控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用。室温下,通过下列实验探究一定浓度的Na2CO3和NaHCO3混合溶液的性质。
。Na2CO3和NaHCO3混合溶液具有控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用。室温下,通过下列实验探究一定浓度的Na2CO3和NaHCO3混合溶液的性质。
下列有关说法正确的是
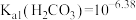 、
、 。Na2CO3和NaHCO3混合溶液具有控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用。室温下,通过下列实验探究一定浓度的Na2CO3和NaHCO3混合溶液的性质。
。Na2CO3和NaHCO3混合溶液具有控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用。室温下,通过下列实验探究一定浓度的Na2CO3和NaHCO3混合溶液的性质。| 实验 | 实验操作和现象 |
| 1 | 用pH计测得混合溶液的pH为10.25 |
| 2 | 向混合溶液中滴几滴酚酞,加水稀释,溶液红色变浅 |
| 3 | 向混合溶液中通入过量的CO2,无明显现象 |
| 4 | 向实验3所得溶液中滴加少量Ba(OH)2溶液,产生白色沉淀 |
A.实验1溶液中存在: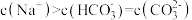 |
B.实验2中随蒸馏水的不断加入,溶液中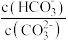 的值逐渐变小 的值逐渐变小 |
C.实验3所得溶液中存在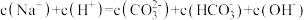 |
D.实验4反应的离子方程式为: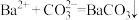 |
2021·江苏·二模 查看更多[9]
江苏省七市(南通、泰州、扬州、徐州、淮安、连云港、宿迁)2021届高三第二次调研检测考试化学试卷江苏省七市(南通、泰州、扬州、徐州、淮安、连云港、宿迁)2021届高三第二次调研考试化学试题江苏省镇江市镇江中学2020-2021学年高二下学期期中考试化学试题江苏省苏州市姑苏区苏州中学2020-2021学年高二下学期期中考试化学试题江苏省镇江中学2020-2021学年高二下学期期末模拟测试化学试题江苏省无锡市普通高中2021-2022学年高二下学期期末考试化学试题江苏省句容高级中学、句容市第三中学等三校2022-2023学年高二10月学情检测调研化学试题(已下线)易错点23 弱电解质的电离平衡-备战2023年高考化学考试易错题(已下线)专题十七选择题的解题策略
更新时间:2021-03-26 15:32:21
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】25℃0.1mol•L-1的BA溶液中各种微粒浓度随pH的变化关系如图所示。下列说法不正确的是


| A.HA的电离常数的数量级为10-5 |
| B.25℃时,BA的溶液pH=7 |
| C.pH由7到14,水解程度A->B+ |
| D.该体系中c(HA)+c(A-)=c(BOH)+c(B+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列溶液中有关物质的量浓度关系正确的是
| A.Na2S溶液中c(OH-)=c(H+)+c(HS-)+2c(H2S) |
B.Na2CO3溶液中:c(Na+)=2c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
| C.室温下,pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合,溶液中离子浓度的大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
D.0.1mol·L-1的NaHC2O4溶液的pH=4,则c(HC2O )>c(H+)>c(H2C2O4)>c(C2O )>c(H+)>c(H2C2O4)>c(C2O ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】25℃时,分别向20.00mL0.1000mol/L氨水、醋酸铵溶液中滴加0.1000mol/L盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是
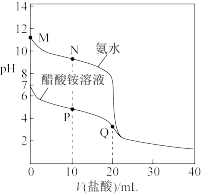

A.M点溶液中:c(OH-)>c(NH )>c(NH3·H2O)>c(H+) )>c(NH3·H2O)>c(H+) |
B.N点溶液中:c(NH3·H2O)>c(Cl-)>c(NH )>c(OH-) )>c(OH-) |
C.P点溶液中:c(NH )<2c(CH3COO-)+c(NH3·H2O) )<2c(CH3COO-)+c(NH3·H2O) |
D.Q点溶液中:2c(Cl-)=c(CH3COOH)+c(NH ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】 时,三种含铁元素的酸或酸根微粒在溶液中有如图所示变化关系,下列说法不正确的是( )
时,三种含铁元素的酸或酸根微粒在溶液中有如图所示变化关系,下列说法不正确的是( )
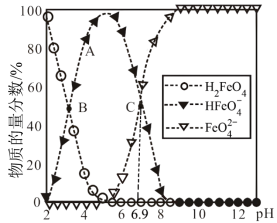
 时,三种含铁元素的酸或酸根微粒在溶液中有如图所示变化关系,下列说法不正确的是( )
时,三种含铁元素的酸或酸根微粒在溶液中有如图所示变化关系,下列说法不正确的是( )
| A.A、B两点对应溶液中水的电离程度:A>B |
B.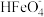 在水中的电离程度大于水解程度 在水中的电离程度大于水解程度 |
C. 的第一步水解平衡常数 的第一步水解平衡常数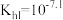 |
| D.C点溶液加适量水稀释,溶液中所有离子浓度均减小 |
您最近一年使用:0次



