在某温度时,将1.0mol・L-1氨水滴入10 mL1.0mol・L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示:
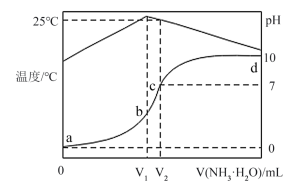
(1)a、b、c、d对应的溶液中水的电离程度由大到小的是_____ 。
(2)氨水体积滴至____ 时(填“V1”或“V2”),氨水与盐酸恰好完全反应,简述判断依据____ ;此时溶液中离子浓度由大到小的顺序是____ 。

(1)a、b、c、d对应的溶液中水的电离程度由大到小的是
(2)氨水体积滴至
2021·上海闵行·二模 查看更多[2]
更新时间:2021-04-15 16:15:25
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】回答下列问题:
(1)结合下表回答,同浓度的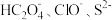 中结合H+能力由强到弱
中结合H+能力由强到弱_______
(2)常温下0.1mol/L的 溶液在加水稀释过程中,下列表达式的数据一定增大的是_______(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定增大的是_______(填字母)。
(3)在新制氯水中加入少量的NaCl固体,水的电离平衡_______ 移动(填“向右”、“向左”、或“不”)。
(4)纯碱溶液清洗油污的原理(用离子方程式表示)_______
(5)室温下,向20.00mL0.10mol/L的CH3COOH溶液中逐滴滴加0.10mol/L的NaOH溶液,溶液的pH随着p 变化关系如图所示。(已知:pc=-lgc lg1.8=0.25)
变化关系如图所示。(已知:pc=-lgc lg1.8=0.25)

① a、b、c三点溶液中水的电离程度从大到小的顺序为_______
② x=_______
(6)在粗制蓝矾中常含有杂质Fe2+,在提纯时,为了除去Fe2+,常加入少量H2O2,使Fe2+氧化为Fe3+,然后调节溶液pH至4,此时的c(Fe3+)=_______ mol/L(已知Fe(OH)3的Ksp为2.8×10-39)。请写出铜元素基态原子价层电子轨道表达式:_______
(7)工业上处理废水时,Na2S、FeS均可用于除去废水中的Hg2+,请用离子方程式解释原因:_______
(1)结合下表回答,同浓度的
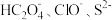 中结合H+能力由强到弱
中结合H+能力由强到弱| 酸 | HClO | H2C2O4 | H2S |
| Ka | 3×10-8 | K1=5.4×10-2 K2=5.4×10-5 | K1=1.3×10-7 K2=7.1×10-15 |
(2)常温下0.1mol/L的
 溶液在加水稀释过程中,下列表达式的数据一定增大的是_______(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定增大的是_______(填字母)。| A.c(H+) | B. | C. | D.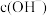 |
(4)纯碱溶液清洗油污的原理(用离子方程式表示)
(5)室温下,向20.00mL0.10mol/L的CH3COOH溶液中逐滴滴加0.10mol/L的NaOH溶液,溶液的pH随着p
 变化关系如图所示。(已知:pc=-lgc lg1.8=0.25)
变化关系如图所示。(已知:pc=-lgc lg1.8=0.25)
① a、b、c三点溶液中水的电离程度从大到小的顺序为
② x=
(6)在粗制蓝矾中常含有杂质Fe2+,在提纯时,为了除去Fe2+,常加入少量H2O2,使Fe2+氧化为Fe3+,然后调节溶液pH至4,此时的c(Fe3+)=
(7)工业上处理废水时,Na2S、FeS均可用于除去废水中的Hg2+,请用离子方程式解释原因:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】室温下向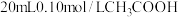 溶液中逐滴加入
溶液中逐滴加入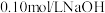 溶液,溶液中由水电离出
溶液,溶液中由水电离出 浓度的负对数与所加
浓度的负对数与所加 溶液体积关系如图所示(忽略溶液混合引起的体积变化):
溶液体积关系如图所示(忽略溶液混合引起的体积变化):

(1) 点溶液:
点溶液:
___________ 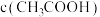 ;
; 点溶液:
点溶液: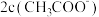
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)书写 点溶液中的物料守恒:
点溶液中的物料守恒:___________ 。
(3) 点溶液显
点溶液显___________ 性, 点显
点显___________ 性。(填“中”酸”或“碱”)
(4) 点醋酸的电离度=
点醋酸的电离度=___________ 。
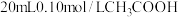 溶液中逐滴加入
溶液中逐滴加入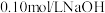 溶液,溶液中由水电离出
溶液,溶液中由水电离出 浓度的负对数与所加
浓度的负对数与所加 溶液体积关系如图所示(忽略溶液混合引起的体积变化):
溶液体积关系如图所示(忽略溶液混合引起的体积变化):
(1)
 点溶液:
点溶液:
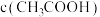 ;
; 点溶液:
点溶液: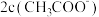
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)书写
 点溶液中的物料守恒:
点溶液中的物料守恒:(3)
 点溶液显
点溶液显 点显
点显(4)
 点醋酸的电离度=
点醋酸的电离度=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向________ (填“正”或“逆”)反应方向移动;水的电离程度将________ (填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12mol2·L-2,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______ 。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____ 。
A.盐酸多B.H2A多C.一样多D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________ 。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________ (填字母)。
a. 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______ 。
(4)0.1mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中c(H2A)________ c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________ (用文字解释)。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向
(2)99℃时,KW=1.0×10-12mol2·L-2,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
A.盐酸多B.H2A多C.一样多D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是
a.
 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是
(4)0.1mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中c(H2A)
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】常温下,向25mL0.1mol·L-1MOH溶液中逐滴加入0.2mol·L-1HA溶液,中和滴定曲线如图所示(体积变化忽略不计)。回答下列问题:

(1)写出MOH在水溶液中的电离方程式:___________ 。
(2)HA的电离平衡常数为___________ mol·L-l(写出计算结果)。
(3)D点时,溶液中c(A-)+c(HA)___________ 2c(M+)(填“>”“<”或“=”);溶液中离子浓度大小顺序为__________ ;若此时测得混合溶液的pH=a,则c(HA)+c(H+)=___________ mol·L-l(用含字母a的计算表达式表示)。

(1)写出MOH在水溶液中的电离方程式:
(2)HA的电离平衡常数为
(3)D点时,溶液中c(A-)+c(HA)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】I.室温时,向100mL 0.1 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:
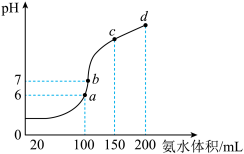
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是______________ ;
(2)在b点,溶液中各离子浓度由大到小的排列顺序是_____________________________ ;
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):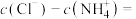
_______________ ;
(4)25℃时,同浓度的下列溶液:①HCl;② ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是_________________ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理镉废水可采用化学沉淀法。
(5)一定温度下, 的
的 ,
, 的
的 ,该温度下
,该温度下______________ [填“ ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。
(6)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到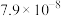 mol/L时,废水中
mol/L时,废水中 的浓度为
的浓度为___________________ mol/L[已知: ,此时
,此时______________ (填“符合”或“不符合”)《生活饮用水卫生标准》。
 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是
(2)在b点,溶液中各离子浓度由大到小的排列顺序是
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):
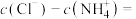
(4)25℃时,同浓度的下列溶液:①HCl;②
 ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理镉废水可采用化学沉淀法。
(5)一定温度下,
 的
的 ,
, 的
的 ,该温度下
,该温度下 ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。(6)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到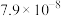 mol/L时,废水中
mol/L时,废水中 的浓度为
的浓度为 ,此时
,此时
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】按要求回答下列问题:
(1)常温下,测得0.1 mol·L-1Na2A溶液的pH=8,则Na2A溶液中各离子的浓度大小关系为______________ 。
(2)将0.2000 mol·L-1HB溶液与0.1000 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)<c(B-)。
①混合溶液中c(B-)________ (填“>”“<”或“=”)c(HB)。
②混合溶液中c(HB)+c(B-)________ (填“>”“<”或“=”)2c(Na+)。
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
①同物质的量浓度的CH3COONa、NaClO、NaCN溶液中阴离子(不含OH-)浓度大小关系为____________ 。
②同pH的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是________ (填字母)。
a HCN b HClO c H2CO3 d CH3COOH
③常温下物质的量浓度相同的醋酸和醋酸钠混合液的pOH=8,则c(CH3COO-)-c(CH3COOH)=____________ (用数值列出计算式即可) mol·L-1。
(1)常温下,测得0.1 mol·L-1Na2A溶液的pH=8,则Na2A溶液中各离子的浓度大小关系为
(2)将0.2000 mol·L-1HB溶液与0.1000 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)<c(B-)。
①混合溶液中c(B-)
②混合溶液中c(HB)+c(B-)
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
| 溶质 | CH3COOH | H2CO3 | HClO | HCN |
| 电离平衡常数Ka | 1.75×10-5 | Ka1=4.4×10-7Ka2=4.7×10-11 | 3.2×10-8 | 6.2×10-10 |
②同pH的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是
a HCN b HClO c H2CO3 d CH3COOH
③常温下物质的量浓度相同的醋酸和醋酸钠混合液的pOH=8,则c(CH3COO-)-c(CH3COOH)=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】亚磷酸(H3PO3)为二元酸,其酸性比磷酸稍强,可用作农药中间体以及有机磷水处理药剂的原料。回答下列问题:
(1)Na2HPO3属于_________ (填“正盐”、“酸式盐”或“无法确定”)。设计一种实验方案, 证明亚磷酸不是强酸:___________ 。
(2)某温度下, H3PO3的电离平衡常数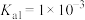 ,
,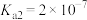 。则NaH2PO3中,
。则NaH2PO3中,
______ 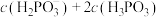 (填“>”、 “<”或“=”)。
(填“>”、 “<”或“=”)。
(1)Na2HPO3属于
(2)某温度下, H3PO3的电离平衡常数
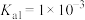 ,
,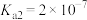 。则NaH2PO3中,
。则NaH2PO3中,
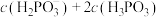 (填“>”、 “<”或“=”)。
(填“>”、 “<”或“=”)。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】工业上可用微生物处理含KCN的废水。第一步是微生物在氧气充足的条件下,将KCN转化成KHCO3和NH3(最佳pH : 6.7~7.2);第二步是把氨转化为硝酸:NH3+202 HNO3+H2O
HNO3+H2O
请完成下列填空:
(1)写出第一步反应的化学反应方程式_____________ ,第二步反应的还原产物是_____________ (填写化学式)。
(2)在KCN中,属于短周期且原子半径最大的元素是_____ ,氮原子最外层电子的运动状态有_______ 种。水的电子式是________ 。
(3)比较碳和氮元素非金属性强弱,化学反应方程式为_____________ 。
(4)室握下,0.lmol/LK2CO3、KCN、KHCO3溶液均呈碱性且pH依次减小,在含等物质的量的KCN、KHCO3混合溶液中,阴离子(除OH-)浓度由大到小的顺序是_____________ 。
(5)工业上还常用氯氧化法处凡含KCN的废水:KCN+2KOH+Cl2=KOCN+2KCl+H2O,2KOCN+4KOH+3Cl2→N2+6KCl+2CO2+2H2O。两扮相比,微生物处理法的优点与缺点是(各写一条)。
优点:________ ;缺点:__________________ 。
 HNO3+H2O
HNO3+H2O请完成下列填空:
(1)写出第一步反应的化学反应方程式
(2)在KCN中,属于短周期且原子半径最大的元素是
(3)比较碳和氮元素非金属性强弱,化学反应方程式为
(4)室握下,0.lmol/LK2CO3、KCN、KHCO3溶液均呈碱性且pH依次减小,在含等物质的量的KCN、KHCO3混合溶液中,阴离子(除OH-)浓度由大到小的顺序是
(5)工业上还常用氯氧化法处凡含KCN的废水:KCN+2KOH+Cl2=KOCN+2KCl+H2O,2KOCN+4KOH+3Cl2→N2+6KCl+2CO2+2H2O。两扮相比,微生物处理法的优点与缺点是(各写一条)。
优点:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】25℃时:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______ (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) _______ c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈_____ ,溶液中c(Na+) _____ c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_______ ,醋酸体积_______ 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)______ 氢氧化钠溶液中c(OH-),m与n的大小关系是m______ n。
(5)相同物质的量浓度的NH4HSO4和(NH4)2SO4溶液,都呈______ 性,前者显酸性的主要原因是______ ;后者显酸性的主要原因是______ 。
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)
(5)相同物质的量浓度的NH4HSO4和(NH4)2SO4溶液,都呈
您最近一年使用:0次



