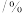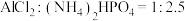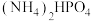处理含硫烟气(主要成分为SO2)备受关注。回答下列问题:
Ⅰ.处理含硫烟气有以下两种方法
(1)水煤气还原法
已知:i.2CO(g)+SO2(g) S(l)+2CO2(g) △H1=—37.0kJ·mol-1
S(l)+2CO2(g) △H1=—37.0kJ·mol-1
ii.2H2(g)+SO2(g) S(l)+2H2O(g) △H2=+45.4kJ·mol-1
S(l)+2H2O(g) △H2=+45.4kJ·mol-1
写出CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式为___ 。
(2)碱液吸收法
①步骤1:用足量氨水吸收SO2,试写出该反应的化学方程式___ 。
②步骤2:再加入熟石灰的反应,试写出该反应离子方程式___ 。
③已知:25℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=__ (用含a、b的代数式表示)。
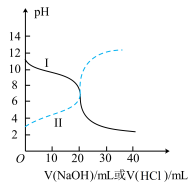
Ⅱ.常温下将NaOH溶液滴加到一定浓度的H2SO3溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
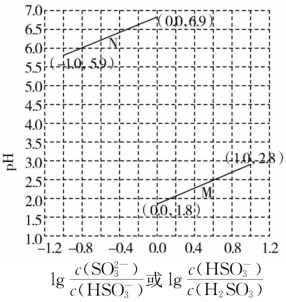
(1)Ka1(H2SO3)=___ 。
(2)当滴加NaOH溶液使混合溶液呈中性时,溶液中各离子浓度大小关系为___ 。
Ⅲ.将组成(物质的量分数)为m%SO2(g)、2m%H2(g)和q%He(g)的气体通入密闭反应器,使反应:H2(g)+ SO2(g)
SO2(g)
 S(l)+H2O(g),在温度t、压强P条件下进行反应,平衡时,若H2转化率为α,则平衡常数Kp=
S(l)+H2O(g),在温度t、压强P条件下进行反应,平衡时,若H2转化率为α,则平衡常数Kp=___ (以分压表示,分压=总压×物质的量分数)。
Ⅰ.处理含硫烟气有以下两种方法
(1)水煤气还原法
已知:i.2CO(g)+SO2(g)
 S(l)+2CO2(g) △H1=—37.0kJ·mol-1
S(l)+2CO2(g) △H1=—37.0kJ·mol-1ii.2H2(g)+SO2(g)
 S(l)+2H2O(g) △H2=+45.4kJ·mol-1
S(l)+2H2O(g) △H2=+45.4kJ·mol-1写出CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式为
(2)碱液吸收法
①步骤1:用足量氨水吸收SO2,试写出该反应的化学方程式
②步骤2:再加入熟石灰的反应,试写出该反应离子方程式
③已知:25℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=
Ⅱ.常温下将NaOH溶液滴加到一定浓度的H2SO3溶液中,混合溶液的pH与离子浓度变化的关系如图所示。

(1)Ka1(H2SO3)=
(2)当滴加NaOH溶液使混合溶液呈中性时,溶液中各离子浓度大小关系为
Ⅲ.将组成(物质的量分数)为m%SO2(g)、2m%H2(g)和q%He(g)的气体通入密闭反应器,使反应:H2(g)+
 SO2(g)
SO2(g)
 S(l)+H2O(g),在温度t、压强P条件下进行反应,平衡时,若H2转化率为α,则平衡常数Kp=
S(l)+H2O(g),在温度t、压强P条件下进行反应,平衡时,若H2转化率为α,则平衡常数Kp=
2021·天津和平·二模 查看更多[3]
天津市和平区2021届高三第二次模拟考试化学试题天津市和平区2020-2021学年高三下学期第二次质量调查(二模)化学试题(已下线)押全国卷理综第28题 化学反应原理-备战2021年高考化学临考题号押题
更新时间:2021-05-03 17:47:28
|
相似题推荐
【推荐1】乙二醇单甲醚 可用作喷气式飞机燃料的防病添加剂,乙二醇二甲醚
可用作喷气式飞机燃料的防病添加剂,乙二醇二甲醚 作为柴油添加剂,能显著降低污染物的排放量。通过乙二醇和甲醇反应制备
作为柴油添加剂,能显著降低污染物的排放量。通过乙二醇和甲醇反应制备 和
和 的热化学方程式为:
的热化学方程式为:
反应Ⅰ.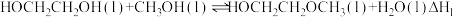
反应Ⅱ.

(1)已知 ,
,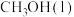 和
和 的燃烧热分别为
的燃烧热分别为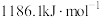 、
、 和
和 ,则
,则 和
和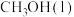 直接合成
直接合成 的热化学方程式为
的热化学方程式为_________________________________________________________ 。
(2)在盛有催化剂的压力为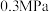 恒压密闭容器中,按物质的量之比为
恒压密闭容器中,按物质的量之比为 充入
充入 和
和 发生反应,在温度为
发生反应,在温度为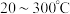 区间内,反应物的平衡转化率及体系气液平衡组成与温度关系分别如图1和图2所示。
区间内,反应物的平衡转化率及体系气液平衡组成与温度关系分别如图1和图2所示。
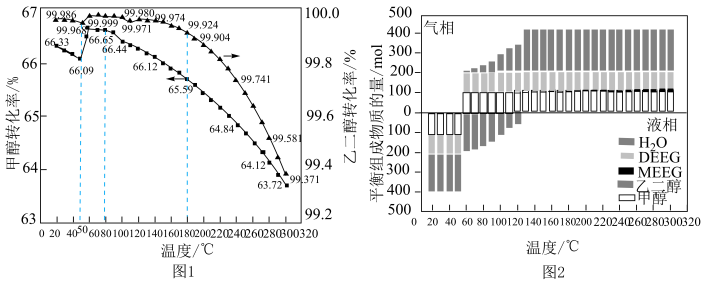
①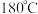 时,反应进行到
时,反应进行到 体系达到平衡状态,则用
体系达到平衡状态,则用 分压表示的反应速率
分压表示的反应速率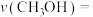
_____________ 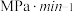 ,该温度下,反应Ⅰ的分压平衡常数
,该温度下,反应Ⅰ的分压平衡常数
_________________ 。(列出表达式即可)
②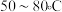 区间,
区间, 和
和 的平衡转化率随温度升高而明显升高的原因为
的平衡转化率随温度升高而明显升高的原因为______________________________________________________________________ 。
③温度高于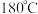 时,随着温度的升高
时,随着温度的升高 和
和 平衡转化率差值逐渐减小的原因为
平衡转化率差值逐渐减小的原因为________________________________________________________________________ 。
(3)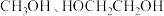 和
和 能够以任意比互溶的原因为
能够以任意比互溶的原因为_______________________________________________________________________ 。
(4)通过实验探究催化剂组成对反应Ⅰ、Ⅱ的影响并探讨反应机理。
①通过实验所得如下表格数据分析,在同一生产周期内,在保证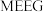 的产量的前提下,为尽可能提高
的产量的前提下,为尽可能提高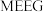 的生产效率,应选择的催化剂质量比为
的生产效率,应选择的催化剂质量比为_____________________ 。
② 和
和 在上述催化剂表面发生反应的机理如图所示,从结构角度解释
在上述催化剂表面发生反应的机理如图所示,从结构角度解释 结合
结合 的原因为
的原因为_______________________________________________ 。
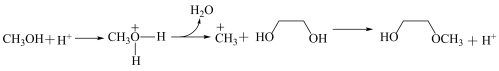
 可用作喷气式飞机燃料的防病添加剂,乙二醇二甲醚
可用作喷气式飞机燃料的防病添加剂,乙二醇二甲醚 作为柴油添加剂,能显著降低污染物的排放量。通过乙二醇和甲醇反应制备
作为柴油添加剂,能显著降低污染物的排放量。通过乙二醇和甲醇反应制备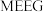 和
和 的热化学方程式为:
的热化学方程式为:反应Ⅰ.
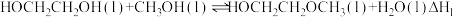
反应Ⅱ.


(1)已知
 ,
,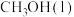 和
和 的燃烧热分别为
的燃烧热分别为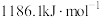 、
、 和
和 ,则
,则 和
和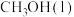 直接合成
直接合成 的热化学方程式为
的热化学方程式为(2)在盛有催化剂的压力为
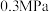 恒压密闭容器中,按物质的量之比为
恒压密闭容器中,按物质的量之比为 充入
充入 和
和 发生反应,在温度为
发生反应,在温度为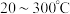 区间内,反应物的平衡转化率及体系气液平衡组成与温度关系分别如图1和图2所示。
区间内,反应物的平衡转化率及体系气液平衡组成与温度关系分别如图1和图2所示。
①
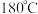 时,反应进行到
时,反应进行到 体系达到平衡状态,则用
体系达到平衡状态,则用 分压表示的反应速率
分压表示的反应速率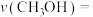
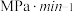 ,该温度下,反应Ⅰ的分压平衡常数
,该温度下,反应Ⅰ的分压平衡常数
②
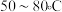 区间,
区间, 和
和 的平衡转化率随温度升高而明显升高的原因为
的平衡转化率随温度升高而明显升高的原因为③温度高于
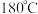 时,随着温度的升高
时,随着温度的升高 和
和 平衡转化率差值逐渐减小的原因为
平衡转化率差值逐渐减小的原因为(3)
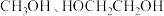 和
和 能够以任意比互溶的原因为
能够以任意比互溶的原因为(4)通过实验探究催化剂组成对反应Ⅰ、Ⅱ的影响并探讨反应机理。
①通过实验所得如下表格数据分析,在同一生产周期内,在保证
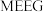 的产量的前提下,为尽可能提高
的产量的前提下,为尽可能提高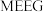 的生产效率,应选择的催化剂质量比为
的生产效率,应选择的催化剂质量比为催化剂质量比 | 乙二醇转化率 | 乙二醇单甲醚选择性 |
纯 | 44 | 55 |
| 30 | 71 |
| 27 | 82 |
| 22 | 87 |
纯 | 10 | 94 |
 和
和 在上述催化剂表面发生反应的机理如图所示,从结构角度解释
在上述催化剂表面发生反应的机理如图所示,从结构角度解释 结合
结合 的原因为
的原因为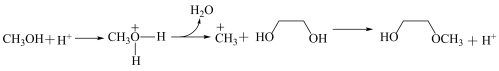
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】开发使用氢燃料、转化和利用 均有利于实现“碳达峰、碳中和”。回答下列问题:
均有利于实现“碳达峰、碳中和”。回答下列问题:
(1)工业上可用煤和水为燃料制氢气。
i.

ii.

iii.

反应 的
的
_______ 。
(2)甲烷水蒸气重整也可以制氢气。
i.
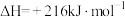
ii.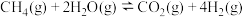

①向密闭容器中加入1.0
 和3.0
和3.0
 ,平衡时吸收热量109.2
,平衡时吸收热量109.2 ,剩余2.0
,剩余2.0
 ,则参加反应的甲烷和水的物质的量之比为
,则参加反应的甲烷和水的物质的量之比为_______ 。
②一定条件下在恒容密闭容器中仅发生反应ii,当起始加入1.8
 和3.6
和3.6
 ,测得
,测得 和某生成物X随时间的变化曲线如图。分析X的化学式是
和某生成物X随时间的变化曲线如图。分析X的化学式是_______ ,0~4min内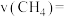
_______ ,6~9min的平均反应速率_______ 0~4min的平均反应速率(填“>”、“<”或“=”)。

(3)在稀硫酸中利用电催化可将 同时转化为多种燃料,其原理如图所示。铜电极上产生
同时转化为多种燃料,其原理如图所示。铜电极上产生 的电极反应式为
的电极反应式为_______ ,若铜电极上只生成3.2g ,则铜极区溶液质量变化了
,则铜极区溶液质量变化了_______ g,若铜极上只生成0.3
 和0.4
和0.4
 ,则通过质子交换膜的
,则通过质子交换膜的 数目为
数目为_______ 。

 均有利于实现“碳达峰、碳中和”。回答下列问题:
均有利于实现“碳达峰、碳中和”。回答下列问题:(1)工业上可用煤和水为燃料制氢气。
i.


ii.


iii.


反应
 的
的
(2)甲烷水蒸气重整也可以制氢气。
i.

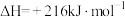
ii.
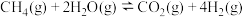

①向密闭容器中加入1.0

 和3.0
和3.0
 ,平衡时吸收热量109.2
,平衡时吸收热量109.2 ,剩余2.0
,剩余2.0
 ,则参加反应的甲烷和水的物质的量之比为
,则参加反应的甲烷和水的物质的量之比为②一定条件下在恒容密闭容器中仅发生反应ii,当起始加入1.8

 和3.6
和3.6
 ,测得
,测得 和某生成物X随时间的变化曲线如图。分析X的化学式是
和某生成物X随时间的变化曲线如图。分析X的化学式是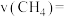

(3)在稀硫酸中利用电催化可将
 同时转化为多种燃料,其原理如图所示。铜电极上产生
同时转化为多种燃料,其原理如图所示。铜电极上产生 的电极反应式为
的电极反应式为 ,则铜极区溶液质量变化了
,则铜极区溶液质量变化了
 和0.4
和0.4
 ,则通过质子交换膜的
,则通过质子交换膜的 数目为
数目为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】氮氧化物是大气污染物之一,可用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)已知①N2(g)+O2(g)=2NO(g) ΔH1=a kJ·mol-1;②C(s)的燃烧热为ΔH2=b kJ·mol-1。反应C(s)+2NO(g) N2(g)+CO2(g)的ΔH =
N2(g)+CO2(g)的ΔH =_________ kJ·mol-1(用含a、b的代数式表示)。
(2)在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表:
结合表中数据,判断该反应的ΔH___ 0(填“>”或“<”),理由是___________ 。
(3)对比研究活性炭、负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、CaO/C、La2O3/C,通入相同浓度的NO,不同温度下测得反应2小时时NO去除率如图所示:
据图分析,温度在500℃以内,三种情况下反应的活化能最小的是______ (填“C” “CaO/C”或“La2O3/C”)。A点______ (填“是”或“不是”)平衡点,原因是__________ 。
(4)某温度下,若向2L体积恒定的密闭容器中充入等物质的量的N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示:
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示:

①图中B点v正___ v逆(填“>” “<”或“=”)。
②第10min时,外界改变的条件可能是________ (填字母)。
A.加催化剂
B.增大C(s)的物质的量
C.减小CO2的物质的量
D.升温
E.降温
③该温度下反应N2(g)+CO2(g) C(s)+2NO(g)的平衡常数K=
C(s)+2NO(g)的平衡常数K=_____ (保留小数点后2位)。
 N2(g)+CO2(g)。
N2(g)+CO2(g)。(1)已知①N2(g)+O2(g)=2NO(g) ΔH1=a kJ·mol-1;②C(s)的燃烧热为ΔH2=b kJ·mol-1。反应C(s)+2NO(g)
 N2(g)+CO2(g)的ΔH =
N2(g)+CO2(g)的ΔH =(2)在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表:
| 实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
| 1 | 700 | 0.24 | 0.08 |
| 2 | 800 | 0.40 | 0.09 |
(3)对比研究活性炭、负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、CaO/C、La2O3/C,通入相同浓度的NO,不同温度下测得反应2小时时NO去除率如图所示:

据图分析,温度在500℃以内,三种情况下反应的活化能最小的是
(4)某温度下,若向2L体积恒定的密闭容器中充入等物质的量的N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示:
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示:
①图中B点v正
②第10min时,外界改变的条件可能是
A.加催化剂
B.增大C(s)的物质的量
C.减小CO2的物质的量
D.升温
E.降温
③该温度下反应N2(g)+CO2(g)
 C(s)+2NO(g)的平衡常数K=
C(s)+2NO(g)的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】氨气是一种无色、有刺激性气味的气体,广泛应用于多个领域。氨气可由氨基甲酸铵(H2NCOONH4)分解制得。
已知:Ⅰ.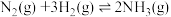

Ⅱ.

Ⅲ.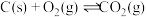
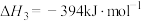
Ⅳ.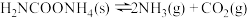 ΔH4
ΔH4
(1)
______ ,该反应在______ (填“高温”、“低温”或“任意温度”)条件下能够自发进行;
(2)某温度下在一恒容密闭容器中加入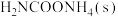 ,假设只发生反应Ⅳ,能判断已达化学平衡状态的是
,假设只发生反应Ⅳ,能判断已达化学平衡状态的是______ (填序号);
a.容器内混合气体的密度不变
b.CO2体积分数不再发生变化
c.升高体系温度,则正、逆反应速率均增大
d.混合气体的平均摩尔质量保持不变
e.
(3)在一定温度和催化剂的条件下,将1mol NH3通入2L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用H2的压强变化表示 时间内的反应速率
时间内的反应速率
______  (用含
(用含 的代数式表示);
的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是______ (用图中a、b、c、d表示),理由是______ ;
③在该温度下,反应Ⅰ的标准平衡常数
______ 。(已知:分压=总压×该组分物质的量分数,对于反应 ,
,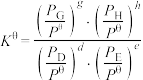 ,其中
,其中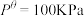 ,
,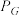 、
、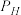 、
、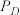 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
已知:Ⅰ.
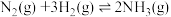

Ⅱ.


Ⅲ.
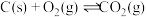
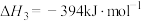
Ⅳ.
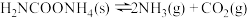 ΔH4
ΔH4(1)

(2)某温度下在一恒容密闭容器中加入
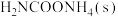 ,假设只发生反应Ⅳ,能判断已达化学平衡状态的是
,假设只发生反应Ⅳ,能判断已达化学平衡状态的是a.容器内混合气体的密度不变
b.CO2体积分数不再发生变化
c.升高体系温度,则正、逆反应速率均增大
d.混合气体的平均摩尔质量保持不变
e.

(3)在一定温度和催化剂的条件下,将1mol NH3通入2L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用H2的压强变化表示
 时间内的反应速率
时间内的反应速率
 (用含
(用含 的代数式表示);
的代数式表示);②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
③在该温度下,反应Ⅰ的标准平衡常数

 ,
,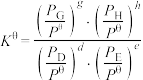 ,其中
,其中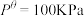 ,
,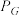 、
、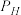 、
、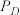 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ.“十四五”规划明确了“碳达峰、碳中和”工作的定位。某科研机构想利用CO2和H2合成燃料。已知:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2
③C(s)+2H2(g) CH4(g) ΔH3
CH4(g) ΔH3
④2CO(g) C(s)+CO2(g) ΔH4
C(s)+CO2(g) ΔH4
(1)试写出CO2与H2反应生成CH4和H2O(g)的热化学方程式为_______ 。
Ⅱ.CO2可用来生产燃料甲醇。CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= - 49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得
CH3OH(g)+H2O(g) ΔH2= - 49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得 的浓度随时间的变化如表所示:
的浓度随时间的变化如表所示:
(2)H2的平衡转化率=_______ 。该条件下上述反应的平衡常数K=_______ 。
(3)下列措施中能使平衡体系中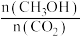 增大且不减慢化学反应速率的是_______。
增大且不减慢化学反应速率的是_______。
(4)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1_______ c2(填“>”、“<”或“=”)。
(5)要提高CO2的转化率,可以采取的措施是_______(填序号)。
(6)T℃时,向恒容密闭容器中充入CO2和H2,发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H。在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如下图所示。
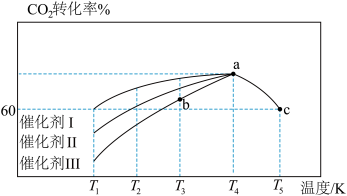
则催化效果最佳的是催化剂_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。如果a点已经达到平衡状态,则b点的v正_______ v逆(填“>”、“<”或“=”),c点转化率比a点低的原因是_______ 。
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1②CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2③C(s)+2H2(g)
 CH4(g) ΔH3
CH4(g) ΔH3④2CO(g)
 C(s)+CO2(g) ΔH4
C(s)+CO2(g) ΔH4(1)试写出CO2与H2反应生成CH4和H2O(g)的热化学方程式为
Ⅱ.CO2可用来生产燃料甲醇。CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2= - 49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得
CH3OH(g)+H2O(g) ΔH2= - 49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得 的浓度随时间的变化如表所示:
的浓度随时间的变化如表所示:| 时间/min | 0 | 3 | 5 | 10 | 15 |
| 浓度/mol/L | 0 | 0.3 | 0.45 | 0.5 | 0.5 |
(3)下列措施中能使平衡体系中
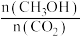 增大且不减慢化学反应速率的是_______。
增大且不减慢化学反应速率的是_______。| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.再充入1molH2 | D.将H2O(g)从体系中分离出去 |
(5)要提高CO2的转化率,可以采取的措施是_______(填序号)。
| A.加入催化剂 | B.增大CO2的浓度 | C.通入惰性气体 | D.通入H2 |

则催化效果最佳的是催化剂
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】工业上利用脱硫后的天然气合成氨的某流程如下:
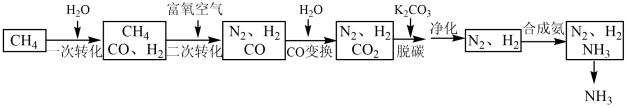
(1)“一次转化”中H2O(g)过量的目的是______ 。
(2)已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ•mol-1
“二次转化”时CH4和O2反应生成CO和H2的热化学方程式为______ 。
(3)“CO变换”的反应是CO(g)+H2O(g)⇌CO2(g)+H2(g)某温度下,该反应的平衡常数K=1,若要使CO的转化率达到90%,则起始时c(H2O):c(CO)应不低于______ 。
(4)“脱碳”后的溶液再生的方法是______ (以化学方程式表示)。
(5)“净化”时发生的反应为 [Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)⇌[Cu(NH3)3•CO]Ac(aq),△H<0。充分吸收CO采取的措施是______ (选填序号)。
a 升温 b 降温 c 加压 d 减压
(6)已知N2(g)+3H2(g)⇌2NH3(g)△H<0,平衡时NH3的物质的量分数c(NH3)与氢氮比x(H2与N2的物质的量比)的关系如图:
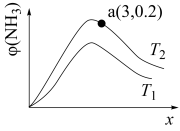
①T1______ T2(填“>”、“=”或“<”)。
②a点总压为50Mpa,T2时Kp=______ (Mpa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③实验测得一定条件下合成氨反应的速率方程为v=kc(N2)c1.5(H2)c-1(NH3)。以下措施既能加快反应速率,又能提高H2平衡转化率的是______
a 加压 b 使用催化剂 c 增大氢氮比 d 分离NH3

(1)“一次转化”中H2O(g)过量的目的是
(2)已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ•mol-1
“二次转化”时CH4和O2反应生成CO和H2的热化学方程式为
(3)“CO变换”的反应是CO(g)+H2O(g)⇌CO2(g)+H2(g)某温度下,该反应的平衡常数K=1,若要使CO的转化率达到90%,则起始时c(H2O):c(CO)应不低于
(4)“脱碳”后的溶液再生的方法是
(5)“净化”时发生的反应为 [Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)⇌[Cu(NH3)3•CO]Ac(aq),△H<0。充分吸收CO采取的措施是
a 升温 b 降温 c 加压 d 减压
(6)已知N2(g)+3H2(g)⇌2NH3(g)△H<0,平衡时NH3的物质的量分数c(NH3)与氢氮比x(H2与N2的物质的量比)的关系如图:

①T1
②a点总压为50Mpa,T2时Kp=
③实验测得一定条件下合成氨反应的速率方程为v=kc(N2)c1.5(H2)c-1(NH3)。以下措施既能加快反应速率,又能提高H2平衡转化率的是
a 加压 b 使用催化剂 c 增大氢氮比 d 分离NH3
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】Ⅰ.二甲醚又称甲醚,简称DME,结构简式为 ,是一种无色气体,被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,在医药、燃料、农药工业中有许多独特的用途。
,是一种无色气体,被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,在医药、燃料、农药工业中有许多独特的用途。
(1)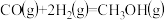
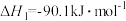

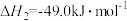

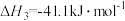

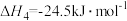
由H2和CO直接制备二甲酵(另一产物为水蒸气)的热化学方程式为___________
(2)T℃时,在2L密闭容器中充入4molCO和8molH2发生制备二甲醚的反应: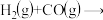
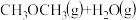 (没有配平),测得环的物质的量随时间的变化情况如图中状态Ⅰ所示。
(没有配平),测得环的物质的量随时间的变化情况如图中状态Ⅰ所示。
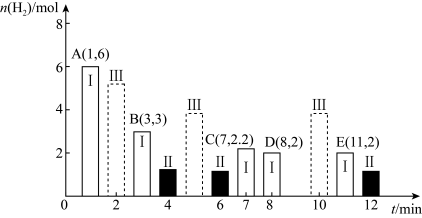
①T℃时,反应的平衡常数K1=___________ 。
②若仅改变某一条件,测得B的物质的最随时间的变化情况如图中状态Ⅱ所示,则K1___________ K2(填“>”、“<”或“=”)。
③若仅改变某一条件,测得B的物质的量随时间的变化情况如图中状态Ⅲ所示,则改变的条件可能是___________ 。
(3)燃料电池是一种绿色环保、高效的化学电源。二甲醚还可作燃料电池的燃料,以熔融 作为电解质,一极充入二甲醚,另一极充入空气和
作为电解质,一极充入二甲醚,另一极充入空气和 气体,该电池的负极反应式为
气体,该电池的负极反应式为___________ 。用该二甲醚燃料电池电解300mL饱和食盐水。电解一段时间后,当溶液的pH值为13(室温下测定)时,消耗二甲醛的质量为___________ g.(忽略溶液体积变化,不考虑损耗)
Ⅱ.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)25℃时,0.1mol/L的 溶液呈
溶液呈___________ (填“酸性”、“碱性”或“中性”)
(2)用足量 溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为
溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为___________ 。
(3)25℃时,取浓度均为0.1000mol/L的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol/LNaOH溶液、0.1000mol/L盐酸进行中和滴定,滴定过程中溶液pH随滴加溶液的体积变化关系如图所示。下列说法错误的是_____________
a.曲线Ⅰ,滴加溶液到10mL时: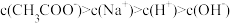
b.当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交
c.曲线Ⅱ:滴加溶液到10.00mL时,溶液中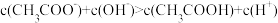
d.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
 ,是一种无色气体,被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,在医药、燃料、农药工业中有许多独特的用途。
,是一种无色气体,被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,在医药、燃料、农药工业中有许多独特的用途。(1)
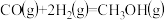
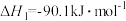

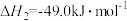

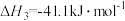

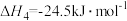
由H2和CO直接制备二甲酵(另一产物为水蒸气)的热化学方程式为
(2)T℃时,在2L密闭容器中充入4molCO和8molH2发生制备二甲醚的反应:
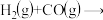
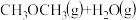 (没有配平),测得环的物质的量随时间的变化情况如图中状态Ⅰ所示。
(没有配平),测得环的物质的量随时间的变化情况如图中状态Ⅰ所示。
①T℃时,反应的平衡常数K1=
②若仅改变某一条件,测得B的物质的最随时间的变化情况如图中状态Ⅱ所示,则K1
③若仅改变某一条件,测得B的物质的量随时间的变化情况如图中状态Ⅲ所示,则改变的条件可能是
(3)燃料电池是一种绿色环保、高效的化学电源。二甲醚还可作燃料电池的燃料,以熔融
 作为电解质,一极充入二甲醚,另一极充入空气和
作为电解质,一极充入二甲醚,另一极充入空气和 气体,该电池的负极反应式为
气体,该电池的负极反应式为Ⅱ.25℃时,部分物质的电离平衡常数如表所示:
| 化学式 |  |  |  |  |  |
| 电离平衡常数 |  |  |   |   |   |
(1)25℃时,0.1mol/L的
 溶液呈
溶液呈(2)用足量
 溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为
溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为(3)25℃时,取浓度均为0.1000mol/L的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol/LNaOH溶液、0.1000mol/L盐酸进行中和滴定,滴定过程中溶液pH随滴加溶液的体积变化关系如图所示。下列说法错误的是

a.曲线Ⅰ,滴加溶液到10mL时:
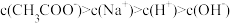
b.当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交
c.曲线Ⅱ:滴加溶液到10.00mL时,溶液中
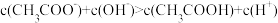
d.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】利用 可消除CO污染或定量测定CO,反应为:
可消除CO污染或定量测定CO,反应为:
完成下列填空:
(1)该反应的平衡常数表达式
___________ 。在2L恒容密闭容器中反应25min后,固体质量减少了6.4g,则0~25min  的平均反应速率为
的平均反应速率为___________ 。
(2)取一定量的 和CO于某密闭容器中,分别在80
和CO于某密闭容器中,分别在80 和100
和100 下进行实验,测得
下进行实验,测得 如下:
如下:
上表中
___________ ,理由是___________ 。根据上表数据可以得出的结论是___________ 。
(3)如图所示,300 时
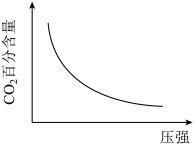
时 的百分含量随着压强的增大而减小,请解释其原因
的百分含量随着压强的增大而减小,请解释其原因___________ 。
(4) 可用高浓度NaOH溶液吸收。
可用高浓度NaOH溶液吸收。
①若4.48L (标准状况)和0.35mol NaOH溶液完全反应,生成的碳酸钠和碳酸氢钠的物质的量之比为
(标准状况)和0.35mol NaOH溶液完全反应,生成的碳酸钠和碳酸氢钠的物质的量之比为___________ 。
②继续通入二氧化碳至溶液中碳酸钠和碳酸氢钠(碳酸氢钠溶液呈碱性)的物质的量之比1∶1,则溶液中各离子浓度大小顺序为___________ 。
③若使碳酸氢钠溶液中 的比值变小,可加入的物质是
的比值变小,可加入的物质是___________ 。
a.通入HCl b.NaOH固体 c.通入 d.
d. 固体
固体
 可消除CO污染或定量测定CO,反应为:
可消除CO污染或定量测定CO,反应为:
完成下列填空:
(1)该反应的平衡常数表达式

 的平均反应速率为
的平均反应速率为(2)取一定量的
 和CO于某密闭容器中,分别在80
和CO于某密闭容器中,分别在80 和100
和100 下进行实验,测得
下进行实验,测得 如下:
如下:| 时间/min 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
80 | 0.50 | 0.37 | 0.26 | 0.18 | 0.12 | 0.12 |
100 | 0.50 | 0.35 | 0.24 | 0.17 | x | 0.15 |
上表中

(3)如图所示,300
 时
时 的百分含量随着压强的增大而减小,请解释其原因
的百分含量随着压强的增大而减小,请解释其原因
(4)
 可用高浓度NaOH溶液吸收。
可用高浓度NaOH溶液吸收。①若4.48L
 (标准状况)和0.35mol NaOH溶液完全反应,生成的碳酸钠和碳酸氢钠的物质的量之比为
(标准状况)和0.35mol NaOH溶液完全反应,生成的碳酸钠和碳酸氢钠的物质的量之比为②继续通入二氧化碳至溶液中碳酸钠和碳酸氢钠(碳酸氢钠溶液呈碱性)的物质的量之比1∶1,则溶液中各离子浓度大小顺序为
③若使碳酸氢钠溶液中
 的比值变小,可加入的物质是
的比值变小,可加入的物质是a.通入HCl b.NaOH固体 c.通入
 d.
d. 固体
固体
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】火力发电厂释放出大量氮的氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理。可实现绿色环保、低碳减排、废物利用等目的。
(1)已知:N2(g) +O2(g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2(g)=CO2(g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为: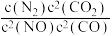 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_________ 。
(2)脱硝
利用甲烷与NO2反应,生成无污染的物质,则该反应的化学方程式为:___________ 。
(3)脱碳
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图1),则上述CO2转化为甲醇反应的△H3_____ 0(填“>”、“<”或“=”)。
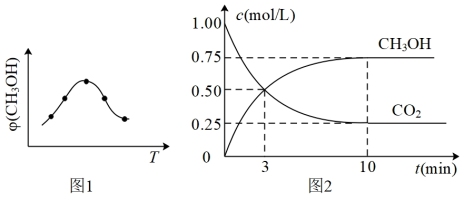
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示,请回答:第10min后,若升温,该反应的平衡常数将_____ (填“变大”、“变小”、“不变”);若向该容器中再充入1molCO2和3molH2再次达到平衡时,则CH3OH(g)的体积分数将___ (“变大”、“变小”、“不变”)。
(4)脱硫
某种脱硫工艺中将废气经处理后,与一定量的氨气、潮湿的空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥,设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为__________ 。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由大到小的顺序为______________ 。
(1)已知:N2(g) +O2(g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2(g)=CO2(g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为:
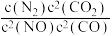 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)脱硝
利用甲烷与NO2反应,生成无污染的物质,则该反应的化学方程式为:
(3)脱碳
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图1),则上述CO2转化为甲醇反应的△H3

②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示,请回答:第10min后,若升温,该反应的平衡常数将
(4)脱硫
某种脱硫工艺中将废气经处理后,与一定量的氨气、潮湿的空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥,设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为
您最近一年使用:0次