常温下,向1L0.1mol·L-1—酸HR溶液中缓慢通氨气[已知常温下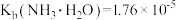 ],假设溶液温度和体积保持不变,混合溶液的pH与
],假设溶液温度和体积保持不变,混合溶液的pH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
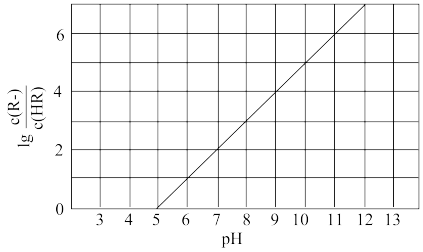
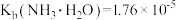 ],假设溶液温度和体积保持不变,混合溶液的pH与
],假设溶液温度和体积保持不变,混合溶液的pH与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
A. 的HR溶液的pH约为3 的HR溶液的pH约为3 |
B.HR为弱酸,常温时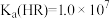 |
C.当通入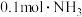 时,溶液中 时,溶液中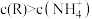 |
D.当溶液呈中性时,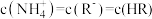 |
2021·广东·模拟预测 查看更多[1]
更新时间:2021-05-27 15:48:53
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH的关系图如下所示,下列说法正确的是
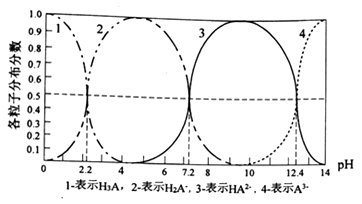

| A.NaH2A水溶液呈碱性 |
| B.H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+1/2c(HA2-)+1/3c(A3-) |
| C.向H3A溶液中加入一定量的NaOH溶液至pH=5时,c(HA2-)/c(H3A)=100.6 |
D.向H3A溶液中加入氨水使pH从5→9发生的主要离子反应是:H2A-+OH- HA2-+H2O HA2-+H2O |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】工业上可利用氨水吸收SO2和NO2,原理如下图所示。已知:25℃时,NH3·H2O的Kb=l.7×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,下列说法正确的是


A.向氨水中通入SO2恰好生成NH4HSO3:c(OH-)+c(NH3·H2O)=c(H+)+c(H2SO3)+c( ) ) |
B.向氨水中通入SO2至pH=7:c( )>c(NH )>c(NH )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
C.反应NH3·H2O+H2SO3=NH + + +H2O平衡常数K=2.21×107 +H2O平衡常数K=2.21×107 |
D.NO2被NH4HSO3吸收的离子方程式:2NO2+4 =N2+4 =N2+4 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温下将NaOH溶液滴加到亚硒酸( H2SeO3)溶液中 ,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
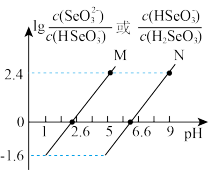

A.曲线M表示pH与lg |
| B.Ka2(H2SeO3)的数量级为10-7 |
C.混合溶液中 =104 =104 |
D.NaHSeO3溶液中c( H2SeO3)>c( ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】25℃时,向某二元弱酸H2X的溶液中滴加NaOH溶液,混合溶液中lg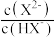 或lg
或lg 与pH的关系如图所示。下列叙述不正确的是
与pH的关系如图所示。下列叙述不正确的是

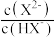 或lg
或lg 与pH的关系如图所示。下列叙述不正确的是
与pH的关系如图所示。下列叙述不正确的是
| A.Ka2(H2X)的数量级为10-11 | B.n曲线表示lg 与pH的变化关系 与pH的变化关系 |
| C.25℃时,NaHX溶液中c(X2-)<c(H2X) | D.pH=8时,c(X2-)>c(H2X) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
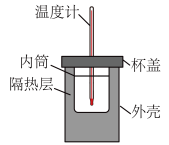
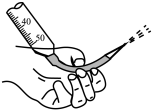
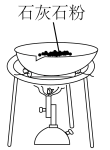
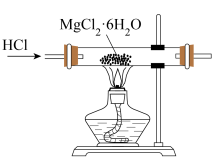
【推荐1】用下列实验装置进行相应实验,其中装置正确且能达到实验目的的是
|
|
| A.测定中和反应的反应热 | B.为装有 溶液的滴定管排气泡 溶液的滴定管排气泡 |
|
|
| C.煅烧石灰石 | D.制取无水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,下列各组离子在指定的条件下可能大量共存的是
A.c(OH-)/c(H+)=1012的溶液中: 、Al3+、 、Al3+、 、 、 |
B.有Fe3+存在的溶液中: 、 、 、 、 、Cl- 、Cl- |
C.pH=0的溶液中:Fe2+、Mg2+、 、 、 |
D.由水电离出的c(H+)=1×10-13mol/L的溶液:Al3+、K+、 、Cl﹣ 、Cl﹣ |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温下,将NaOH溶液滴加到等物质的量浓度的HX、HY两种酸溶液中,混合溶液的pH与离子浓度的关系如图所示。下列说法错误的是
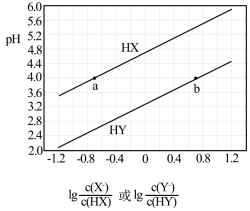

| A.HX的酸性比HY弱 |
| B.Ka(HY)的数量级为10-3 |
| C.b点溶液中c(Y-)一定大于a点溶液中c(X-) |
| D.a、b两点溶液中c(Na+)的差值为c(X-)-c(Y-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】联氨 是二元弱碱,联氨溶液中存在:
是二元弱碱,联氨溶液中存在:

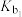
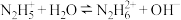
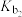
25℃时,溶液中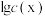 与pH的关系如图所示(x表示含氮微粒,已知
与pH的关系如图所示(x表示含氮微粒,已知 )。
)。
下列说法错误的是

 是二元弱碱,联氨溶液中存在:
是二元弱碱,联氨溶液中存在:
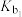
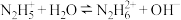
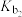
25℃时,溶液中
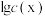 与pH的关系如图所示(x表示含氮微粒,已知
与pH的关系如图所示(x表示含氮微粒,已知 )。
)。下列说法错误的是

A. 表示 表示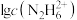 与pH的关系 与pH的关系 | B.联氨与硫酸形成酸式盐的化学式为 |
C.0.05mol/L的 水溶液的 水溶液的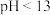 | D.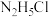 溶液中, 溶液中,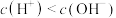 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】20℃时,在c(H2A)+c(HA-)+c(A2-)=0.100mol•L-1的H2A、NaOH混合溶液中,溶液中部分微粒的物质的量分数δ随溶液pH变化的关系如图所示。下列说法不正确 的是


| A.该温度下HA-的电离常数K=10-4.2 |
| B.pH=7的溶液中:c(Na+)>2c(A2-) |
| C.c(HA-)=c(A2-)的溶液中:c(Na+)<0.100mol•L-1+c(HA-) |
| D.c(Na+)=0.100mol•L-1的溶液中:c(H+)+c(H2A)=c(OH-)+2c(A2-) |
您最近一年使用:0次


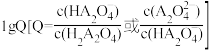 随溶液pH的变化关系如图所示,下列说法正确的是
随溶液pH的变化关系如图所示,下列说法正确的是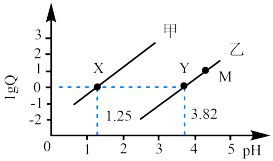
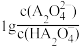 随溶液pH的变化关系
随溶液pH的变化关系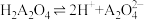 的平衡常数K=10-5.07
的平衡常数K=10-5.07 )>c(OH-)>c(HA2O
)>c(OH-)>c(HA2O )
)

 )+2c(OH-)=c(
)+2c(OH-)=c(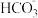 )+2c(H+)+3c(H2CO3)
)+2c(H+)+3c(H2CO3)

