随着低碳钢等洁净钢技术的发展,Al2O3-C耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
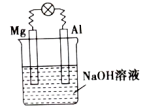
(1)将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示。写出铝电极的电极反应式:_____ 。
(2)在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①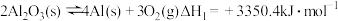
②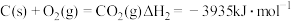
③
④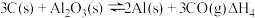 则
则
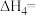
______  。
。
(3)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤
⑥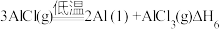
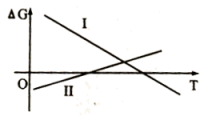
反应⑤、反应⑥中自由能(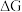 )与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
)与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线____ (填“I”或“II”),试分析氧化铝碳热还原氯化法炼铝的可行性:______
(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑: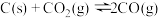 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
①650℃反应达到平衡时,容器体积为10L,则平衡时c(CO)=___________ 。
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=3:2的混合气体,则平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。
③800℃时,如图CO的体积分数为92%,用平衡分压代替平衡浓度表示的化学平衡常数Kp=___________ [用含p总的代数式表示,气体分压(p分)=气体总压(p总) 体积分数]。
体积分数]。
(1)将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示。写出铝电极的电极反应式:

(2)在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①
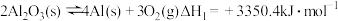
②
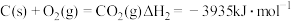
③

④
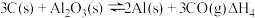 则
则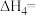
 。
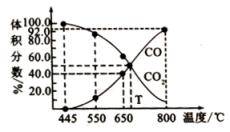
。(3)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤

⑥
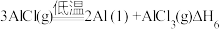
反应⑤、反应⑥中自由能(
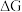 )与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
)与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:
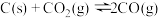 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
①650℃反应达到平衡时,容器体积为10L,则平衡时c(CO)=
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=3:2的混合气体,则平衡
③800℃时,如图CO的体积分数为92%,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
 体积分数]。
体积分数]。
更新时间:2021-07-21 20:52:05
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
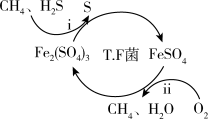
(1)过程i中H2S发生了________ (选填“氧化”或“还原”)反应。
(2)过程ⅱ的离子方程式是____________ 。
(3)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
请结合以上信息,判断工业脱硫应选择的最佳pH范围____________ 。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
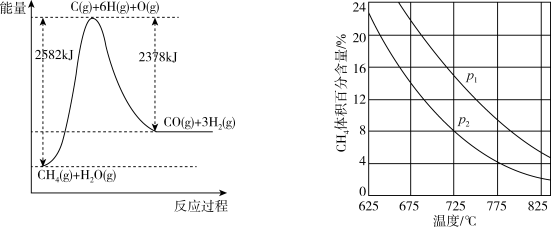
(4)①该过程的热化学方程式是__________________ 。
②比较压强p1和p2的大小关系:p1__ p2(选填“>”“<”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程示意图如下。
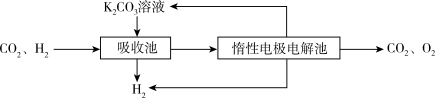
(5)①吸收池中发生反应的离子方程式是___________________ 。
②用化学语言解释K2CO3溶液的再生的原理:_____________________ 。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。

(1)过程i中H2S发生了
(2)过程ⅱ的离子方程式是
(3)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
Fe2+氧化速率/(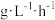 ) ) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
请结合以上信息,判断工业脱硫应选择的最佳pH范围
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。

(4)①该过程的热化学方程式是
②比较压强p1和p2的大小关系:p1
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程示意图如下。

(5)①吸收池中发生反应的离子方程式是
②用化学语言解释K2CO3溶液的再生的原理:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族。请回答下列问题。
(1)W的原子结构示意图为_________ 。能说明Z的非金属性比X的非金属性强的事实是_______________ (举一例)。
(2)W、Y和氢3种元素所形成的一种化合物,其75%(体积分数)的溶液常用于医疗消毒,该化合物的结构简式为__________ 。用化学方程式表示该化合物在中学实验室的一种用途____________ 。
(3)电解NaZ水溶液时,阴极的电极反应式为___________ 。工业上,以上述反应的阳极产物和Ca(OH)2为原料,制备漂白粉反应的化学方程式为_____________ 。
(4)已知:298K时,金属钠与Y2气体反应,生成1 mol Na2Y固体时,放出热量414 kJ;生成1 mol Na2Y2固体时,放出热量511 kJ。由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为_________ 。
| W | Y | ||
| X | Z |
(2)W、Y和氢3种元素所形成的一种化合物,其75%(体积分数)的溶液常用于医疗消毒,该化合物的结构简式为
(3)电解NaZ水溶液时,阴极的电极反应式为
(4)已知:298K时,金属钠与Y2气体反应,生成1 mol Na2Y固体时,放出热量414 kJ;生成1 mol Na2Y2固体时,放出热量511 kJ。由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】汽车尾气主要含有CO2 、CO、SO2、NOx 等物质,尾气中CO、氢氧化物(NOx) 严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深入的研究。
(1)利用甲烷还原NOx
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mo l;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+H2O(g) △H2=-1160kJ/mo l,
甲烷直接将NO2还原为N2的热化学方程式为________________________________ 。
(2)将不同量的CO(g)积H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2) 表示的反应速率为_________ (保留两位有效数字,下同)。
②该反应为________ (填“吸热”或“放热”) 反应,实验2条件下的平衡常数K=________ 。
③若达平衡状态时,实验2 与实验3中各物质的质量分数分别相等,且t<4min,则a、b应满足的关系是_________________________ (用含a、b的数学式表示)。
(3)CO分析仪的传感器可测定汽车尾气是否符合排放标准。该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3) 和氧化锆(ZrO2) 晶体,能传导O2-,则负极的电极反应式为____________ 。
(4)SO2可用钙基固硫反应除去,反应生成的CaSO4是一种微溶物质,其Ksp=9.0×10-6。若将浓度为2×10-3mol/L的Na2SO4溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为_____________ 。
(1)利用甲烷还原NOx
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mo l;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+H2O(g) △H2=-1160kJ/mo l,
甲烷直接将NO2还原为N2的热化学方程式为
(2)将不同量的CO(g)积H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 4 |
| 3 | 900 | a | b | c | d | t |
②该反应为
③若达平衡状态时,实验2 与实验3中各物质的质量分数分别相等,且t<4min,则a、b应满足的关系是
(3)CO分析仪的传感器可测定汽车尾气是否符合排放标准。该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3) 和氧化锆(ZrO2) 晶体,能传导O2-,则负极的电极反应式为
(4)SO2可用钙基固硫反应除去,反应生成的CaSO4是一种微溶物质,其Ksp=9.0×10-6。若将浓度为2×10-3mol/L的Na2SO4溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g) +4H2(g) ΔH=akJ/mol
CO(g) +2H2(g)=CH3OH(g) ΔH=bkJ/mol
试写出由CH4和O2制取甲醇蒸气的热化学方程式:____ 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=
CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=_______ 。

(3)在一容积可变的密闭容器中充入1 molCO和2mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是____ 。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___ PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为2L。如果反应开始时仍充入1molCO和2molH2,则在平衡状态B时容器的体积V(B)=___ L。
(1)已知2CH4(g)+O2(g)=2CO(g) +4H2(g) ΔH=akJ/mol
CO(g) +2H2(g)=CH3OH(g) ΔH=bkJ/mol
试写出由CH4和O2制取甲醇蒸气的热化学方程式:
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=
CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=
(3)在一容积可变的密闭容器中充入1 molCO和2mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时,容器的体积为2L。如果反应开始时仍充入1molCO和2molH2,则在平衡状态B时容器的体积V(B)=
您最近一年使用:0次
【推荐2】近年来,原有的催化裂化和石脑油裂解制丙烯工艺萎缩,由丙烷脱氢制丙烯成为研究热点。丙烷脱氢制丙烯的主要反应为C3H8(g) C3H6(g)+H2(g) △H。
C3H6(g)+H2(g) △H。
回答下列问题:
(1)已知:C—H键能为412kJ·mol-1,C—C键能为348kJ·mol-1,C=C键能为612kJ·mol-1,H—H键能为436kJ·mol-1,则△H=____ ;上述反应在_____ (填“低温”“高温”或“任意温度”)下自发进行。
(2)图1为丙烷脱氢在Pt/Cu(111)SAA、Pt3Cu(111)和Pt(111)催化剂表面的能量曲线(TS表示过渡态,吸附在催化剂表面的物种用*标注)。
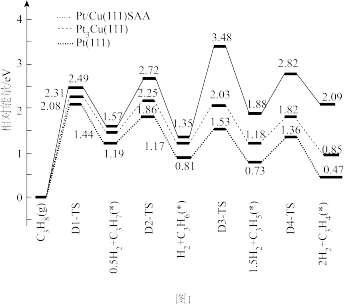
①相同条件下,选择____ (填催化剂)脱氢速率最快。
②由图1可知,丙烯会继续脱氢生成丙炔等副产物,其中选择Pt/Cu(111)SAA比选择其他催化剂所得副产物偏少,原因为____ 。
(3)一定条件下,针对丙烷脱氢制丙烯的反应,压强分别为p1、p2(p1>p2)时,体系中丙烷和丙烯的平衡体积分数与温度的关系如图2所示。
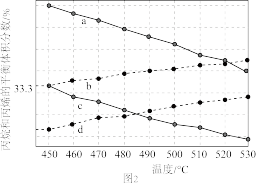
表示p2对应的丙烯平衡体积分数的曲线为____ (填“a”“b”“c”或“d”),该压强下,450℃时,丙烷脱氢主反应对应的平衡常数Kp=____ (Kp为以分压表示的平衡常数,分压=总压×体积分数。用含p1或p2的代数式表示)。
(4)丙烷还可通过CO2氧化脱氢制丙烯,反应为C3H8(g)+CO2(g) C3H6(g)+H2O(g)+CO(g) △H<0,与催化剂直接脱氢相比,该法的优点为
C3H6(g)+H2O(g)+CO(g) △H<0,与催化剂直接脱氢相比,该法的优点为____ (任答一条)。
 C3H6(g)+H2(g) △H。
C3H6(g)+H2(g) △H。回答下列问题:
(1)已知:C—H键能为412kJ·mol-1,C—C键能为348kJ·mol-1,C=C键能为612kJ·mol-1,H—H键能为436kJ·mol-1,则△H=
(2)图1为丙烷脱氢在Pt/Cu(111)SAA、Pt3Cu(111)和Pt(111)催化剂表面的能量曲线(TS表示过渡态,吸附在催化剂表面的物种用*标注)。

①相同条件下,选择
②由图1可知,丙烯会继续脱氢生成丙炔等副产物,其中选择Pt/Cu(111)SAA比选择其他催化剂所得副产物偏少,原因为
(3)一定条件下,针对丙烷脱氢制丙烯的反应,压强分别为p1、p2(p1>p2)时,体系中丙烷和丙烯的平衡体积分数与温度的关系如图2所示。

表示p2对应的丙烯平衡体积分数的曲线为
(4)丙烷还可通过CO2氧化脱氢制丙烯,反应为C3H8(g)+CO2(g)
 C3H6(g)+H2O(g)+CO(g) △H<0,与催化剂直接脱氢相比,该法的优点为
C3H6(g)+H2O(g)+CO(g) △H<0,与催化剂直接脱氢相比,该法的优点为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】二氧化碳在工业生产中的综合利用是实现碳中和的重要研究课题。回答下列问题:
(1)合成尿素
已知合成尿素反应为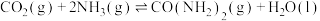
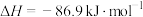 。合成机理及能量变化如图所示(TS表示过渡态):
。合成机理及能量变化如图所示(TS表示过渡态): ,则
,则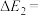
_________  。
。
②在TK时,向恒容密闭容器中充入等体积的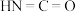 (g)和
(g)和 (g),发生反应。平衡时
(g),发生反应。平衡时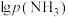 与
与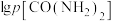 的关系如图所示,其中p为物质的分压(单位为kPa)。
的关系如图所示,其中p为物质的分压(单位为kPa)。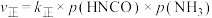 ,
,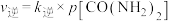 ,则
,则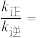
_________  。M点时继续向该容器中充入少量等体积两种反应物,再次达平衡时,
。M点时继续向该容器中充入少量等体积两种反应物,再次达平衡时, 的体积分数
的体积分数_________ (填“增大”、“不变”或“减小”)。
(2)合成甲醇
一定温度下,将 (g)和
(g)和 (g)按
(g)按 充入恒容密闭容器中,初始压强
充入恒容密闭容器中,初始压强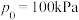 ,发生以下反应:
,发生以下反应:
ⅰ.
ⅱ.
ⅲ.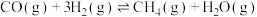
实验测得反应经25min达平衡,此时 ,压强
,压强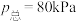 且
且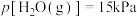 ,则
,则
①平衡时, 的平均分压变化率为
的平均分压变化率为_________ 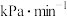 ,
, 转化率为
转化率为_________ 。
②反应ⅱ的压强平衡常数
__________ (以平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)合成尿素
已知合成尿素反应为
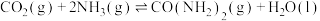
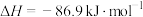 。合成机理及能量变化如图所示(TS表示过渡态):
。合成机理及能量变化如图所示(TS表示过渡态):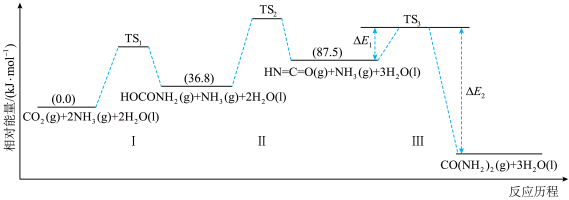
 ,则
,则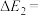
 。
。②在TK时,向恒容密闭容器中充入等体积的
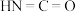 (g)和
(g)和 (g),发生反应。平衡时
(g),发生反应。平衡时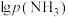 与
与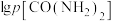 的关系如图所示,其中p为物质的分压(单位为kPa)。
的关系如图所示,其中p为物质的分压(单位为kPa)。
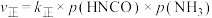 ,
,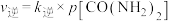 ,则
,则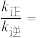
 。M点时继续向该容器中充入少量等体积两种反应物,再次达平衡时,
。M点时继续向该容器中充入少量等体积两种反应物,再次达平衡时, 的体积分数
的体积分数(2)合成甲醇
一定温度下,将
 (g)和
(g)和 (g)按
(g)按 充入恒容密闭容器中,初始压强
充入恒容密闭容器中,初始压强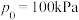 ,发生以下反应:
,发生以下反应:ⅰ.

ⅱ.

ⅲ.
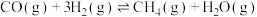
实验测得反应经25min达平衡,此时
 ,压强
,压强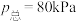 且
且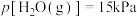 ,则
,则①平衡时,
 的平均分压变化率为
的平均分压变化率为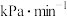 ,
, 转化率为
转化率为②反应ⅱ的压强平衡常数

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】请回答下列问题。
I.在一定体积的密闭容器中,进行如下化学反应: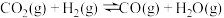 ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______ 。
(2)该反应的正反应为_______ (填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为_______  。此温度下加入
。此温度下加入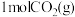 和
和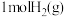 ,充分反应,达到平衡时,CO2的转化率为
,充分反应,达到平衡时,CO2的转化率为_______ 。
(4)在 时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 为
为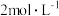 ,
, 为
为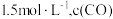 为
为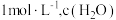 为
为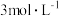 ,则此时平衡
,则此时平衡_______ (填“向左移动”“向右移动”或“不移动”)。
II.H2S受热发生分解反应: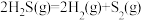 ,在密闭容器中充入
,在密闭容器中充入 ,压强为p时,控制不同的温度(从左到右依次为
,压强为p时,控制不同的温度(从左到右依次为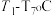 )进行实验,H2S的平衡转化率如图所示。
)进行实验,H2S的平衡转化率如图所示。

(5)压强为p,温度为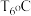 时,反应经
时,反应经 达到平衡,则平均反应速率
达到平衡,则平均反应速率
_______ 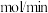 。
。
(6)若压强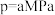 ,温度为
,温度为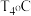 时,该反应的平衡常数
时,该反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
I.在一定体积的密闭容器中,进行如下化学反应:
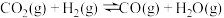 ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示: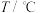 | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应的正反应为
(3)某温度下,平衡浓度符合下式:
 ,试判断此时的温度为
,试判断此时的温度为 。此温度下加入
。此温度下加入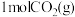 和
和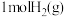 ,充分反应,达到平衡时,CO2的转化率为
,充分反应,达到平衡时,CO2的转化率为(4)在
 时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 为
为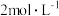 ,
, 为
为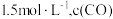 为
为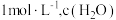 为
为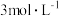 ,则此时平衡
,则此时平衡II.H2S受热发生分解反应:
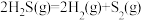 ,在密闭容器中充入
,在密闭容器中充入 ,压强为p时,控制不同的温度(从左到右依次为
,压强为p时,控制不同的温度(从左到右依次为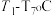 )进行实验,H2S的平衡转化率如图所示。
)进行实验,H2S的平衡转化率如图所示。
(5)压强为p,温度为
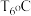 时,反应经
时,反应经 达到平衡,则平均反应速率
达到平衡,则平均反应速率
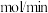 。
。(6)若压强
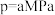 ,温度为
,温度为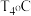 时,该反应的平衡常数
时,该反应的平衡常数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ + SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

乙同学查阅资料得知:
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
① 经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ +
 SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol•L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
您最近一年使用:0次
【推荐3】某小组从反应速率和产物角度探究Mg与NaHCO3溶液反应。
实验I、25°C, 相同镁条分别与下列试剂反应
(1)已知: Mg(OH)2固体致密,易包裹在金属表面成膜。根据上述现象,推测在实验ii中。
①Mg可以提高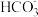 的电离程度,原因是
的电离程度,原因是___________ ;
②浑浊的主要原因是产生了___________ (填化学式) ;
③实验ii中产生气泡的速率快于实验i的原因可能是___________ 。
(2)补充实验II,证实(1)的推测:
①小组设计实验iii 的目的是___________ ; 甲同学结合实验iv的现象认为可以不必进行实验iii,他的理由是___________ ;
②实验ii生成气体的速率快于实验iv,原因可能是___________ ;
③查资料知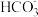 +Mg2+
+Mg2+  [Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因
[Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因___________ 。
实验I、25°C, 相同镁条分别与下列试剂反应
| 序号 | 试剂 | 浓度(mol·L-1) | 体积(mL) | pH | 现象 |
| i | H2O | —— | 7.5 | 7 | 镁条表面有微量气泡附着 |
| ii | NaHCO3溶液 | 1.0 | 7.5 | 8.4 | 镁条表面持续产生大量气泡,溶液略显浑浊,点燃气泡有爆鸣声 |
①Mg可以提高
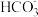 的电离程度,原因是
的电离程度,原因是②浑浊的主要原因是产生了
③实验ii中产生气泡的速率快于实验i的原因可能是
(2)补充实验II,证实(1)的推测:
| 序号 | 试剂 | 浓度(mol·L-1) | 体积(mL) | pH | 现象 |
| iii | NaNO3溶液 | 1.0 | 7.5 | 7 | 镁条表面有微量气泡附着 |
| iv | Na2CO3溶液 | 0.5 | 7.5 | 11.8 | 持续产生少量气泡,溶液显浑浊 |
②实验ii生成气体的速率快于实验iv,原因可能是
③查资料知
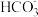 +Mg2+
+Mg2+  [Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因
[Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称_______ ,可作为碱使用的原因是_______ (用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ·mol-1
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5 kJ·mol-1
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=_______ kJ·mol−1,该反应的平衡常数表达式K=_______ 。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中 =
=_______ 。已知Ksp(BaCO3)=2.6×10−9,Ksp(BaSO4)=1.1×10−10。
(4)溶液中Cu2+的浓度可采用碘量法测得:①2Cu2++5I-=2CuI↓+I ②I
②I +2S2O
+2S2O = S4O
= S4O +3I-;反应①中的氧化剂为
+3I-;反应①中的氧化剂为 _______ 。现取20.00 mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol• L-1的Na2S2O3,标准溶液滴定至终点,消耗Na2S2O3溶液25.00 mL,此溶液中Cu2+的浓度为_______ mol• L-1。
(1)碳酸钠俗称
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ·mol-1
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5 kJ·mol-1
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中
 =
=(4)溶液中Cu2+的浓度可采用碘量法测得:①2Cu2++5I-=2CuI↓+I
 ②I
②I +2S2O
+2S2O = S4O
= S4O +3I-;反应①中的氧化剂为
+3I-;反应①中的氧化剂为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 捕集技术能有效解决温室效应及能源短缺问题。
捕集技术能有效解决温室效应及能源短缺问题。
(1) 催化加氢制
催化加氢制 的反应体系中,发生的反应如下:
的反应体系中,发生的反应如下:
反应Ⅰ:

反应Ⅱ: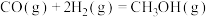

反应Ⅲ: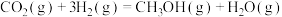

将 与
与 按照一定流速通过催化剂反应,测得
按照一定流速通过催化剂反应,测得 的转化率与产物的选择性
的转化率与产物的选择性 选择性
选择性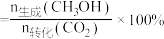 ]随温度变化如图所示:
]随温度变化如图所示:
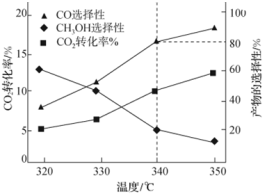
①
________ (用含 、
、 的式子表示)。
的式子表示)。
②反应Ⅲ的平衡常数表达式为________ 。
③340℃时,原料气按 相同流速通过催化剂反应,出口处测得气体中
相同流速通过催化剂反应,出口处测得气体中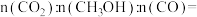
________ 。
(2)电催化还原 生成含碳产物(如CO、
生成含碳产物(如CO、 等)原理如图所示:
等)原理如图所示:

若阴极产物为 ,则该电极反应式为
,则该电极反应式为________ 。
(3)对于反应
 ,在一定条件下存在:
,在一定条件下存在: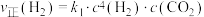 或
或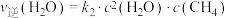 ,相应的速率与温度关系如图所示。
,相应的速率与温度关系如图所示。
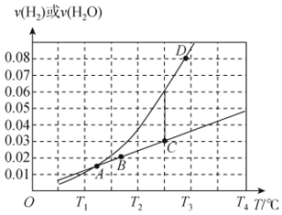
该反应的平衡常数
________ (用含 、
、 的代数式表示),图中A、B、C、D四个点中,能表示反应已达到平衡状态的是
的代数式表示),图中A、B、C、D四个点中,能表示反应已达到平衡状态的是________ 。
 捕集技术能有效解决温室效应及能源短缺问题。
捕集技术能有效解决温室效应及能源短缺问题。(1)
 催化加氢制
催化加氢制 的反应体系中,发生的反应如下:
的反应体系中,发生的反应如下:反应Ⅰ:


反应Ⅱ:
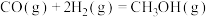

反应Ⅲ:
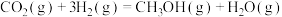

将
 与
与 按照一定流速通过催化剂反应,测得
按照一定流速通过催化剂反应,测得 的转化率与产物的选择性
的转化率与产物的选择性 选择性
选择性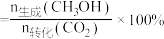 ]随温度变化如图所示:
]随温度变化如图所示:
①

 、
、 的式子表示)。
的式子表示)。②反应Ⅲ的平衡常数表达式为
③340℃时,原料气按
 相同流速通过催化剂反应,出口处测得气体中
相同流速通过催化剂反应,出口处测得气体中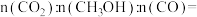
(2)电催化还原
 生成含碳产物(如CO、
生成含碳产物(如CO、 等)原理如图所示:
等)原理如图所示:
若阴极产物为
 ,则该电极反应式为
,则该电极反应式为(3)对于反应

 ,在一定条件下存在:
,在一定条件下存在: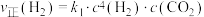 或
或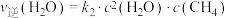 ,相应的速率与温度关系如图所示。
,相应的速率与温度关系如图所示。
该反应的平衡常数

 、
、 的代数式表示),图中A、B、C、D四个点中,能表示反应已达到平衡状态的是
的代数式表示),图中A、B、C、D四个点中,能表示反应已达到平衡状态的是
您最近一年使用:0次
【推荐3】PH3是粮食杀虫处理时常用的熏蒸杀虫剂;水煤气变换时产生的PH3能使催化剂中毒,必须脱除。回答下列问题:
(1)PH3通入 NaClO溶液脱除PH3时,氧化产物是一种含氧酸且反应中氧化剂与还原剂的物质的量之比为4:1,则该含氧酸的化学式为______ 。
(2)已知下列键能数据及P4(白磷)分子结构:
则反应4PH3(g)⇌P4(g)+6H2(g)△H=______ kJ•mol-1;某温度时平衡体系中c(PH3)=0.25mol•L-1,c(H2)=c(P4)=0.50mol•L-1,则平衡常数K=______ 。
(3)文献报道“反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s)”是铁触媒中毒的主导反应,其平衡常数Kp(Kp为以分压表示的平衡常数)的对数值与温度的关系如图所示:

①该反应的△H______ 0(填“>”“<”或“=”)。
②图中lgKp=______ [列出用分压p(CO2)、p(PH3)、p(H2O)表示的计算式]。
(4)反应(CH3)3AuPH3→(CH3)AuPH3+C2H6的历程如下:
第一步:(CH3)3AuPH3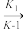 (CH3)3Au+PH3(快反应)
(CH3)3Au+PH3(快反应)
第二步:(CH3)3Au C2H6+CH3Au(慢反应)
C2H6+CH3Au(慢反应)
第三步:CH3Au+PH3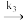 (CH3)AuPH3(快反应)
(CH3)AuPH3(快反应)
①反应的中间产物有PH3、______ 。
②第______ 步(填“一”“二”或“三”)反应的活化能最大。
(5)用Cu2+、Pd2+液相脱除PH3的反应为:PH3+2O2 H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:

O2的体积分数大,PH3的净化效率高的原因是______ (用碰撞理论等说明)。
(1)PH3通入 NaClO溶液脱除PH3时,氧化产物是一种含氧酸且反应中氧化剂与还原剂的物质的量之比为4:1,则该含氧酸的化学式为
(2)已知下列键能数据及P4(白磷)分子结构:
| 化学键 | P-P | H-H | P-H |  |
| 键能/(kJ•mol-1) | 213 | 436 | 322 |
(3)文献报道“反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s)”是铁触媒中毒的主导反应,其平衡常数Kp(Kp为以分压表示的平衡常数)的对数值与温度的关系如图所示:

①该反应的△H
②图中lgKp=
(4)反应(CH3)3AuPH3→(CH3)AuPH3+C2H6的历程如下:
第一步:(CH3)3AuPH3
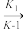 (CH3)3Au+PH3(快反应)
(CH3)3Au+PH3(快反应)第二步:(CH3)3Au
 C2H6+CH3Au(慢反应)
C2H6+CH3Au(慢反应)第三步:CH3Au+PH3
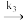 (CH3)AuPH3(快反应)
(CH3)AuPH3(快反应)①反应的中间产物有PH3、
②第
(5)用Cu2+、Pd2+液相脱除PH3的反应为:PH3+2O2
 H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
O2的体积分数大,PH3的净化效率高的原因是
您最近一年使用:0次



