I. 已知:H2O2可看作二元弱酸。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式________________ 。
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:___________ △H <0 快反应
(3)能正确表示I-催化H2O2分解原理的示意图为______ 。

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应
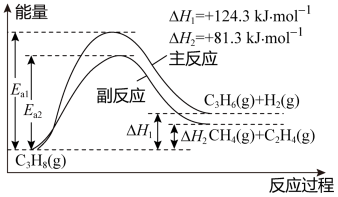
已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =______ kJ·mol-1。
副反应丙烷裂解制乙烯的过程中,其原子利用率为_______ (保留三位有效数字)。
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:
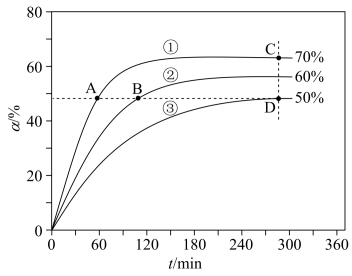
①A、B、D三点中,k正/k逆 值最大的是_________ ,
②A、B、C、D四点中,v逆 最大的是_________ 。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:
(3)能正确表示I-催化H2O2分解原理的示意图为

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应

已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =
| H2 | CH4 | C2H4 | |
| △H /kJ·mol—1 | -285.8 | -890.3 | -1411.0 |
副反应丙烷裂解制乙烯的过程中,其原子利用率为
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:

①A、B、D三点中,k正/k逆 值最大的是
②A、B、C、D四点中,v逆 最大的是
更新时间:2021-10-21 00:28:43
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。请回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物NOx,用CH4催化还原NOx可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-865.0 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-112.5 kJ·mol-1
③适量的N2和O2完全反应,每生成2.24 L(标准状况下)NO时,吸收8.9 kJ的热量。
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=___________ kJ·mol-1。
(2)已知合成氨反应N2(g)+3H2(g)⇌2NH3(g) △H=-92 kJ·mol-1
①合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图1所示(其他条件相同),则实际生产中适宜选择的催化剂是______ (填“A”、“B”或“C”),理由是______ 。
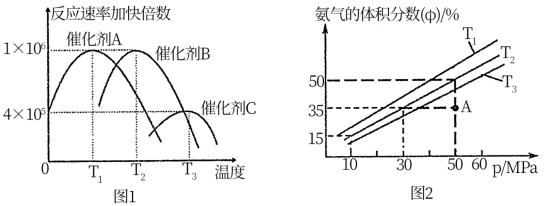
②科研小组模拟不同条件下的合成氨反应,向刚性容器中充人10.0 mol N2和20.0 mol H2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图2,T1、T2、T3由小到大的排序为___________ ;在T2、50MPa条件下,A点v正___________ v逆(填“>”、“<”或“=”);在温度T2压强50 MPa时,平衡常数Kp=___________ MPa-2(列出表达式,分压=总压×物质的量分数)。
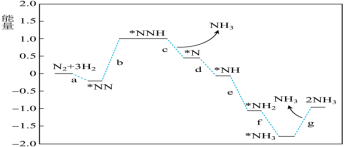
③合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步N2(g)→2N*;H2(g)→2H*(慢反应)
第二步N*+H*⇌NH*;NH*+H*⇌NH2*;NH2*+H*⇌NH3*;(快反应)
第三步NH3*⇌NH3(g)(快反应)
i.第一步反应的活化能E1与第二步反应的活化能E2相比:E1>E2,请写出判断理由___________ 。
ii.关于合成氨工艺的下列理解,正确的有___________ (填写字母编号)。
A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和加快的反应速率
B.合成氨反应在不同温度下的△H和△S都小于零
C.NH3易液化,不断将液氨移去,利于反应正向进行
D.原料气中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生
(1)煤燃烧产生的烟气中含有氮的氧化物NOx,用CH4催化还原NOx可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-865.0 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-112.5 kJ·mol-1
③适量的N2和O2完全反应,每生成2.24 L(标准状况下)NO时,吸收8.9 kJ的热量。
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=
(2)已知合成氨反应N2(g)+3H2(g)⇌2NH3(g) △H=-92 kJ·mol-1
①合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图1所示(其他条件相同),则实际生产中适宜选择的催化剂是

②科研小组模拟不同条件下的合成氨反应,向刚性容器中充人10.0 mol N2和20.0 mol H2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图2,T1、T2、T3由小到大的排序为
③合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步N2(g)→2N*;H2(g)→2H*(慢反应)
第二步N*+H*⇌NH*;NH*+H*⇌NH2*;NH2*+H*⇌NH3*;(快反应)
第三步NH3*⇌NH3(g)(快反应)
i.第一步反应的活化能E1与第二步反应的活化能E2相比:E1>E2,请写出判断理由
ii.关于合成氨工艺的下列理解,正确的有
A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和加快的反应速率
B.合成氨反应在不同温度下的△H和△S都小于零
C.NH3易液化,不断将液氨移去,利于反应正向进行
D.原料气中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)水能发生自偶电离2H2O H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程____ 。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)___ pH(NaHN2O2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=____ (保留三位有效数字)。
③0.lmol/L NaHN2O2溶液中离子浓度由大到小的顺序为____ 。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
反应II:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;
反应III:H2O(l)═H2O(g) △H3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为_____ 。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为____ 。
②图2中能正确反应平衡常数K随温度变化关系的曲线为_____ (填字母标号)。
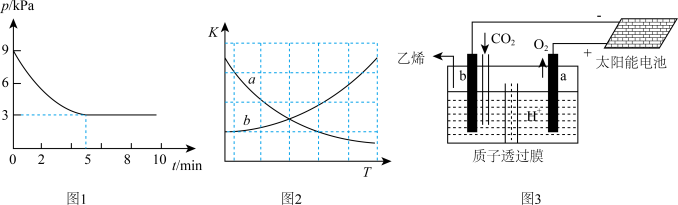
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为______ 。
(1)水能发生自偶电离2H2O
 H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=
③0.lmol/L NaHN2O2溶液中离子浓度由大到小的顺序为
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)
 NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
NH2CO2NH4(s) △H1=-159.5kJ•mol-1;反应II:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;反应III:H2O(l)═H2O(g) △H3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为
②图2中能正确反应平衡常数K随温度变化关系的曲线为

(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】硫及其化合物对人类的生产和生活有着重要的作用。
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:O2(g)+2C(s)=2CO(g) ΔH=-221kJ·mol-1,
写出O2氧化Ba(s)和S(s)至BaSO4的热化学方程式___________________ 。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g) 2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示

①与实验a相比,c组改变的实验条件可能是______________ ,判断的依据是______________________ 。
②用P0表示开始时总压强,P表示平衡时总压强,用α表示SO2的平衡转化率,则α的表达式为______________________ 。
(3)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)⇌SO3(g)+NO(g) ΔH=-42kJ·mol-1。
在1 L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如下:
①实验甲中,若2 min 时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2 (g)表示的平均反应速率υ(SO2)=__________ ,该温度下的平衡常数为______________ 。
②实验丙中,达到平衡时,NO2的转化率为_______________ 。
③由表中数据可推知,T1_____ T2(填“>”“<”或“=”),判断的理由是____________________ 。
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:O2(g)+2C(s)=2CO(g) ΔH=-221kJ·mol-1,
写出O2氧化Ba(s)和S(s)至BaSO4的热化学方程式
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)
 2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
①与实验a相比,c组改变的实验条件可能是
②用P0表示开始时总压强,P表示平衡时总压强,用α表示SO2的平衡转化率,则α的表达式为
(3)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)⇌SO3(g)+NO(g) ΔH=-42kJ·mol-1。
在1 L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如下:
实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T2 | 0.20 | 0.30 | a |
①实验甲中,若2 min 时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2 (g)表示的平均反应速率υ(SO2)=
②实验丙中,达到平衡时,NO2的转化率为
③由表中数据可推知,T1
您最近一年使用:0次
【推荐1】2-甲氧基-2-甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:
反应Ⅰ: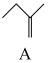 +CH3OH
+CH3OH
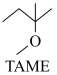 △H1
△H1
反应Ⅱ: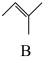 +CH3OH
+CH3OH
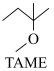 △H2
△H2
反应Ⅲ: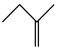
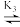
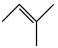 △H3
△H3
回答下列问题:
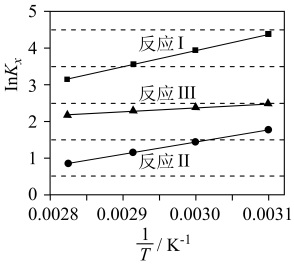
(1)反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是__ (用系统命名法命名); 的数值范围是
的数值范围是___ (填标号)。
A.<-1 B.-1~0 C.0~1 D.>1
(2)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为___ mol,反应Ⅰ的平衡常数Kx1=___ 。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应Ⅰ的化学平衡将__ (填“正向移动”“逆向移动”或“不移动”)平衡时,A与CH3OH物质的量浓度之比c(A):c(CH3OH)=___ 。
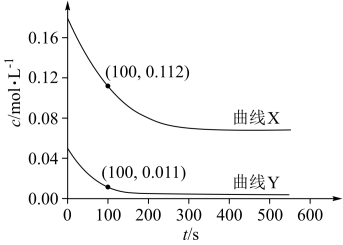
(3)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为__ (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率v正__ 逆反应速率v逆(填“>”“<”或“=)。
反应Ⅰ:
 +CH3OH
+CH3OH
 △H1
△H1反应Ⅱ:
 +CH3OH
+CH3OH
 △H2
△H2反应Ⅲ:

 △H3
△H3回答下列问题:
(1)反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是
 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1

(2)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为
(3)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要的作用。
(1)下图是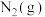 和
和 反应生成
反应生成 过程中能量的变化示意图,请写出
过程中能量的变化示意图,请写出 和
和 反应的热化学方程式:
反应的热化学方程式:_____ 。

(2)若已知下列数据:
试根据表中及图中数据计算 的键能:
的键能:_____  。
。
Ⅱ、我国力争于2030年前做到碳达峰,2060年前实现碳中和。 与
与 重整是
重整是 利用的研究热点之一。该重整反应体系主要涉及以下反应:
利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)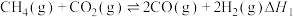
b)
c)
d)
e)
(3)根据盖斯定律,反应 的
的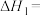
_____ (写出一个代数式即可)。
(4)上述反应体系在一定条件下建立平衡后,下列说法正确的有_____。
(5)一定条件下, 分解形成碳的反应历程如图1所示。该历程分
分解形成碳的反应历程如图1所示。该历程分_____ 步进行,其中,第_____ 步的正反应活化能最大。
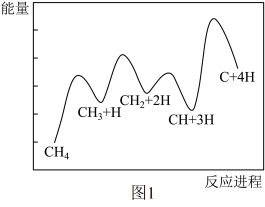
(6)设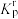 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以 。反应a、c、e的
。反应a、c、e的 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。
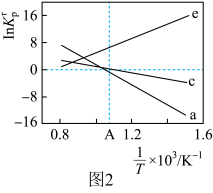
①反应a、c、e中,属于吸热反应的有_____ (填字母)。
②反应c的相对压力平衡常数表达式为
_____ 。
③在图2中 点对应温度下、原料组成为
点对应温度下、原料组成为 、初始总压为
、初始总压为 的恒容密闭容器中进行反应,体系达到平衡时
的恒容密闭容器中进行反应,体系达到平衡时 的分压为
的分压为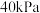 。计算
。计算 的平衡转化率等于
的平衡转化率等于_____
(7) 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:_____ 。
(1)下图是
 和
和 反应生成
反应生成 过程中能量的变化示意图,请写出
过程中能量的变化示意图,请写出 和
和 反应的热化学方程式:
反应的热化学方程式:
(2)若已知下列数据:
| 化学键 |  |  |
键能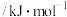 | 435 | 943 |
 的键能:
的键能: 。
。Ⅱ、我国力争于2030年前做到碳达峰,2060年前实现碳中和。
 与
与 重整是
重整是 利用的研究热点之一。该重整反应体系主要涉及以下反应:
利用的研究热点之一。该重整反应体系主要涉及以下反应:a)
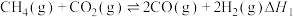
b)

c)

d)

e)

(3)根据盖斯定律,反应
 的
的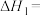
(4)上述反应体系在一定条件下建立平衡后,下列说法正确的有_____。
A.增大 与 与 的浓度,反应 的浓度,反应 的正反应速率都增加 的正反应速率都增加 |
B.移去部分 ,反应 ,反应 的平衡均向右移动 的平衡均向右移动 |
C.加入反应 的催化剂,可提高 的催化剂,可提高 的平衡转化率 的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |
(5)一定条件下,
 分解形成碳的反应历程如图1所示。该历程分
分解形成碳的反应历程如图1所示。该历程分
(6)设
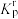 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以 。反应a、c、e的
。反应a、c、e的 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。
①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为

③在图2中
 点对应温度下、原料组成为
点对应温度下、原料组成为 、初始总压为
、初始总压为 的恒容密闭容器中进行反应,体系达到平衡时
的恒容密闭容器中进行反应,体系达到平衡时 的分压为
的分压为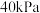 。计算
。计算 的平衡转化率等于
的平衡转化率等于(7)
 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】 的综合利用成为研究热点,
的综合利用成为研究热点, 作为碳源加氢是再生能源的有效方法。回答下列问题:
作为碳源加氢是再生能源的有效方法。回答下列问题:
Ⅰ.工业上利用 和
和 制备
制备 ,已知温度为T、压强为p时的摩尔生成焓
,已知温度为T、压强为p时的摩尔生成焓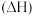 如表所示:
如表所示:
已知:一定温度下,由元素的最稳定单质生成 纯物质的热效应称为该物质的摩尔生成焓。
纯物质的热效应称为该物质的摩尔生成焓。
(1)温度为T、压强为p时,反应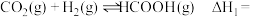
___________  。
。
(2)已知:温度为 时,
时,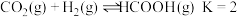 。实验测得:
。实验测得: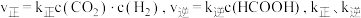 为速率常数。
为速率常数。
① 时,
时,
___________ 。
②若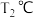 时,
时,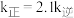 ,则
,则
___________ (填“>”“<”或“=”) 。
。
Ⅱ.在催化剂作用下, 可被氢气还原为甲醇:
可被氢气还原为甲醇: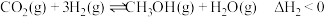 [同时有副反应
[同时有副反应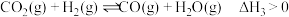 发生],
发生], 平衡转化率随温度和压强的变化如图。
平衡转化率随温度和压强的变化如图。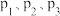 的大小关系:
的大小关系:___________ 。解释压强一定时, 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:___________ 。同时增大 的平衡转化率和
的平衡转化率和 的产率可采取的措施是
的产率可采取的措施是___________ 。
(4)向压强为p的恒温恒压密闭容器中加入 和
和 ,进行反应,达到平衡状态时,
,进行反应,达到平衡状态时, 的转化率为20%,生成
的转化率为20%,生成 的物质的量为
的物质的量为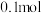 ,则甲醇的选择性为
,则甲醇的选择性为___________ %[甲醇选择性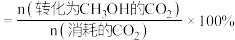 ];在该温度下,
];在该温度下, 的压强平衡常数
的压强平衡常数
___________ (列出计算式,分压=总压×物质的量分数)。
 的综合利用成为研究热点,
的综合利用成为研究热点, 作为碳源加氢是再生能源的有效方法。回答下列问题:
作为碳源加氢是再生能源的有效方法。回答下列问题:Ⅰ.工业上利用
 和
和 制备
制备 ,已知温度为T、压强为p时的摩尔生成焓
,已知温度为T、压强为p时的摩尔生成焓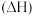 如表所示:
如表所示:| 气态物质 |  |  |  |
摩尔生成焓/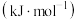 | 0 |  |  |
 纯物质的热效应称为该物质的摩尔生成焓。
纯物质的热效应称为该物质的摩尔生成焓。(1)温度为T、压强为p时,反应
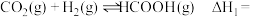
 。
。(2)已知:温度为
 时,
时,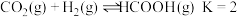 。实验测得:
。实验测得: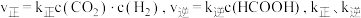 为速率常数。
为速率常数。①
 时,
时,
②若
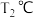 时,
时,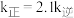 ,则
,则
 。
。Ⅱ.在催化剂作用下,
 可被氢气还原为甲醇:
可被氢气还原为甲醇: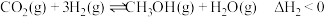 [同时有副反应
[同时有副反应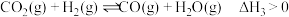 发生],
发生], 平衡转化率随温度和压强的变化如图。
平衡转化率随温度和压强的变化如图。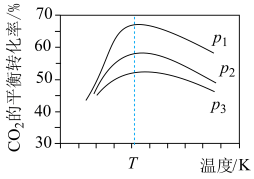
 的大小关系:
的大小关系: 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因: 的平衡转化率和
的平衡转化率和 的产率可采取的措施是
的产率可采取的措施是(4)向压强为p的恒温恒压密闭容器中加入
 和
和 ,进行反应,达到平衡状态时,
,进行反应,达到平衡状态时, 的转化率为20%,生成
的转化率为20%,生成 的物质的量为
的物质的量为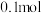 ,则甲醇的选择性为
,则甲醇的选择性为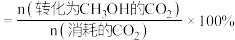 ];在该温度下,
];在该温度下, 的压强平衡常数
的压强平衡常数
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】科学家研究发现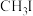 热裂解时主要发生如下反应:
热裂解时主要发生如下反应:
反应i:
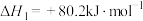
反应ii:
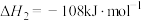
反应iii:
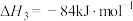
反应iv: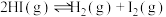
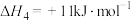
回答下列问题:
(1)反应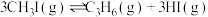

_____ 
(2)在密闭刚性容器中投料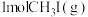 ,若只发生反应i、ii、iii,平衡总压强为pMPa,温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如下图甲所示。
,若只发生反应i、ii、iii,平衡总压强为pMPa,温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如下图甲所示。
①随温度升高, 物质的量分数先增大后减小的原因是
物质的量分数先增大后减小的原因是_____ 。
②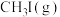 转化率
转化率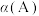
_____ 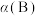 (填“>”“<”或“=”);715K时,反应i平衡常数
(填“>”“<”或“=”);715K时,反应i平衡常数
_____ MPa(列计算式)。

图甲 图乙
(3)反应iv的相关信息如下表:
①m=_____ ,反应iv逆反应的活化能=_____  。
。
②研究反应iv发现: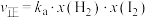 ,
,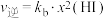 ,其中
,其中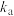 、
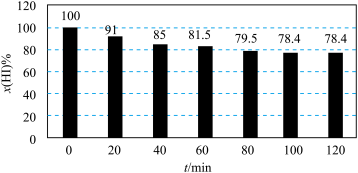
、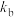 为常数。在某温度下,向刚性密闭容器中充入一定量的HI(g),碘化氢的物质的量分数x(HI)与反应时间t的关系如上图乙所示。
为常数。在某温度下,向刚性密闭容器中充入一定量的HI(g),碘化氢的物质的量分数x(HI)与反应时间t的关系如上图乙所示。
0~40min,反应的平均速率
_____ 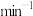 (用单位时间内物质的量分数的变化表示)。该温度下,反应iv的
(用单位时间内物质的量分数的变化表示)。该温度下,反应iv的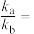
_____ (列计算式)。
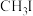 热裂解时主要发生如下反应:
热裂解时主要发生如下反应:反应i:

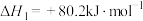
反应ii:

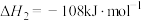
反应iii:

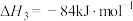
反应iv:
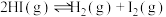
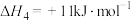
回答下列问题:
(1)反应
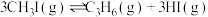


(2)在密闭刚性容器中投料
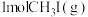 ,若只发生反应i、ii、iii,平衡总压强为pMPa,温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如下图甲所示。
,若只发生反应i、ii、iii,平衡总压强为pMPa,温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如下图甲所示。①随温度升高,
 物质的量分数先增大后减小的原因是
物质的量分数先增大后减小的原因是②
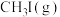 转化率
转化率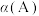
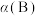 (填“>”“<”或“=”);715K时,反应i平衡常数
(填“>”“<”或“=”);715K时,反应i平衡常数


图甲 图乙
(3)反应iv的相关信息如下表:
| H-H键能 | I-I键能 | H-I键能 | 正反应活化能 |
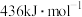 | 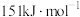 | 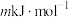 | 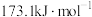 |
 。
。②研究反应iv发现:
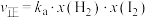 ,
,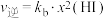 ,其中
,其中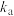 、
、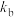 为常数。在某温度下,向刚性密闭容器中充入一定量的HI(g),碘化氢的物质的量分数x(HI)与反应时间t的关系如上图乙所示。
为常数。在某温度下,向刚性密闭容器中充入一定量的HI(g),碘化氢的物质的量分数x(HI)与反应时间t的关系如上图乙所示。0~40min,反应的平均速率

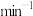 (用单位时间内物质的量分数的变化表示)。该温度下,反应iv的
(用单位时间内物质的量分数的变化表示)。该温度下,反应iv的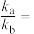
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】含硫化合物是工业上的常用化学品。
(1)工业上可以通过硫化氢分解制得H2和硫蒸气。在密闭容器中充入一定量H2S气体,反应原理:2H2S(g) 2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。
2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。

①图中压强(P1、P2、P3)从大到小顺序为_______ 。
②在温度T2、P3=6MPa条件下,该反应的平衡常数Kp=_______ (已知:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)工业上主要采用接触法由含硫矿石制备硫酸。
①下列关于接触法制备硫酸说法正确的是_______ 。
A.采用超高烟囱,将尾气排入空气中,是减少尾气污染的有效途径
B.在实际生产中,通入过量空气的目的是提高含硫矿石和SO2的转化率
C.在实际生产中,采用的压强是高压,其目的是高压能加快反应速率并提高原料转化率
D.在实际生产中,采用的温度是650℃-750℃,其主要原因是此时催化剂活性最高
②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中,b1→a2、b2→a3、b3→a4转化率的变化趋势为_______ ,原因是反应物正在进行_______ 。

③对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图3中画出反应2SO2(g)+O2(g)⇌2SO3(g)的转化率与最适宜温度(曲线Ⅰ)、平衡转化率与温度(曲线Ⅱ)的关系曲线示意图______ 。(标明曲线 Ⅰ 、 Ⅱ )

(3)一定条件下,在Na2S-H2SO4-H2O2溶液体系中,检测得到pH-时间振荡曲线如图4,同时观察到体系由澄清→浑浊→澄清的周期性变化。可用四个离子方程式,表示每一个周期内的一组反应进程。请补充步骤Ⅳ对应的离子方程式。

Ⅰ.
Ⅱ._______
Ⅲ. ;
;
Ⅳ._______
(1)工业上可以通过硫化氢分解制得H2和硫蒸气。在密闭容器中充入一定量H2S气体,反应原理:2H2S(g)
 2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。
2H2(g)+S2(g),H2S气体的平衡转化率与温度、压强的关系如图所示。
①图中压强(P1、P2、P3)从大到小顺序为
②在温度T2、P3=6MPa条件下,该反应的平衡常数Kp=
(2)工业上主要采用接触法由含硫矿石制备硫酸。
①下列关于接触法制备硫酸说法正确的是
A.采用超高烟囱,将尾气排入空气中,是减少尾气污染的有效途径
B.在实际生产中,通入过量空气的目的是提高含硫矿石和SO2的转化率
C.在实际生产中,采用的压强是高压,其目的是高压能加快反应速率并提高原料转化率
D.在实际生产中,采用的温度是650℃-750℃,其主要原因是此时催化剂活性最高
②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中,b1→a2、b2→a3、b3→a4转化率的变化趋势为

③对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图3中画出反应2SO2(g)+O2(g)⇌2SO3(g)的转化率与最适宜温度(曲线Ⅰ)、平衡转化率与温度(曲线Ⅱ)的关系曲线示意图

(3)一定条件下,在Na2S-H2SO4-H2O2溶液体系中,检测得到pH-时间振荡曲线如图4,同时观察到体系由澄清→浑浊→澄清的周期性变化。可用四个离子方程式,表示每一个周期内的一组反应进程。请补充步骤Ⅳ对应的离子方程式。

Ⅰ.

Ⅱ.
Ⅲ.
 ;
;Ⅳ.
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】合成氨对人类生存具有重大意义,反应为:
 。
。
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
由图像可知合成氨反应的
___________ 0(填“>”“<”或“=”),判断的依据是___________ 。
(2)下列有关合成氨的说法中,正确的是___________。
(3)原料气( 、
、 及少量CO、
及少量CO、 的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:Ac代表
(注:Ac代表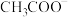 )。利于CO被吸收的反应条件有
)。利于CO被吸收的反应条件有___________________ (写出两点)。
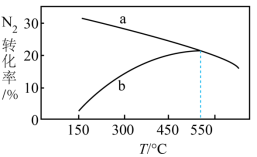
(4)若一定条件下,向体积相同的甲(含催化剂)、乙(不含催化剂)两个恒容密闭容器中分别充入等量的 和等量的
和等量的 进行合成氨反应。反应相同时间时测得两容器中
进行合成氨反应。反应相同时间时测得两容器中 的转化率随温度的变化如图所示,表示甲容器中
的转化率随温度的变化如图所示,表示甲容器中 的转化率随温度变化的曲线是
的转化率随温度变化的曲线是___________ (填“a”或“b”),随着温度的升高,乙容器中 的转化率变化的原因可能是
的转化率变化的原因可能是___________ 。
(5)一定条件下,若向容积为1.0L的反应容器中投入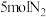 、
、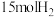 ,平衡时混合气中
,平衡时混合气中 的质量分数为40%,计算平衡常数
的质量分数为40%,计算平衡常数
___________ (可用分数表示)。

 。
。(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。

由图像可知合成氨反应的

(2)下列有关合成氨的说法中,正确的是___________。
| A.反应物断键吸收的总能量高于生成物成键放出的总能量 |
| B.使用催化剂和施加高压,都能提高反应速率,但都对化学平衡状态无影响 |
| C.合成氨工业温度选择400~500℃,主要是为了提高平衡混合物中氨的含量 |
| D.合成氨生产过程中采用循环操作,主要是为了提高氮气和氢气的利用率 |
 、
、 及少量CO、
及少量CO、 的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:Ac代表
(注:Ac代表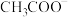 )。利于CO被吸收的反应条件有
)。利于CO被吸收的反应条件有(4)若一定条件下,向体积相同的甲(含催化剂)、乙(不含催化剂)两个恒容密闭容器中分别充入等量的
 和等量的
和等量的 进行合成氨反应。反应相同时间时测得两容器中
进行合成氨反应。反应相同时间时测得两容器中 的转化率随温度的变化如图所示,表示甲容器中
的转化率随温度的变化如图所示,表示甲容器中 的转化率随温度变化的曲线是
的转化率随温度变化的曲线是 的转化率变化的原因可能是
的转化率变化的原因可能是
(5)一定条件下,若向容积为1.0L的反应容器中投入
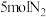 、
、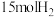 ,平衡时混合气中
,平衡时混合气中 的质量分数为40%,计算平衡常数
的质量分数为40%,计算平衡常数
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】以 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇: 。
。
已知: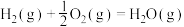
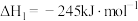
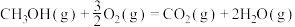
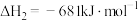
回答下列问题:
(1)计算上述合成甲醇反应的焓变
______  。
。
(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果.在3 MPa, 时,不同Ni、Ga配比的Ni-Ga/
时,不同Ni、Ga配比的Ni-Ga/ 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是______ 。催化剂的最佳配比和反应温度是______ 。 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数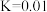 ,下列事实说明该反应已达平衡的是______。
,下列事实说明该反应已达平衡的是______。
(4)① 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1 L容器中投入1 mol
。5MPa,200℃时在1 L容器中投入1 mol  和3 mol
和3 mol  ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=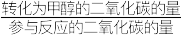 )。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)________________________ 。
②已知200℃时有60%以上的原料未转化,为了提高转化率,设计如图流程分离甲醇和水,循环利用原料气。已知甲醇的沸点是64.7℃,根据信息判断反应室的温度______ 闪蒸室的温度(选填“<”、“=”或“>”).在原料气中通入CO的目的是________________________ 。
 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇: 。
。已知:
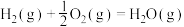
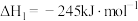
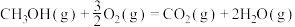
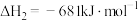
回答下列问题:
(1)计算上述合成甲醇反应的焓变

 。
。(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果.在3 MPa,
 时,不同Ni、Ga配比的Ni-Ga/
时,不同Ni、Ga配比的Ni-Ga/ 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是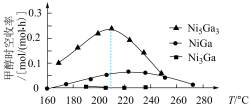
 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数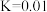 ,下列事实说明该反应已达平衡的是______。
,下列事实说明该反应已达平衡的是______。| A.气体密度保持不变 |
B. 与 与 的生成速率相等 的生成速率相等 |
C.某时刻容器中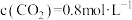 , ,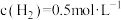 , , |
| D.混合气体的平均相对分子质量不变 |
 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1 L容器中投入1 mol
。5MPa,200℃时在1 L容器中投入1 mol  和3 mol
和3 mol  ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=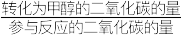 )。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)②已知200℃时有60%以上的原料未转化,为了提高转化率,设计如图流程分离甲醇和水,循环利用原料气。已知甲醇的沸点是64.7℃,根据信息判断反应室的温度
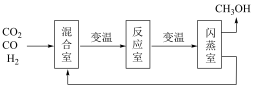
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
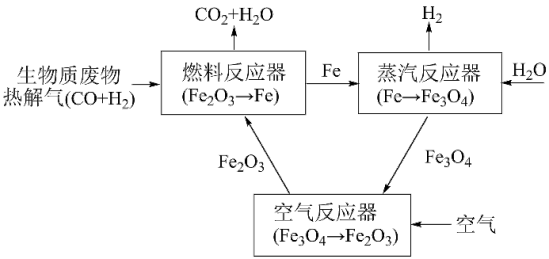
【推荐2】热解耦合化学链制氢工艺是一种将生物质废物转变为高纯 的环境友好型技术路线,如图。
的环境友好型技术路线,如图。
(1)在燃料反应器中,研究人员对纯 作为燃料气与铁基载氧体(
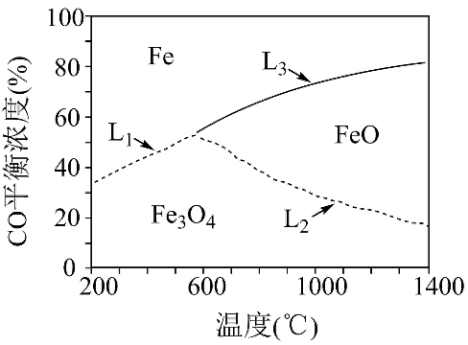
作为燃料气与铁基载氧体( )的还原反应进行了理论研究,得到了还原阶段
)的还原反应进行了理论研究,得到了还原阶段 平衡浓度和固体成分随温度变化的图象,如图。
平衡浓度和固体成分随温度变化的图象,如图。
已知:a.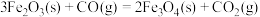
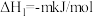
b.

c.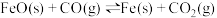
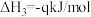
①反应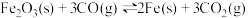 的
的
_______ 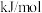 (用m、n、q表示)。
(用m、n、q表示)。
②当温度低于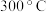 时,燃料还原阶段得到的固体主要是
时,燃料还原阶段得到的固体主要是 和
和_______ 。
③曲线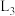 代表的反应为
代表的反应为_______ (填“b”或“c”),曲线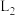 随温度升高而降低的原因是
随温度升高而降低的原因是_______ 。
④纯 作燃料气反应时发生歧化反应[
作燃料气反应时发生歧化反应[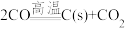 ]使铁基载氧体的固定床内大量积碳。对
]使铁基载氧体的固定床内大量积碳。对 歧化反应进行独立研究:
歧化反应进行独立研究: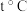 时,向一固定容器中通入一定量
时,向一固定容器中通入一定量 ,测得平衡后
,测得平衡后 的浓度为
的浓度为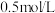 ,已知该温度下反应的平衡常数
,已知该温度下反应的平衡常数 ,
, 的平衡转化率是
的平衡转化率是_______ (写出计算过程,保留一位小数)。
(2) 深度还原
深度还原 的过程为:
的过程为: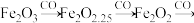
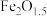
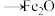 。该过程中,在不同铁基载氧体(
。该过程中,在不同铁基载氧体(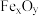 )表面的能垒变化如图所示:
)表面的能垒变化如图所示: 在各表面稳定吸附为初始状态(
在各表面稳定吸附为初始状态( ),
), 从各表面脱附进入气相为最终状态(
从各表面脱附进入气相为最终状态( )。
)。

① 在
在_______ 表面反应释放 的速率最快;释放等量
的速率最快;释放等量 时,在
时,在_______ 表面反应放出能量最多(填“Ⅰ”、“Ⅱ”、“ⅢI”或“Ⅳ”)。
② 在Ⅰ表面上的反应路径分三步:
在Ⅰ表面上的反应路径分三步:
i.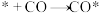 ;(*为活性点位)
;(*为活性点位)
ⅱ. ;
;
ⅲ._______ 。
(3)在蒸汽反应器中,研究表明:压强对出口气体百分含量的影响不大,其原因是_______ 。
 的环境友好型技术路线,如图。
的环境友好型技术路线,如图。
(1)在燃料反应器中,研究人员对纯
 作为燃料气与铁基载氧体(
作为燃料气与铁基载氧体( )的还原反应进行了理论研究,得到了还原阶段
)的还原反应进行了理论研究,得到了还原阶段 平衡浓度和固体成分随温度变化的图象,如图。
平衡浓度和固体成分随温度变化的图象,如图。
已知:a.
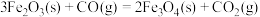
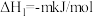
b.


c.
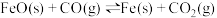
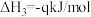
①反应
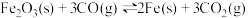 的
的
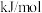 (用m、n、q表示)。
(用m、n、q表示)。②当温度低于
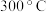 时,燃料还原阶段得到的固体主要是
时,燃料还原阶段得到的固体主要是 和
和③曲线
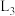 代表的反应为
代表的反应为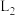 随温度升高而降低的原因是
随温度升高而降低的原因是④纯
 作燃料气反应时发生歧化反应[
作燃料气反应时发生歧化反应[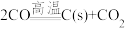 ]使铁基载氧体的固定床内大量积碳。对
]使铁基载氧体的固定床内大量积碳。对 歧化反应进行独立研究:
歧化反应进行独立研究: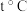 时,向一固定容器中通入一定量
时,向一固定容器中通入一定量 ,测得平衡后
,测得平衡后 的浓度为
的浓度为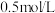 ,已知该温度下反应的平衡常数
,已知该温度下反应的平衡常数 ,
, 的平衡转化率是
的平衡转化率是(2)
 深度还原
深度还原 的过程为:
的过程为: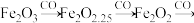
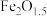
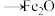 。该过程中,在不同铁基载氧体(
。该过程中,在不同铁基载氧体(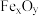 )表面的能垒变化如图所示:
)表面的能垒变化如图所示: 在各表面稳定吸附为初始状态(
在各表面稳定吸附为初始状态( ),
), 从各表面脱附进入气相为最终状态(
从各表面脱附进入气相为最终状态( )。
)。
①
 在
在 的速率最快;释放等量
的速率最快;释放等量 时,在
时,在②
 在Ⅰ表面上的反应路径分三步:
在Ⅰ表面上的反应路径分三步:i.
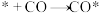 ;(*为活性点位)
;(*为活性点位)ⅱ.
 ;
;ⅲ.
(3)在蒸汽反应器中,研究表明:压强对出口气体百分含量的影响不大,其原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】I.钾是一种活泼金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应: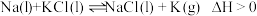 。
。
该反应的平衡常数可表示: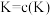 ,各物质的沸点与压强的关系见下表:
,各物质的沸点与压强的关系见下表:
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为________ ,而反应的最高温度应低于________ 。
(2)制取钾的过程中,为了提高原料的转化率可以采取的措施是________________ 。
(3)常压下,当反应温度升高到 时,该反应的平衡常数可表示为
时,该反应的平衡常数可表示为________ 。
II.
(4) 可用于合成甲醇,反应的化学方程式为
可用于合成甲醇,反应的化学方程式为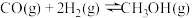 。
。 在不同温度下的平衡转化率与压强的关系如下图所示。该反应
在不同温度下的平衡转化率与压强的关系如下图所示。该反应
________ (填“>”或“<”)0。实际生产条件控制在 、
、 左右,选择此压强的理由是
左右,选择此压强的理由是________________________ 。

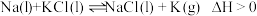 。
。该反应的平衡常数可表示:
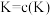 ,各物质的沸点与压强的关系见下表:
,各物质的沸点与压强的关系见下表:压强/ | 13.33 | 53.32 | 101.3 |
K的沸点/ | 590 | 710 | 770 |
| 700 | 830 | 890 |
| 1437 | ||
| 1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为
(2)制取钾的过程中,为了提高原料的转化率可以采取的措施是
(3)常压下,当反应温度升高到
 时,该反应的平衡常数可表示为
时,该反应的平衡常数可表示为II.
(4)
 可用于合成甲醇,反应的化学方程式为
可用于合成甲醇,反应的化学方程式为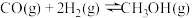 。
。 在不同温度下的平衡转化率与压强的关系如下图所示。该反应
在不同温度下的平衡转化率与压强的关系如下图所示。该反应
 、
、 左右,选择此压强的理由是
左右,选择此压强的理由是
您最近一年使用:0次


 的沸点/
的沸点/ 的沸点/
的沸点/ 的沸点/
的沸点/

