弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是_______ (结合方程式说明)。
(2)常温下,取 盐酸与
盐酸与 碱MOH溶液等体积混合,测得混合溶液后的
碱MOH溶液等体积混合,测得混合溶液后的 ,写出MOH的电离方程式
,写出MOH的电离方程式_______ 。
(3)室温下, 的NaHA溶液中,测得溶液显碱性。则
的NaHA溶液中,测得溶液显碱性。则
①该溶液中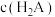
_______ 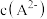 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②作出上述判断的依据是_______ (用文字解释)。
(4)常温下向含有1mol溶质的稀盐酸中缓慢通入1mol (溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是
(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是_______ ;在通入 的过程中溶液的导电能力
的过程中溶液的导电能力_______ (选填“变大”、“变小”或“几乎不变”)。
(5) 溶液与NaOH溶液混合至中性,则
溶液与NaOH溶液混合至中性,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(1)生活中明矾常作净水剂,其净水的原理是
(2)常温下,取
 盐酸与
盐酸与 碱MOH溶液等体积混合,测得混合溶液后的
碱MOH溶液等体积混合,测得混合溶液后的 ,写出MOH的电离方程式
,写出MOH的电离方程式(3)室温下,
 的NaHA溶液中,测得溶液显碱性。则
的NaHA溶液中,测得溶液显碱性。则①该溶液中
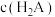
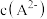 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②作出上述判断的依据是
(4)常温下向含有1mol溶质的稀盐酸中缓慢通入1mol
 (溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是
(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是 的过程中溶液的导电能力
的过程中溶液的导电能力(5)
 溶液与NaOH溶液混合至中性,则
溶液与NaOH溶液混合至中性,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
更新时间:2021-10-29 17:27:22
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】电解质溶液的电导率越大,导电能力越强。用0.1mol·L-1的NaOH溶液分别滴定体积均为10.00mL浓度均为0.1mol·L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示。
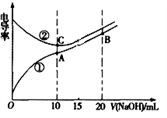
回答下列问题:
(1)曲线_______ 代表滴定CH3COOH溶液的曲线。
(2)在相同温度下,A、B、C三点溶液中水电离的c(H+)从大到小顺序为:___________________ 。
(3)若室温下,当NaOH溶液滴定CH3COOH溶液恰好使溶液PH=7时, 消耗NaOH溶液为V L,则V取值应在___ 处,
A.0 – 5mL B.5 – 10mL C.10 –1 5mL D.15 – 20mL
CH3COOH溶液的电离平衡常数Ka用V表示为 Ka =_______ (忽略混合时溶液体积的变化)。

回答下列问题:
(1)曲线
(2)在相同温度下,A、B、C三点溶液中水电离的c(H+)从大到小顺序为:
(3)若室温下,当NaOH溶液滴定CH3COOH溶液恰好使溶液PH=7时, 消耗NaOH溶液为V L,则V取值应在
A.0 – 5mL B.5 – 10mL C.10 –1 5mL D.15 – 20mL
CH3COOH溶液的电离平衡常数Ka用V表示为 Ka =
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】Ⅰ.在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸,若三者 相同:
相同:
(1)物质的量浓度由大到小的顺序是_________________ ,(用字母表示,下同):
(2)若三者体积也相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的 (相同状况),则开始时反应速率的大小关系为
(相同状况),则开始时反应速率的大小关系为________________ ,反应所需时间的长短关系是________ 。
(3)若三者体积也相同时,分别与等浓度的 稀溶液反应至
稀溶液反应至 ,则消耗
,则消耗 溶液的体积大小关系为
溶液的体积大小关系为________ 。
Ⅱ.已知亚磷酸( )为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的
)为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的 溶液,混合溶液的pH与离子浓度的关系如图所示。
溶液,混合溶液的pH与离子浓度的关系如图所示。
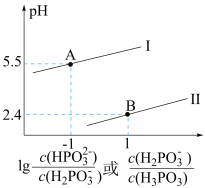
(4)写出亚磷酸电离的方程式:________________________ 、________________________ 。
(5)表示pH与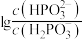 的变化关系的曲线是
的变化关系的曲线是________ (填“Ⅰ”或“Ⅱ”)。
(6)根据图像计算亚磷酸的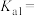
________ 。
 相同:
相同:(1)物质的量浓度由大到小的顺序是
(2)若三者体积也相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的
 (相同状况),则开始时反应速率的大小关系为
(相同状况),则开始时反应速率的大小关系为(3)若三者体积也相同时,分别与等浓度的
 稀溶液反应至
稀溶液反应至 ,则消耗
,则消耗 溶液的体积大小关系为
溶液的体积大小关系为Ⅱ.已知亚磷酸(
 )为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的
)为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的 溶液,混合溶液的pH与离子浓度的关系如图所示。
溶液,混合溶液的pH与离子浓度的关系如图所示。
(4)写出亚磷酸电离的方程式:
(5)表示pH与
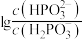 的变化关系的曲线是
的变化关系的曲线是(6)根据图像计算亚磷酸的
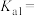
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现有下列物质①熔化的NaCl、②盐酸、③氯气、④冰醋酸、⑤铜、⑥酒精、⑦硫酸氢钠、⑧液氨、⑨SO2,请按要求回答下列问题。
(1)属于强电解质的是___________ (填序号)。
(2)在上述状态下能导电的是___________ (填序号)。
(3)属于弱电解质的是___________ (填序号)。
(4)属于非电解质,但溶于水后的水溶液能导电的是___________ (填序号)。
(5)可以证明④是弱酸的事实是___________(填序号)。
(6)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4。若四种溶液的物质的量浓度相同,其c(H+)由大到小顺序为___________ (用字母序号表示,下同)。若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为___________ 。
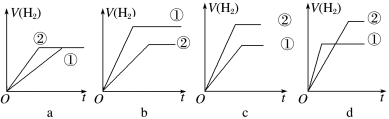
(7)常温下,有c(H+)相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是___________ (填字母)。(①表示盐酸,②表示醋酸)
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于弱电解质的是
(4)属于非电解质,但溶于水后的水溶液能导电的是
(5)可以证明④是弱酸的事实是___________(填序号)。
| A.等体积的0.1mol/L的乙酸与0.1mol/L的氢氧化钠恰好反应 |
| B.常温下,0.1mol/L的乙酸中pH>1 |
| C.乙酸与Na2CO3溶液反应放出CO2气体。 |
| D.1mol/L的乙酸水溶液能使紫色石蕊溶液变红色 |
(6)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4。若四种溶液的物质的量浓度相同,其c(H+)由大到小顺序为
(7)常温下,有c(H+)相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】(1)在一定温度下,有下列反应发生:Fe2O3(s)+3CO(g) ⇌2Fe(s)+3CO2(g),该反应的平衡常数表达式K=________ 。
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:_____________ ;不断加热FeCl3溶液,蒸干其水分并灼烧固体,最后得到的物质是________ 。
(3)已知:Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+ O2(g)===Fe2O3(s)的ΔH是
O2(g)===Fe2O3(s)的ΔH是____________________ 。
(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,下列说法中错误的是________ (填字母)。
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:
(3)已知:Fe2O3(s)+
 C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/molC(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+
 O2(g)===Fe2O3(s)的ΔH是
O2(g)===Fe2O3(s)的ΔH是(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,下列说法中错误的是
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,其目的是_________________________________________________ 。
(2)FeCl3净水的原理是(用离子方程式表示):______________________________ 将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_________ 。
(3)用纯碱溶液可清洗油污,其原因是(用离子方程式表示):_________________________
(4)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈现碱性的原因是(用离子方程式表示)______ ;灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是(用离子方程式表示):_________________________ ,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为:__________________________ 。
(2)FeCl3净水的原理是(用离子方程式表示):
(3)用纯碱溶液可清洗油污,其原因是(用离子方程式表示):
(4)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈现碱性的原因是(用离子方程式表示)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】 和
和 都是重要的化工产品,均可应用于造纸业。
都是重要的化工产品,均可应用于造纸业。
(1) 溶液的
溶液的 ,用离子方程式表示原因
,用离子方程式表示原因___________ 。
(2)某小组同学用如图所示装置探究饱和 和
和 溶液混合反应的实验。打开分液漏斗活塞向烧瓶中加入饱和
溶液混合反应的实验。打开分液漏斗活塞向烧瓶中加入饱和 溶液,产生大量的白色胶状沉淀。反应的离子方程式是
溶液,产生大量的白色胶状沉淀。反应的离子方程式是___________ 。

(3)已知在常温下测得浓度均为 的下列5种溶液的
的下列5种溶液的 :
:
判断下列反应不能成立的是___________ (填编号)。
A.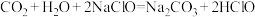
B.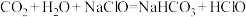
C.
D.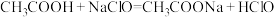
(4)亚磷酸( )是中强酸,它与足量的
)是中强酸,它与足量的 溶液反应生成
溶液反应生成 。试回答下列问题:
。试回答下列问题:
① 中
中 元素在周期表中的位置为
元素在周期表中的位置为___________ 。
② 是
是___________ (填“正盐”或者“酸式盐”)。
 和
和 都是重要的化工产品,均可应用于造纸业。
都是重要的化工产品,均可应用于造纸业。(1)
 溶液的
溶液的 ,用离子方程式表示原因
,用离子方程式表示原因(2)某小组同学用如图所示装置探究饱和
 和
和 溶液混合反应的实验。打开分液漏斗活塞向烧瓶中加入饱和
溶液混合反应的实验。打开分液漏斗活塞向烧瓶中加入饱和 溶液,产生大量的白色胶状沉淀。反应的离子方程式是
溶液,产生大量的白色胶状沉淀。反应的离子方程式是
(3)已知在常温下测得浓度均为
 的下列5种溶液的
的下列5种溶液的 :
:| 溶质 |  |  |  |  |  |
 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
判断下列反应不能成立的是
A.
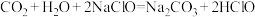
B.
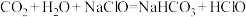
C.

D.
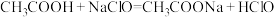
(4)亚磷酸(
 )是中强酸,它与足量的
)是中强酸,它与足量的 溶液反应生成
溶液反应生成 。试回答下列问题:
。试回答下列问题:①
 中
中 元素在周期表中的位置为
元素在周期表中的位置为②
 是
是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)==c(M+),而乙同学认为c(A-)与 c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为_____ 同学的说法正确,理由是_______ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知25℃时部分弱电解质的电离平衡常数如表所示,请回答下列有关问题:
(1)25℃时,NaHC2O4溶液显_______ 性(填“酸”“中”或“碱”),原因是_______ 。
(2)25℃时,若向氨水中加入少量硫酸铵固体,下列表达式的数据变小的是_______。
(3)常温下,体积均为10 ml、pH=2的盐酸溶液与醋酸溶液分别加蒸馏水稀释a倍和b倍到pH=4,a_______ b(填“>”“<”或“=”)。
(4)请写出在次氯酸钠溶液中通入少量二氧化碳气体的离子方程式:_______ 。
(5)常温下,将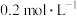 HCN溶液和
HCN溶液和 的NaOH溶液等体积混合后,此时溶液显
的NaOH溶液等体积混合后,此时溶液显_______ 性(填“酸”“中”或“碱”),该溶液中的质子守恒关系式为:_______ 。
| 化学式 | CH3COOH | H2C2O4 | HCN | HClO | H2CO3 |  |
 |  |  | 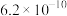 |  | 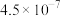 |  |
 | —— | 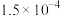 | —— | —— | 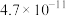 | —— |
(2)25℃时,若向氨水中加入少量硫酸铵固体,下列表达式的数据变小的是_______。
A. | B. | C. | D. |
(4)请写出在次氯酸钠溶液中通入少量二氧化碳气体的离子方程式:
(5)常温下,将
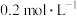 HCN溶液和
HCN溶液和 的NaOH溶液等体积混合后,此时溶液显
的NaOH溶液等体积混合后,此时溶液显
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】25℃时,三种酸的电离平衡常数如表所示,据此回答下列问题。
(1)一般情况下,当温度升高时,电离平衡常数
________ (填“增大”“减小”或“不变”)
(2)下列四种离子结合质子能力最强的是________ (填字母)。
a. b.
b. c.
c. d.
d.
(3)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
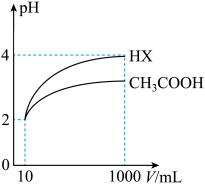
则HX的电离平衡常数________ (填或“<”,“=”或“<”下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的
________ 醋酸溶液中水电离出来的 ;用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸溶液
;用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸溶液________ HX溶液。
化学式 |
|
|
|
电离平衡常数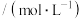 | 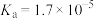 | 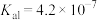  | 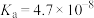 |
(1)一般情况下,当温度升高时,电离平衡常数

(2)下列四种离子结合质子能力最强的是
a.
 b.
b. c.
c. d.
d.
(3)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。

则HX的电离平衡常数

 ;用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸溶液
;用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸溶液
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c平(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
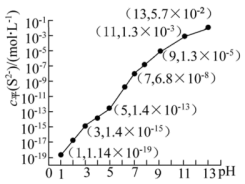
①pH=13时,溶液中的c平(H2S)+c平(HS-)=___________ mol·L-1
②某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液pH=___________ 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-15]
(2)25 ℃,亚硫酸的电离平衡常数如下表。
0.10 mol·L-1 NaHSO3溶液中离子浓度由大到小的顺序为___________ 。
(1)25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c平(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c平(H2S)+c平(HS-)=
②某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液pH=
(2)25 ℃,亚硫酸的电离平衡常数如下表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
0.10 mol·L-1 NaHSO3溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】常温下,向100mL0.01mol·L-1MOH溶液中逐滴加入0.02mol·L-1HA溶液,滴加过程中混合溶液的pH随着HA溶液体积变化如图所示(体积变化忽略不计)。
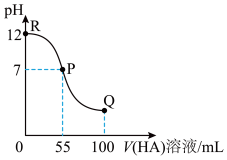
(1)由图中信息可知HA为___________ 酸(填“强”或 “弱”),理由是___________ 。
(2)R点时由水电离出的c(OH-)=___________ mol·L-1。
(3)常温下一定浓度的MA稀溶液中所有离子的浓度由大到小的顺序为:___________ 。
(4)Q点时所得溶液中,c(A-)+c(HA)___________ 2c(M+),c(M+)___________ c(HA)(填“>”、“<”或“=”)。

(1)由图中信息可知HA为
(2)R点时由水电离出的c(OH-)=
(3)常温下一定浓度的MA稀溶液中所有离子的浓度由大到小的顺序为:
(4)Q点时所得溶液中,c(A-)+c(HA)
您最近一年使用:0次






