室温下,向20mL盐酸和硫酸的混合溶液中逐渐滴入0.05mol/L的 溶液,生成的
溶液,生成的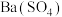 沉淀的质量和pH的变化如图所示(不考虑溶液混合时体积的变化)。
沉淀的质量和pH的变化如图所示(不考虑溶液混合时体积的变化)。
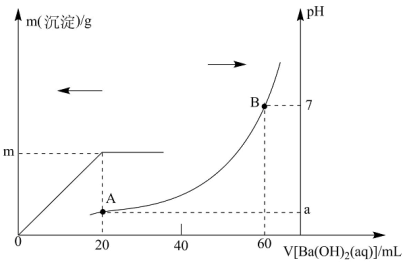
(1)原混合溶液中HCl的物质的量的浓度为___________ 。
(2)图中A点对应溶液的
___________ 。
(3)pH相等的NaOH溶液与 溶液,分别加热到相同的温度后,
溶液,分别加热到相同的温度后, 溶液的pH
溶液的pH___________ NaOH溶液的pH(填“>“=”或“<”)。
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的 ,则盐酸的体积
,则盐酸的体积___________ 氨水的体积(填“>“=”或“<”)。
(5)将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中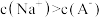 ,则:
,则:
①混合溶液中,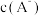
___________  (填“>”“=”或“<”,下同)。
(填“>”“=”或“<”,下同)。
②混合溶液中,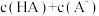
___________ 0.1mol/L。
(6)生活中常用明矾作净水剂,其原理是___________ (结合必要的离子方程式说明)。
(7)泡沫灭火器(硫酸铝和碳酸氢钠溶液)的作用原理是___________ (写出离子方程式)
(8)室温下,0.1mol/L的NaHA溶液中,测得溶液显碱性。则该溶液中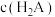
___________ 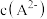 (填“>”<”或“=”)。
(填“>”<”或“=”)。
(9)①现有等物质的量浓度的下列五种溶液① 、②
、②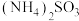 、③
、③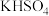 、④
、④ 、⑤
、⑤ ,溶液中水的电离程度由大到小的排列顺序是
,溶液中水的电离程度由大到小的排列顺序是___________ (填序号)。
② 可以将碘盐中的
可以将碘盐中的 还原为碘单质,试写出此反应的离子方程式:
还原为碘单质,试写出此反应的离子方程式:___________ 。
 溶液,生成的
溶液,生成的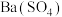 沉淀的质量和pH的变化如图所示(不考虑溶液混合时体积的变化)。
沉淀的质量和pH的变化如图所示(不考虑溶液混合时体积的变化)。
(1)原混合溶液中HCl的物质的量的浓度为
(2)图中A点对应溶液的

(3)pH相等的NaOH溶液与
 溶液,分别加热到相同的温度后,
溶液,分别加热到相同的温度后, 溶液的pH
溶液的pH(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的
 ,则盐酸的体积
,则盐酸的体积(5)将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中
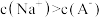 ,则:
,则:①混合溶液中,
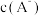
 (填“>”“=”或“<”,下同)。
(填“>”“=”或“<”,下同)。②混合溶液中,
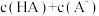
(6)生活中常用明矾作净水剂,其原理是
(7)泡沫灭火器(硫酸铝和碳酸氢钠溶液)的作用原理是
(8)室温下,0.1mol/L的NaHA溶液中,测得溶液显碱性。则该溶液中
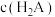
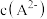 (填“>”<”或“=”)。
(填“>”<”或“=”)。(9)①现有等物质的量浓度的下列五种溶液①
 、②
、②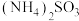 、③
、③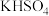 、④
、④ 、⑤
、⑤ ,溶液中水的电离程度由大到小的排列顺序是
,溶液中水的电离程度由大到小的排列顺序是②
 可以将碘盐中的
可以将碘盐中的 还原为碘单质,试写出此反应的离子方程式:
还原为碘单质,试写出此反应的离子方程式:
更新时间:2021-12-10 21:38:21
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】25℃时,有浓度均为0.1mol·L-l的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是___________ (填序号),其中②由水电离的H+浓度为___________ 。
(2)①中各离子浓度由大到小的顺序是___________ 。
(3)25℃时,测得HCN和NaCN的混合溶液的pH=11,则 =
=___________ (填写数值)。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为___________ 。
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
| HCN | H2CO3 | CH3COOH |
| Ka=5.0×10-10 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=1.75×10-5 |
(2)①中各离子浓度由大到小的顺序是
(3)25℃时,测得HCN和NaCN的混合溶液的pH=11,则
 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:________ 。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1NaOH溶液混合而成,则溶液M的pH______ (填“>”“<”或“=”)7,溶液中离子浓度由大到小的顺序为_______ ;
(3)若有三种溶液:①0.01 mol·L-1的H2A溶液、②0.01 mol·L-1的NaHA溶液、③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合,则三种溶液中c(H2A)最大的是______ ;pH由大到小的顺序为_______ 。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液中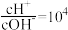 ,V1与V2的大小关系为
,V1与V2的大小关系为______ (填“V1>V2”“V1=V2”“V1<V2”或“均有可能”)。
(1)写出酸H2A的电离方程式:
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1NaOH溶液混合而成,则溶液M的pH
(3)若有三种溶液:①0.01 mol·L-1的H2A溶液、②0.01 mol·L-1的NaHA溶液、③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合,则三种溶液中c(H2A)最大的是
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液中
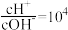 ,V1与V2的大小关系为
,V1与V2的大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】某温度下纯水的pH=7,按要求回答下列问题:
(1)pH=7的溶液呈_______ (填“酸性”“中性”或“碱性”)。
(2)该温度下某溶液中由水电离出的c(OH-)=10-9mol/L的pH=_______ 。
(3)pH=3的H2SO4溶液与pH=6的HCl溶液的等体积混合,溶液的pH=_______ 。
(4)将pH=2的盐酸和pH=11的氢氧化钠溶液,以体积比1∶9混合后,溶液的pH=_______ 。
(1)pH=7的溶液呈
(2)该温度下某溶液中由水电离出的c(OH-)=10-9mol/L的pH=
(3)pH=3的H2SO4溶液与pH=6的HCl溶液的等体积混合,溶液的pH=
(4)将pH=2的盐酸和pH=11的氢氧化钠溶液,以体积比1∶9混合后,溶液的pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】25℃时,往25 mL氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的一元酸HA溶液,pH变化曲线如图所示:
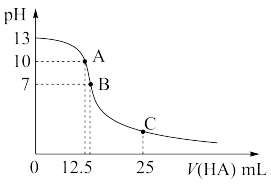
(1)该氢氧化钠溶液的物质的量浓度为________________ mol/L-1。
(2)A点对应酸的体积为12.5mL,则所得混合溶液中由水电离出 的c(OH-)=______ mol/L-1。
(3)在B点所得混合溶液中,c(Na+)、c(A-)、c(H+)、c(OH-)由大到小的顺序是__________ 。
(4)在C点所得混合溶液中,下列说法正确的是____________ (填字母序号)。
A.HA的电高程度大于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A-)>c(H+)>c(OH-)
C.c(Na+)+ c(H+)= c(A-)+c(OH-)
D.c(HA)+ c(A-)=0.2 mol·L-1

(1)该氢氧化钠溶液的物质的量浓度为
(2)A点对应酸的体积为12.5mL,则所得混合溶液中
(3)在B点所得混合溶液中,c(Na+)、c(A-)、c(H+)、c(OH-)由大到小的顺序是
(4)在C点所得混合溶液中,下列说法正确的是
A.HA的电高程度大于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A-)>c(H+)>c(OH-)
C.c(Na+)+ c(H+)= c(A-)+c(OH-)
D.c(HA)+ c(A-)=0.2 mol·L-1
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】现有以下浓度均为0.1mol·L-1的溶液:①KNO3溶液②CH3COONa溶液③NH4Cl溶液④NaOH溶液⑤氨水⑥CH3COOH溶液⑦盐酸⑧NaHCO3溶液⑨NaHC2O4溶液;已知常温下相关电离平衡常数如表:
回答下列有关小题:
(1)写出NaHCO3的电离方程式___ ;列出NH 的水解平衡常数表达式Kh(NH
的水解平衡常数表达式Kh(NH )=
)=___ ,计算常温下Kh(NH )=
)=___ 。
(2)②中各离子浓度由大到小的顺序为___ 。
(3)常温下:若将④和⑥混合,并使混合后溶液pH=7,则所需体积V④___ V⑥(填“>”“<”或“=”);若将④和⑦混合,并使混合后溶液pH=12,则V④:V⑦=__ ;将④和⑦等体积混合得w溶液,⑤和⑥等体积混合得Z溶液,混合后溶液pH值W___ Z(填“>”、“<”或“=”,下同);
(4)⑧和⑨混合如果能反应,写出离子反应方程式___ ,如果不能反应,则该小题不填。
| 弱电解质 | CH3COOH | NH3•H2O | H2CO3 | H2C2O4 |
| Ka或Kb | 1.8×10-5 | 1.8×10-5 | Ka1=4.3×10-7 | Ka1=5.6×10-2 Ka2=5.0×10-5 |
(1)写出NaHCO3的电离方程式
 的水解平衡常数表达式Kh(NH
的水解平衡常数表达式Kh(NH )=
)= )=
)=(2)②中各离子浓度由大到小的顺序为
(3)常温下:若将④和⑥混合,并使混合后溶液pH=7,则所需体积V④
(4)⑧和⑨混合如果能反应,写出离子反应方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题
(1)实验室在配制 的溶液时,为了抑制
的溶液时,为了抑制 的水解可加入少量的
的水解可加入少量的_______ (填写物质的名称).把 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是________ (填化学式).
(2)已知 水溶液呈碱性,其原因是
水溶液呈碱性,其原因是_________ (用离子方程式和相应的文字解释).
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.
高铁电池的总反应为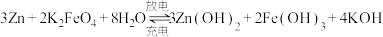 .充电时,阳极反应式为
.充电时,阳极反应式为______________ .
(1)实验室在配制
 的溶液时,为了抑制
的溶液时,为了抑制 的水解可加入少量的
的水解可加入少量的 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是(2)已知
 水溶液呈碱性,其原因是
水溶液呈碱性,其原因是(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.
高铁电池的总反应为
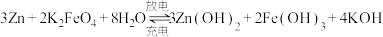 .充电时,阳极反应式为
.充电时,阳极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】水溶液中的离子平衡是以化学平衡理论为基础的进一步探究。
(1)常温下,等体积的0.10mol/L氨水与0.10mol/L烧碱溶液相比,c(OH-)的大小关系为前者_____ 后者(填“大于”“等于”或“小于”,下同);常温下,pH均为5的氯化铵溶液与盐酸相比,溶液中水的电离程度前者_____ 后者,两者均稀释10倍,pH的大小关系为前者_____ 后者。
(2)醋酸钠溶液呈碱性,其原因是_____ (用离子方程式表示)。
(3)常温下,Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36,则FeS的溶解度_____ CuS的溶解度(填“大于”“等于”或“小于”);在处理含有Cu2+的污水时,可向其中加入FeS固体作为沉淀剂,FeS逐渐溶解,Cu2+转化为CuS沉淀,用沉淀溶解平衡原理解释其原因为_____ 。
(1)常温下,等体积的0.10mol/L氨水与0.10mol/L烧碱溶液相比,c(OH-)的大小关系为前者
(2)醋酸钠溶液呈碱性,其原因是
(3)常温下,Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36,则FeS的溶解度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
(1)由上表判断NaHSO3溶液显_____ 性,试解释原因______ 。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______ 0.1mol•L-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______ 。
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m______ n(填“<”、“>”或“=”)
| n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显
(2)pH=8.2的吸收液中由水电离出的c(OH-)
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】已知草酸为二元弱酸:


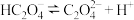

常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:

(1)如果所得溶液溶质为 ,则该溶液显
,则该溶液显______ (填“酸性”、“碱性”或“中性”); 的电离程度
的电离程度______ 水解程度(填“大于”、“等于”或“小于”)
(2)如果所得溶液溶质为 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为_____________ 。由电荷守恒得出的等式为__________________ 。
(3)当所得溶液pH=2.7时,溶液中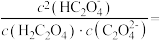
______ ;
(4)常温下,将体积相同,pH均等于10的 和KOH溶液,分别加水稀释m倍、n倍,稀释后溶液的pH都变成9,则m与n的大小关系为
和KOH溶液,分别加水稀释m倍、n倍,稀释后溶液的pH都变成9,则m与n的大小关系为______ 。


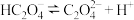

常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中
 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
(1)如果所得溶液溶质为
 ,则该溶液显
,则该溶液显 的电离程度
的电离程度(2)如果所得溶液溶质为
 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为(3)当所得溶液pH=2.7时,溶液中
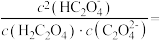
(4)常温下,将体积相同,pH均等于10的
 和KOH溶液,分别加水稀释m倍、n倍,稀释后溶液的pH都变成9,则m与n的大小关系为
和KOH溶液,分别加水稀释m倍、n倍,稀释后溶液的pH都变成9,则m与n的大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】25℃时,有浓度均为0.10 mol/L的下列4种溶液:①NaCN溶液 ②NaOH溶液③CH3COOH溶液 ④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是_______ (填序号),其中②由水电离的H+浓度为_______ 。
(2)①中各离子浓度由大到小的顺序是_______ 。向①溶液中通入少量CO2,则发生反应的离子方程式为_______ 。
(3)用离子方程式解释NaCN溶液显碱性的原因_______ 。
(4)CH3COOH和CH3COONa混合溶液中,若溶液pH=6则溶液中c(CH3COO-)-c(Na+)=_______ mol/L(填精确值)。
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10-10 mol/L | Ka1=4×10-7 mol/L Ka2=5.6×10-11 mol/L | Ka=1.7×10-5 mol/L |
(1)这4种溶液pH由大到小的顺序是
(2)①中各离子浓度由大到小的顺序是
(3)用离子方程式解释NaCN溶液显碱性的原因
(4)CH3COOH和CH3COONa混合溶液中,若溶液pH=6则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】按要求书写方程式和填空。
(1)NH4Cl水解_______ (离子方程式)。
(2)Na2CO3水解_______ (离子方程式)。
(3)Al2(SO4)3和Na2CO3溶液混合_______ (离子方程式)。
(4)在粗制CuSO4.5H2O晶体中常含有杂质Fe2+,提纯时为了除去Fe2+,常加入酸化的H2O2溶液作氧化剂,使Fe2+氧化为Fe3+,则该反应的离子方程式为_______
(5)①请写出Na2S溶液中的电荷守恒式_______
②请写出Na2S溶液中的质子守恒式_______
③请比较Na2S溶液中的离子浓度大小_______
(6)下列事实能说明醋酸是弱酸的是_______ (填序号)。
①醋酸钠溶液中CH3COO-与CH3COOH共存
②常温下,0.1mol/L的醋酸钠溶液的pH值约为9
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④常温下,0.1mol/L的醋酸的pH值约为4.8
⑤pH=4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸溶液消耗碱液多
(1)NH4Cl水解
(2)Na2CO3水解
(3)Al2(SO4)3和Na2CO3溶液混合
(4)在粗制CuSO4.5H2O晶体中常含有杂质Fe2+,提纯时为了除去Fe2+,常加入酸化的H2O2溶液作氧化剂,使Fe2+氧化为Fe3+,则该反应的离子方程式为
(5)①请写出Na2S溶液中的电荷守恒式
②请写出Na2S溶液中的质子守恒式
③请比较Na2S溶液中的离子浓度大小
(6)下列事实能说明醋酸是弱酸的是
①醋酸钠溶液中CH3COO-与CH3COOH共存
②常温下,0.1mol/L的醋酸钠溶液的pH值约为9
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④常温下,0.1mol/L的醋酸的pH值约为4.8
⑤pH=4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸溶液消耗碱液多
您最近一年使用:0次



