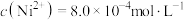T℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示,已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数,下列说法正确的是
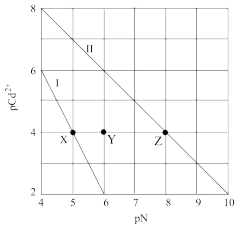

A.X点:c(Cd2+)<c(OH-);Z点:c(CO )<c(Cd2+) )<c(Cd2+) |
| B.溶度积的负对数:pKsp(CdCO3)<pKsp[Cd(OH)2] |
| C.Y点对应的CdCO3溶液为不饱和溶液,可以继续溶解CdCO3 |
D.T℃时,Cd(OH)2(s)+ (aq)⇌CdCO3(s)+2OH-(aq)的平衡常数K为102 (aq)⇌CdCO3(s)+2OH-(aq)的平衡常数K为102 |
2021·全国·模拟预测 查看更多[6]
(已下线)第16周 周测卷-备战2022年高考化学周测与晚练(新高考专用)河南省商城县观庙高级中学2021-2022学年高二上学期12月月考化学试题福建省福州高级中学2021-2022学年高二上学期期末化学考试题(已下线)【直击双一流】02-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)押江苏卷第13题 水溶液中的离子平衡 -备战2022年高考化学临考题号押题(江苏卷)湖南省株洲市攸县第一中学2022届高三下学期四月月考化学试题
更新时间:2021-12-17 12:35:28
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】已知25 ℃时有关弱酸的电离平衡常数如下表,则下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A.等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定小于b |
| C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小 |
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+c(H+)=c(OH-)+c(HCO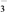 )+2c(CO )+2c(CO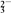 ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是


| A.HClO2的电离平衡常数的数值Ka=10-8 |
| B.pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH- |
| C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-) |
| D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】25℃下,将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.10 mol/L的NaOH溶液,整个过程中溶液pH变化的曲线如图所示,下列叙述中正确的是
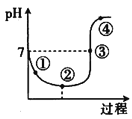

| A.点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) |
| B.点②所示溶液中:c(H+)>c(Cl-)>c(HClO)>c(ClO-) |
| C.点③所示溶液中:c(Na+)>2c(ClO-)+c(HClO) |
| D.点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
您最近一年使用:0次
【推荐1】已知: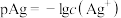 ,
,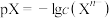 。
。 时,几种物质的
时,几种物质的 的值如下表:
的值如下表:
 、
、 、
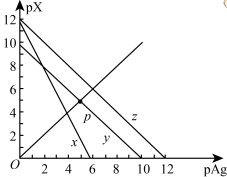
、 的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
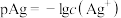 ,
,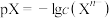 。
。 时,几种物质的
时,几种物质的 的值如下表:
的值如下表:| 化学式 |  |  |  |
| 颜色 | 白 | 浅黄 | 红 |
 |  |  |  |
 、
、 、
、 的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
A.图中x代表 曲线,z代表 曲线,z代表 曲线 曲线 |
B.298K时,在 和 和 的物质的量浓度均为 的物质的量浓度均为 的溶液中,滴入少量 的溶液中,滴入少量 的 的 溶液,首先产生的是红色沉淀 溶液,首先产生的是红色沉淀 |
| C.298K时,若增大p点的阴离子浓度,则y上的点沿曲线向上移动 |
D.298K时, 的平衡常数 的平衡常数 |
您最近一年使用:0次
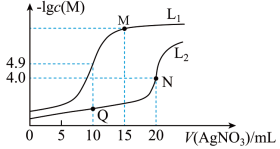
【推荐2】可溶性氯化物中氯含量的测定常采用莫尔法,此法是以 为指示剂,用
为指示剂,用 标准溶液进行滴定。某温度下,分别向
标准溶液进行滴定。某温度下,分别向 和
和 溶液中滴加
溶液中滴加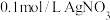 溶液,滴加过程中
溶液,滴加过程中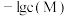 (M为
(M为 或
或 )与
)与 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
 为指示剂,用
为指示剂,用 标准溶液进行滴定。某温度下,分别向
标准溶液进行滴定。某温度下,分别向 和
和 溶液中滴加
溶液中滴加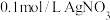 溶液,滴加过程中
溶液,滴加过程中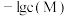 (M为
(M为 或
或 )与
)与 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
A.曲线 表示 表示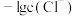 与 与 的变化关系 的变化关系 |
B.M点溶液中: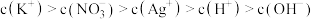 |
C.该温度下,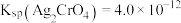 |
D.温度不变时,增大 溶液浓度,则曲线 溶液浓度,则曲线 中Q点移到N点 中Q点移到N点 |
您最近一年使用:0次
【推荐1】某温度时硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是


| A.向BaSO4悬浊液中加入浓度较大的Pb(NO3)2溶液可能转化成PbSO4 |
| B.X、Y两点对应的SrSO4均是饱和溶液,不能继续溶解SrSO4 |
| C.蒸发Z点的BaSO4溶液可得到C点状态的BaSO4溶液 |
| D.溶度积:Ksp(SrSO4)<Ksp(PbSO4)<Ksp(BaSO4) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
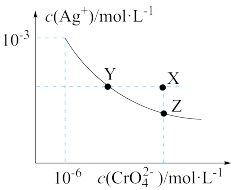
【推荐2】①已知t℃时AgCl的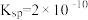 ;②
;② 是一种橙红色的固体。在t℃时
是一种橙红色的固体。在t℃时 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
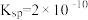 ;②
;② 是一种橙红色的固体。在t℃时
是一种橙红色的固体。在t℃时 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.在t℃时,用 标准溶液滴定20mL未知浓度的KCl溶液,可以采用 标准溶液滴定20mL未知浓度的KCl溶液,可以采用 溶液为指示剂 溶液为指示剂 |
B.在饱和 溶液中加入 溶液中加入 固体可使溶液由Y点到X点 固体可使溶液由Y点到X点 |
C.在t℃时,以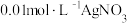 溶液滴定 溶液滴定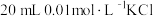 和 和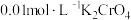 的混合溶液, 的混合溶液, 先沉淀 先沉淀 |
D.在t℃时,反应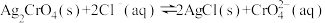 的平衡常数 的平衡常数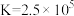 |
您最近一年使用:0次

 HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
HCO3-+OH-平衡,若通入CO2,则平衡逆向移动 和
和 ,对节约资源和环境保护有着重要意义,已知:当溶液中离子浓度小于
,对节约资源和环境保护有着重要意义,已知:当溶液中离子浓度小于 时,该离子沉淀完全。25℃时,
时,该离子沉淀完全。25℃时, 的电离常数
的电离常数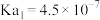 ,
,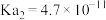 ,有关物质
,有关物质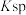 的如下表:
的如下表:





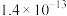

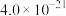

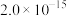

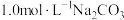 溶液与废水混合,生成的沉淀成分为
溶液与废水混合,生成的沉淀成分为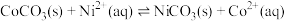 达到平衡,则溶液中
达到平衡,则溶液中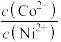
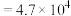
 溶液调节废水的pH至8.0,
溶液调节废水的pH至8.0, 溶液逐滴加入浓度均为
溶液逐滴加入浓度均为 的
的