生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为___________ 。
②0.01 mol·L-1的NH3·H2O的pH=___________ 。
③若上述酸和碱等体积充分混合,混合后所得溶液的pH___________ (填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为___________ 。
(2)甲酸钠(HCOONa)属于_______ (填“强”或“弱”)电解质,HCOONa溶液呈碱性的原因是_________ (用离子方程式表示)。0.01 mol·L-1的HCOONa溶液中c(HCOO-)+c(OH-)-c(H+)=_______ mol·L-1。
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为
②0.01 mol·L-1的NH3·H2O的pH=
③若上述酸和碱等体积充分混合,混合后所得溶液的pH
(2)甲酸钠(HCOONa)属于
21-22高二上·湖南·期中 查看更多[7]
湖南省百所名校大联考2021-2022学年高二上学期期中考试化学试题辽宁省葫芦岛市协作校2021-2022学年高三上学期第二次联考化学试题河北金太阳2021-2022学年高二上学期期中联考化学试题重庆市九校联盟2021-2022学年高二上学期12月联考化学试题陕西省榆林市2021-2022学年高二上学期期末考试化学试题(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)黑龙江省齐齐哈尔市三立高级中学2021-2022学年高二下学期开学考试化学试题
更新时间:2022-01-10 17:41:52
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题
(1)H3PO2是一种精细磷化工产品,是一元中强酸,写出其电离方程式___________ 。
(2)试用离子方程式表示泡沫灭火器的原理:___________ 。
(3)室温,10mLpH=3盐酸和氯化铵溶液中,由水电离出的氢离子浓度分别为___________ mol•L‾1、___________ mol•L‾1。
(4)室温下,0.1mol/L的硫氢化钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是___________ ,其原因是___________ 。已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-15;H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
(5)25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合恰好中和,且已知Va<Vb和a=0.5b,a的取值范围是___________ 。
(1)H3PO2是一种精细磷化工产品,是一元中强酸,写出其电离方程式
(2)试用离子方程式表示泡沫灭火器的原理:
(3)室温,10mLpH=3盐酸和氯化铵溶液中,由水电离出的氢离子浓度分别为
(4)室温下,0.1mol/L的硫氢化钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是
(5)25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合恰好中和,且已知Va<Vb和a=0.5b,a的取值范围是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】根据所学知识,完成以下问题。
(1)短周期中金属性最强的元素与非金属性最强的元素形成的物质的电子式为___ 。
(2)25℃时,将体积Va、pH=13的某一元强碱与体积为Vb、pH=2的某二元强酸混合。所得溶液的pH=11,则Va∶Vb=___ 。
(3)常温下,某浓度的偏铝酸钠溶液pH=10,用离子方程式表示其呈碱性的原因:___ 。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
①0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是___ ;
②常温下NO 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=___ (保留两位有效数字)。
(1)短周期中金属性最强的元素与非金属性最强的元素形成的物质的电子式为
(2)25℃时,将体积Va、pH=13的某一元强碱与体积为Vb、pH=2的某二元强酸混合。所得溶液的pH=11,则Va∶Vb=
(3)常温下,某浓度的偏铝酸钠溶液pH=10,用离子方程式表示其呈碱性的原因:
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
①0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是
②常温下NO
 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】已知水的电离平衡曲线如图示,试回答下列问题:
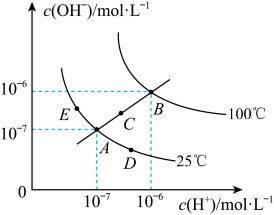
(1)图中A、B、C三点Kw的由小到大的顺序是_____________ 。
(2)若从A点到B点,可采用的措施是___ 。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)E对应的温度下,将pH=13的NaOH溶液与pH=2的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____ 。
(4)B对应温度下,将pH=11的苛性钠溶液V1L与0.05 mol/L的稀硫酸V2L混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=_________________ 。
(5) A对应温度下,将V mL、0.1000 mol·L-1 氢氧化钠溶液逐滴加入到20.00mL、0.1000 mol·L-1醋酸溶液中充分反应。如果溶液pH=7,此时V的取值_______ 20.00(填“>”“<”或“=”)。

(1)图中A、B、C三点Kw的由小到大的顺序是
(2)若从A点到B点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)E对应的温度下,将pH=13的NaOH溶液与pH=2的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(4)B对应温度下,将pH=11的苛性钠溶液V1L与0.05 mol/L的稀硫酸V2L混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=
(5) A对应温度下,将V mL、0.1000 mol·L-1 氢氧化钠溶液逐滴加入到20.00mL、0.1000 mol·L-1醋酸溶液中充分反应。如果溶液pH=7,此时V的取值
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】现有下列几种物质:a.Na2O2b.CH3COOH c.NH4Cld.CO2e. NaOHf.Si。请回答下列问题:
(1)属于共价化合物的是___________ (填写编号,下同);含有非极性共价键的离子化合物是___________ 。
(2)NH4Cl溶于水需要破坏___________ (填写一种作用力名称,下同),干冰升华需要破坏___________ 。
(3)写出 CH3COOH 溶于水的电离方程式___________ 。
(4)试比较 d、e、f 三种晶体的熔点由高到低的顺序:___________ 。(填写编号)
(1)属于共价化合物的是
(2)NH4Cl溶于水需要破坏
(3)写出 CH3COOH 溶于水的电离方程式
(4)试比较 d、e、f 三种晶体的熔点由高到低的顺序:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】化学中,酸的电离平衡常数( )是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):
)是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):
回答下列问题:
(1)T℃下, 的电离平衡常数为
的电离平衡常数为 ,则T
,则T___________ 25℃(选填“>”、“<”或“=”)估算T℃下, 溶液的
溶液的
___________ mol/L;保持温度不变,将该溶液加水稀释至0.01mol/L下列物理量增大的是___________ 。
a. b.
b.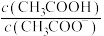 c.
c. d.电离度α
d.电离度α
(2)根据以上数据,写出将少量 气体通入NaClO溶液反应的离子方程式:
气体通入NaClO溶液反应的离子方程式:___________ 。
(3) 是一元酸,其在水中的电离方程式为:
是一元酸,其在水中的电离方程式为: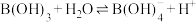 。利用上表中的数据,计算反应
。利用上表中的数据,计算反应 的平衡常数
的平衡常数___________ (列出原始计算式,不计算结果)
(4) 的酸式电离与
的酸式电离与 类似,在水中电离生成
类似,在水中电离生成 ,试写出
,试写出 酸式电离的电离方程式:
酸式电离的电离方程式:___________ 。根据上表中的数据,写出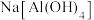 溶液与
溶液与 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
 )是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):
)是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):| 酸 |  |  | HClO |  |  |
 |  | 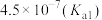 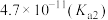 |  | 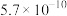 | 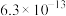 |
(1)T℃下,
 的电离平衡常数为
的电离平衡常数为 ,则T
,则T 溶液的
溶液的
a.
 b.
b.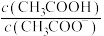 c.
c. d.电离度α
d.电离度α(2)根据以上数据,写出将少量
 气体通入NaClO溶液反应的离子方程式:
气体通入NaClO溶液反应的离子方程式:(3)
 是一元酸,其在水中的电离方程式为:
是一元酸,其在水中的电离方程式为: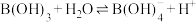 。利用上表中的数据,计算反应
。利用上表中的数据,计算反应 的平衡常数
的平衡常数(4)
 的酸式电离与
的酸式电离与 类似,在水中电离生成
类似,在水中电离生成 ,试写出
,试写出 酸式电离的电离方程式:
酸式电离的电离方程式: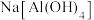 溶液与
溶液与 溶液反应的化学方程式:
溶液反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】正误判断,正确的划“√”,错误的划“×”
1.室温下,稀释0.1 mol·L-1CH3COOH溶液,溶液的导电能力增强。(_______)
2.0.1 L 0.5 mol/L CH3COOH溶液中含有的H+数为0.05NA。(_______)
3. 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH
室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH +2H2O=NH3·H2O+H3O+ 。(_______)
+2H2O=NH3·H2O+H3O+ 。(_______)
4.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度。(_______)
5.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7。(_______)
6.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱。(_______)
1.室温下,稀释0.1 mol·L-1CH3COOH溶液,溶液的导电能力增强。(_______)
2.0.1 L 0.5 mol/L CH3COOH溶液中含有的H+数为0.05NA。(_______)
3.
 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH
室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH +2H2O=NH3·H2O+H3O+ 。(_______)
+2H2O=NH3·H2O+H3O+ 。(_______)4.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度。(_______)
5.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7。(_______)
6.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱。(_______)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知电导率越大溶液导电能力越强。常温下用0.20mol/LNaOH溶液分别滴定10.00mL浓度均为0.20mol/L的盐酸和醋酸溶液,测得滴定过程中溶液的导电率如图所示(忽略滴定过程中溶液混合后的体积变化)。回答下列问题:

(1)表示滴定醋酸的曲线是___________ (填①或②),滴定醋酸的过程选择的指示剂最好为___________ 。
(2)a、b两点溶液中水的电离程度大小关系是a___________ b(填“>”、“<”或“=”)。
(3)常温下,向上述醋酸溶液中滴加10.00mL浓度为0.20mol/L的NaOH溶液,恰好中和,溶液pH=9,则醋酸的电离常数Ka=___________ 。
(4)b点溶液中:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(5)几种弱酸的电离平衡常数如下表所示:
①向次氯酸钠溶液中通入少量的 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
②向次氯酸钠溶液中通入足量的 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
③向碳酸钠溶液中加入足量的亚硫酸氢钠,发生反应的离子方程式为___________ 。

(1)表示滴定醋酸的曲线是
(2)a、b两点溶液中水的电离程度大小关系是a
(3)常温下,向上述醋酸溶液中滴加10.00mL浓度为0.20mol/L的NaOH溶液,恰好中和,溶液pH=9,则醋酸的电离常数Ka=
(4)b点溶液中:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(5)几种弱酸的电离平衡常数如下表所示:
| 弱酸 |  |  | HClO |
| 电离平衡常数(25℃) | 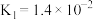 |  |  |
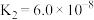 |  |
 ,发生反应的离子方程式为
,发生反应的离子方程式为②向次氯酸钠溶液中通入足量的
 ,发生反应的离子方程式为
,发生反应的离子方程式为③向碳酸钠溶液中加入足量的亚硫酸氢钠,发生反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】运用相关原理,回答下列各小题:
(1)某H2SO4溶液的浓度是0.005 mol·L-1。
①此溶液的pH为_______ ;
②用水稀释到原来体积的100倍,pH为________ ;
③再继续稀释106倍,pH为________ 。
(2)室温下,某水溶液中存在的离子有Na+、A-、H+、 OH-。根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH____ 7( 填大小关系)。
②若溶液pH>7,则c(Na+)________ c(A-), 理由是________ 。
③若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法中正确的是____ (填选项代号)。
A.若反应后溶液呈中性,则c(H+)+c(OH- )=2×10-7 mol·L-1
B.若V1=V2反应后溶液的pH 一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(1)某H2SO4溶液的浓度是0.005 mol·L-1。
①此溶液的pH为
②用水稀释到原来体积的100倍,pH为
③再继续稀释106倍,pH为
(2)室温下,某水溶液中存在的离子有Na+、A-、H+、 OH-。根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH
②若溶液pH>7,则c(Na+)
③若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法中正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH- )=2×10-7 mol·L-1
B.若V1=V2反应后溶液的pH 一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】判断正误,正确的打“√”,错误的写出正确的关系式。
(1)0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c( )+c(
)+c( )+c(OH-)。
)+c(OH-)。_______
(2)在Na2SO3溶液中:c(Na+)=2c(SO )+c(
)+c( )+c(OH-)。
)+c(OH-)。_______
(3)0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+2c(S2-)。_______
(4)Na2CO3和NaOH的混合溶液中:c(Na+)+c(H+)=c( )+2c(
)+2c( )+c(OH-)。
)+c(OH-)。_______
(5)室温下,0.1 mol·L-1 NH4Fe(SO4)2溶液中存在:c(OH-)>c(H+)。_______
(1)0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(
 )+c(
)+c( )+c(OH-)。
)+c(OH-)。(2)在Na2SO3溶液中:c(Na+)=2c(SO
 )+c(
)+c( )+c(OH-)。
)+c(OH-)。(3)0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+2c(S2-)。
(4)Na2CO3和NaOH的混合溶液中:c(Na+)+c(H+)=c(
 )+2c(
)+2c( )+c(OH-)。
)+c(OH-)。(5)室温下,0.1 mol·L-1 NH4Fe(SO4)2溶液中存在:c(OH-)>c(H+)。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是____________ (填序号)。
(2)④的水解平衡常数Kh=_________ 。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____ ④(填“>”、“<"、“=”)
(4)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:______________________ 。
| HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是
(2)④的水解平衡常数Kh=
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③
(4)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】弱酸的电离平衡常数与对应酸根的水解平衡常数存在某种定量关系。
(1)NO2可用氨水吸收生成NH4NO3。25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是_____________________________________ (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度________ mol·L-1 (NH3·H2O的电离平衡常数取Kb=2×10-5)。
(2)已知常温下CN-的水解常数Kh=1.61×10-5,含等物质的量浓度HCN与NaCN的混合溶液显________ (填“酸”“碱”或“中”)性,c(CN-)________ (填“>”“<”或“=”)c(HCN)。溶液中各离子浓度由大到小的顺序为_______________________ 。
(1)NO2可用氨水吸收生成NH4NO3。25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是
(2)已知常温下CN-的水解常数Kh=1.61×10-5,含等物质的量浓度HCN与NaCN的混合溶液显
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】在室温下,下列三种溶液:①0.1 NH4Cl溶液②0.1
NH4Cl溶液②0.1 CH3COONH4溶液③0.1
CH3COONH4溶液③0.1 NH4HSO4溶液,请根据要求填写下列空白:
NH4HSO4溶液,请根据要求填写下列空白:
(1)溶液①呈___________ (填“酸”“碱”或“中”)性,其原因是___________ (用离子方程式表示)。
(2)溶液②③中 的大小关系是②
的大小关系是②___________ ③(填“>”“<”或“=”)。
(3)室温下,测得溶液②的pH=7,则说明 的水解程度
的水解程度___________ (填“>”“<”或“=”,下同) 的水解程度,
的水解程度, 与
与 浓度的大小关系是
浓度的大小关系是
___________  。
。
 NH4Cl溶液②0.1
NH4Cl溶液②0.1 CH3COONH4溶液③0.1
CH3COONH4溶液③0.1 NH4HSO4溶液,请根据要求填写下列空白:
NH4HSO4溶液,请根据要求填写下列空白:(1)溶液①呈
(2)溶液②③中
 的大小关系是②
的大小关系是②(3)室温下,测得溶液②的pH=7,则说明
 的水解程度
的水解程度 的水解程度,
的水解程度, 与
与 浓度的大小关系是
浓度的大小关系是
 。
。
您最近一年使用:0次



