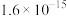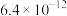用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,A12O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:

已知:PbCl2难溶于冷水,易溶于热水:PbC12(S)+2Cl-(aq) PbCl
PbCl (aq) △H>0
(aq) △H>0

(1)Mn元素在周期表中位于___________ 区。
(2)“浸取”过程中 MnO2和 PbS 反应生成浅黄色固体,写出有关的化学方程式:___________ 。
(3)除杂。上述酸浸液中 Mn2+的浓度为 1.6 mol·L-1,加 MnCO3调节 pH,使酸浸液中 Fe3+、Al3+完全沉淀(离子浓度小于 10-5 mol·L-1)与 Mn2+分离,调节溶液 pH 范围为___________ (不考虑体积的变化)。已知:Ksp[Fe(OH)3]=1.0×10-38,Ksp[Al(OH)3]=1.0×10-32,Ksp[Mn(OH)2]=1.6×10-13
(4)“趁热抽滤”的目的是___________ 。
(5)制备 Mn3O4。将滤液 X 水浴加热并保持 50 ℃,用氨水调节溶液 pH并维持在 8.5 左右,在不断搅拌下边通空气边加氨水,直至有大量沉淀生成,过滤洗涤,真空干燥得到产品 Mn3O4。如果 pH 控制不当会导致有碱式锰盐生成。
①写出制备 Mn3O4的化学方程式___________ 。
②pH 在 7.5-8.5 间,pH 值越低时 Mn3O4产品纯度越低的原因___________ 。

已知:PbCl2难溶于冷水,易溶于热水:PbC12(S)+2Cl-(aq)
 PbCl
PbCl (aq) △H>0
(aq) △H>0
(1)Mn元素在周期表中位于
(2)“浸取”过程中 MnO2和 PbS 反应生成浅黄色固体,写出有关的化学方程式:
(3)除杂。上述酸浸液中 Mn2+的浓度为 1.6 mol·L-1,加 MnCO3调节 pH,使酸浸液中 Fe3+、Al3+完全沉淀(离子浓度小于 10-5 mol·L-1)与 Mn2+分离,调节溶液 pH 范围为
(4)“趁热抽滤”的目的是
(5)制备 Mn3O4。将滤液 X 水浴加热并保持 50 ℃,用氨水调节溶液 pH并维持在 8.5 左右,在不断搅拌下边通空气边加氨水,直至有大量沉淀生成,过滤洗涤,真空干燥得到产品 Mn3O4。如果 pH 控制不当会导致有碱式锰盐生成。
①写出制备 Mn3O4的化学方程式
②pH 在 7.5-8.5 间,pH 值越低时 Mn3O4产品纯度越低的原因
更新时间:2022-02-16 20:13:31
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】研究小组用氯气氧化K2MnO4制备KMnO4 (加热装置已省略),并利用产品进行实验探究。

(1)实验过程中装置连接顺序为_______ ,装置C的作用为_______ 。
(2)加热反应一段时间,观察到装置B中溶液由墨绿色变成紫红色后关闭分液漏斗活塞,停止加热,将KMnO4溶液减压过滤后,倒入蒸发皿中水浴蒸发浓缩、抽滤即得紫红色KMnO4固体。
①装置A中最合适的反应温度为80℃,需要采取的实验方法是_______ 。
②停止加热后,拆卸装置前应采取的实验操作为_______ 。
(3)小组用提纯后的KMnO4配成溶液与H2C2O4反应,探究H2C2O4浓度对反应速率的影响。利用下列试剂完成实验设计。提供试剂:蒸馏水,0.01 mol∙L-1 KMnO4溶液、0.2 mol∙L-1 H2C2O4溶液、0.5 mol∙L-1 H2SO4溶液
①实验中t1<t2,则a=_______ ,b=_______ 。
②在实验中Ⅰ、Ⅱ中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后逐渐加快。某同学查阅得知,存在如下反应历程

反应一段时间后褪色速度突然加快的原因为_______ ,历程中生成CO2的离子反应方程式为_______ 。
(4)取a g实验制得的KMnO4固体溶于水,加入过量的饱和Ba(OH)2溶液(KMnO4不参与反应)沉降 ,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为
,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为_______ (用含a、b的代数式表示)。[已知: ,
, ]
]

(1)实验过程中装置连接顺序为
(2)加热反应一段时间,观察到装置B中溶液由墨绿色变成紫红色后关闭分液漏斗活塞,停止加热,将KMnO4溶液减压过滤后,倒入蒸发皿中水浴蒸发浓缩、抽滤即得紫红色KMnO4固体。
①装置A中最合适的反应温度为80℃,需要采取的实验方法是
②停止加热后,拆卸装置前应采取的实验操作为
(3)小组用提纯后的KMnO4配成溶液与H2C2O4反应,探究H2C2O4浓度对反应速率的影响。利用下列试剂完成实验设计。提供试剂:蒸馏水,0.01 mol∙L-1 KMnO4溶液、0.2 mol∙L-1 H2C2O4溶液、0.5 mol∙L-1 H2SO4溶液
| 编号 | 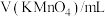 |  | 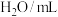 | 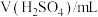 | 褪色时间/s |
| Ⅰ | 5.0 | 5.0 | 3 | 2 |  |
| Ⅱ | 5.0 | a | b | 2 |  |
②在实验中Ⅰ、Ⅱ中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后逐渐加快。某同学查阅得知,存在如下反应历程

反应一段时间后褪色速度突然加快的原因为
(4)取a g实验制得的KMnO4固体溶于水,加入过量的饱和Ba(OH)2溶液(KMnO4不参与反应)沉降
 ,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为
,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为 ,
, ]
]
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入 、
、 、
、 的混合酸性溶液中反应回收S,其物质转化如图所示。
的混合酸性溶液中反应回收S,其物质转化如图所示。
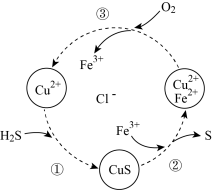
(1)用合适的化学用语表示硫化氢溶于水显弱酸性的原因:_______ ;过程① 吸收
吸收 生成CuS沉淀,溶液的酸性
生成CuS沉淀,溶液的酸性_______ (选填:“增强”或“减弱”或“不变”)。
(2)①在图示过程②中:被氧化的元素是:_______ ;
②在图示过程③中: 转化为
转化为 ,写出反应的离子方程式
,写出反应的离子方程式_______ 。
③写出反应①、②、③的总反应的化学方程式:_______ 。(条件略)
(3)某兴趣小组为探究 和
和 的性质,将两种气体同时通入水中,实验装置如图:
的性质,将两种气体同时通入水中,实验装置如图:
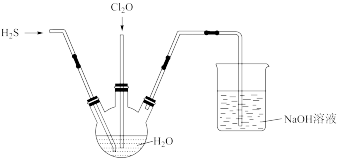
①三颈瓶中出现淡黄色沉淀,溶液呈强酸性,写出与上述现象相关的产物的化学式,依次为:_______ 、_______ 。
② 易溶于水并生成次氯酸,当通入的
易溶于水并生成次氯酸,当通入的 过量,用玻璃棒蘸取三颈瓶中的液体点到淀粉-KI试纸上,将看到的现象是:
过量,用玻璃棒蘸取三颈瓶中的液体点到淀粉-KI试纸上,将看到的现象是:_______ 。
③写出足量的NaOH溶液吸收 气体的化学方程式:
气体的化学方程式:_______ 。
 和空气的混合气体通入
和空气的混合气体通入 、
、 、
、 的混合酸性溶液中反应回收S,其物质转化如图所示。
的混合酸性溶液中反应回收S,其物质转化如图所示。
(1)用合适的化学用语表示硫化氢溶于水显弱酸性的原因:
 吸收
吸收 生成CuS沉淀,溶液的酸性
生成CuS沉淀,溶液的酸性(2)①在图示过程②中:被氧化的元素是:
②在图示过程③中:
 转化为
转化为 ,写出反应的离子方程式
,写出反应的离子方程式③写出反应①、②、③的总反应的化学方程式:
(3)某兴趣小组为探究
 和
和 的性质,将两种气体同时通入水中,实验装置如图:
的性质,将两种气体同时通入水中,实验装置如图:
①三颈瓶中出现淡黄色沉淀,溶液呈强酸性,写出与上述现象相关的产物的化学式,依次为:
②
 易溶于水并生成次氯酸,当通入的
易溶于水并生成次氯酸,当通入的 过量,用玻璃棒蘸取三颈瓶中的液体点到淀粉-KI试纸上,将看到的现象是:
过量,用玻璃棒蘸取三颈瓶中的液体点到淀粉-KI试纸上,将看到的现象是:③写出足量的NaOH溶液吸收
 气体的化学方程式:
气体的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】由黄铜矿(主要成分为CuFeS2)通过过量的硫酸铁溶液浸取制备铜和硫酸亚铁晶体的流程如下,试回答下列问题:

(1)滤渣Ⅰ的主要成分为硫单质,则浸取过程中反应的离子方程式为__________________ ;该反应中产生16 g硫单质时转移的电子的物质的量为__________ 。
(2)滤渣Ⅱ的主要成分为_________________ 。
(3)通过如下装置,将滤液Ⅰ加入到阴极室可以制取铜单质,电解的初期阶段未见铜生成,此阶段阴极对应的电极反应式为_____________________ ;该过程中阳极室硫酸浓度变大的原因是______________________________________________________ 。

(4)滤液Ⅱ能否直接蒸发浓缩制取硫酸亚铁晶体,判断并说明理由:____________________________ 。
(5)高温灼烧FeSO4·7H2O晶体,最终得到红棕色固体粉末,同时得到两种酸性气体和水蒸气,则硫酸亚铁晶体分解的化学方程式为_____________________________ 。
(6)向硫酸亚铁和硫酸铜的混合溶液中加入Na2S溶液,当同时有FeS和CuS沉淀产生时,溶液中c(Fe2+)/c(Cu2+)=_________________________ 。[已知Ksp(FeS)=6.0×10−18;Ksp(CuS)=1.5×10−36]

(1)滤渣Ⅰ的主要成分为硫单质,则浸取过程中反应的离子方程式为
(2)滤渣Ⅱ的主要成分为
(3)通过如下装置,将滤液Ⅰ加入到阴极室可以制取铜单质,电解的初期阶段未见铜生成,此阶段阴极对应的电极反应式为

(4)滤液Ⅱ能否直接蒸发浓缩制取硫酸亚铁晶体,判断并说明理由:
(5)高温灼烧FeSO4·7H2O晶体,最终得到红棕色固体粉末,同时得到两种酸性气体和水蒸气,则硫酸亚铁晶体分解的化学方程式为
(6)向硫酸亚铁和硫酸铜的混合溶液中加入Na2S溶液,当同时有FeS和CuS沉淀产生时,溶液中c(Fe2+)/c(Cu2+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】钨是熔点最高的金属,是重要的战略物资。自然界中黑钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P的化合物。由黑钨矿冶炼钨的工艺流程如下图:
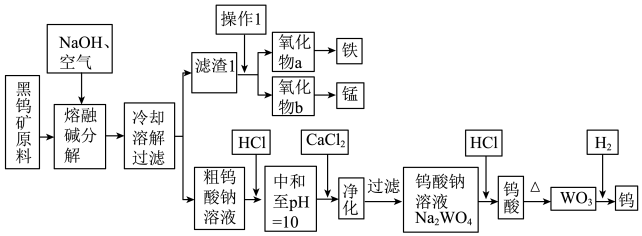
已知:
①滤渣1的主要成分是Fe3O4、MnO2。
②上述流程中,除最后一步外,其余步骤钨的化合价未变。
③常温下,钨酸难溶于水,钨酸钙(CaWO4)微溶于水。
回答下列问题:
⑴钨酸盐(FeWO4、MnWO4)中钨元素的化合价为________ ,为了加快黑钨矿在空气中熔融碱分解速率,可以采取_____________ 措施(写出其中一种即可)。
⑵请写出FeWO4在熔融条件下发生碱分解反应生成Fe3O4的化学方程式_________________________ 。
⑶操作1是工业上分离矿石的一种物理方法,此方法是_____________________________ 。上述流程中向粗钨酸钠溶液中加HCl调pH = 10后,溶液中的杂质阴离子为SiO32-、PO43-等,则“净化”过程中,加CaCl2的作用是____________________________________________ 。
⑷磷有两种同素异形体白磷和红磷,白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成Cu3P(Cu为+1价),反应方程式如下 未配平
未配平 。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为
。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为________ 。
CuSO4 + P4 + H2O = Cu3P + H2SO4+ H3PO4(未配平)

已知:
①滤渣1的主要成分是Fe3O4、MnO2。
②上述流程中,除最后一步外,其余步骤钨的化合价未变。
③常温下,钨酸难溶于水,钨酸钙(CaWO4)微溶于水。
回答下列问题:
⑴钨酸盐(FeWO4、MnWO4)中钨元素的化合价为
⑵请写出FeWO4在熔融条件下发生碱分解反应生成Fe3O4的化学方程式
⑶操作1是工业上分离矿石的一种物理方法,此方法是
⑷磷有两种同素异形体白磷和红磷,白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成Cu3P(Cu为+1价),反应方程式如下
 未配平
未配平 。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为
。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为CuSO4 + P4 + H2O = Cu3P + H2SO4+ H3PO4(未配平)
您最近一年使用:0次
【推荐2】一种从工业锌置换渣(主要含 等)中回收锗、铅的工艺流程如图:
等)中回收锗、铅的工艺流程如图: 能溶于强酸的浓溶液或强碱溶液;
能溶于强酸的浓溶液或强碱溶液; 可溶于热盐酸中:
可溶于热盐酸中: ;常温下,
;常温下,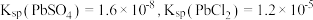 。
。
(1)“还原浸出”时, 的存在可促进
的存在可促进 浸出。
浸出。
① 的空间结构为
的空间结构为___________ 。
②该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)“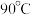 酸浸”所用盐酸的浓度不宜过大或过小,浓度不宜过大的主要原因是
酸浸”所用盐酸的浓度不宜过大或过小,浓度不宜过大的主要原因是___________ 。
(3)“碱溶”时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)“降温析铅”过程中,体系温度冷却至常温,且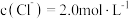 。为防止
。为防止 中混有
中混有 杂质,应控制溶液中
杂质,应控制溶液中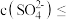
___________ 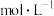 (保留两位有效数字)。
(保留两位有效数字)。
(5)“转化”的意义在于可重复利用___________ (填物质名称)。
(6)通过掺杂硅可将锗单质转化为不同掺杂比例的硅锗合金,锗及硅锗合金的立方晶胞如图所示。 周围与其最近的
周围与其最近的 的个数为
的个数为___________ 。
②若硅锗合金i的晶胞边长为 ,设
,设 为阿伏加德罗常数的值,则硅锗合金i晶体的密度为
为阿伏加德罗常数的值,则硅锗合金i晶体的密度为___________  (列计算式)。
(列计算式)。
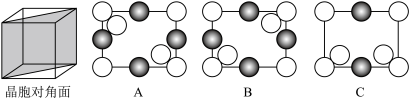
③硅锗合金ii沿晶胞对角面取得的截图为___________ (填标号)。
 等)中回收锗、铅的工艺流程如图:
等)中回收锗、铅的工艺流程如图: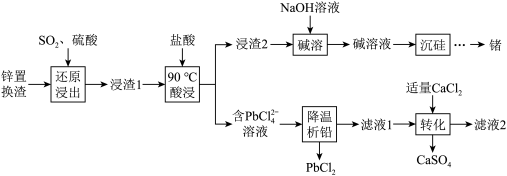
 能溶于强酸的浓溶液或强碱溶液;
能溶于强酸的浓溶液或强碱溶液; 可溶于热盐酸中:
可溶于热盐酸中: ;常温下,
;常温下,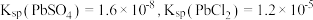 。
。(1)“还原浸出”时,
 的存在可促进
的存在可促进 浸出。
浸出。①
 的空间结构为
的空间结构为②该反应中氧化剂与还原剂的物质的量之比为
(2)“
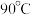 酸浸”所用盐酸的浓度不宜过大或过小,浓度不宜过大的主要原因是
酸浸”所用盐酸的浓度不宜过大或过小,浓度不宜过大的主要原因是(3)“碱溶”时,
 发生反应的离子方程式为
发生反应的离子方程式为(4)“降温析铅”过程中,体系温度冷却至常温,且
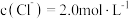 。为防止
。为防止 中混有
中混有 杂质,应控制溶液中
杂质,应控制溶液中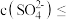
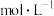 (保留两位有效数字)。
(保留两位有效数字)。(5)“转化”的意义在于可重复利用
(6)通过掺杂硅可将锗单质转化为不同掺杂比例的硅锗合金,锗及硅锗合金的立方晶胞如图所示。
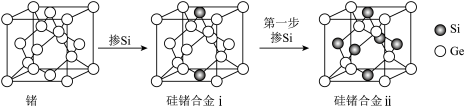
 周围与其最近的
周围与其最近的 的个数为
的个数为②若硅锗合金i的晶胞边长为
 ,设
,设 为阿伏加德罗常数的值,则硅锗合金i晶体的密度为
为阿伏加德罗常数的值,则硅锗合金i晶体的密度为 (列计算式)。
(列计算式)。③硅锗合金ii沿晶胞对角面取得的截图为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以低品位铜钴矿(主要成分为 、
、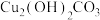 、
、 ,还有少量的FeO、
,还有少量的FeO、 、CaO、MgO等杂质)为原料制备硫酸铜晶体和
、CaO、MgO等杂质)为原料制备硫酸铜晶体和 的一种工艺流程如下:
的一种工艺流程如下:
②萃取时发生反应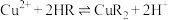
(1)铜钴矿浸出前要预先粉碎,其目的是______ 。
(2)浸出步骤铜钴矿中的 转化为
转化为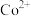 ,该反应的离子方程式为
,该反应的离子方程式为______ 。
(3)加入试剂a______ 可使萃取剂再生。
(4)对于过程I:
①加 溶液作用是
溶液作用是______ 。
②通过计算判断 是否沉淀完全并简述理由
是否沉淀完全并简述理由______ 。(一般认为溶液中离子浓度小于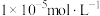 时沉淀完全)
时沉淀完全)
(5)滤渣1成分______ 。
(6) 在足量空气中煅烧生成
在足量空气中煅烧生成 ,写出煅烧过程中的化学反应方程式
,写出煅烧过程中的化学反应方程式______ 。
(7)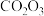 产品纯度测定方法如下:
产品纯度测定方法如下: 与EDTA-2Na按物质的量1:1反应,若滴定至终点时消耗EDTA-2Na标准液体积为20.00mL,则
与EDTA-2Na按物质的量1:1反应,若滴定至终点时消耗EDTA-2Na标准液体积为20.00mL,则 产品纯度为
产品纯度为______ 。( 的摩尔质量是
的摩尔质量是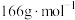 )
)
 、
、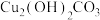 、
、 ,还有少量的FeO、
,还有少量的FeO、 、CaO、MgO等杂质)为原料制备硫酸铜晶体和
、CaO、MgO等杂质)为原料制备硫酸铜晶体和 的一种工艺流程如下:
的一种工艺流程如下: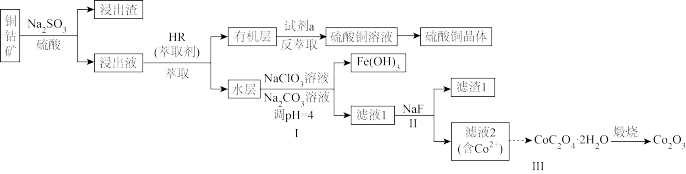
物质 |
|
|
|
|
|
|
|
|
|
|
|
|
|
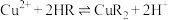
(1)铜钴矿浸出前要预先粉碎,其目的是
(2)浸出步骤铜钴矿中的
 转化为
转化为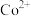 ,该反应的离子方程式为
,该反应的离子方程式为(3)加入试剂a
(4)对于过程I:
①加
 溶液作用是
溶液作用是②通过计算判断
 是否沉淀完全并简述理由
是否沉淀完全并简述理由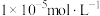 时沉淀完全)
时沉淀完全)(5)滤渣1成分
(6)
 在足量空气中煅烧生成
在足量空气中煅烧生成 ,写出煅烧过程中的化学反应方程式
,写出煅烧过程中的化学反应方程式(7)
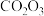 产品纯度测定方法如下:
产品纯度测定方法如下: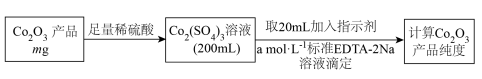
 与EDTA-2Na按物质的量1:1反应,若滴定至终点时消耗EDTA-2Na标准液体积为20.00mL,则
与EDTA-2Na按物质的量1:1反应,若滴定至终点时消耗EDTA-2Na标准液体积为20.00mL,则 产品纯度为
产品纯度为 的摩尔质量是
的摩尔质量是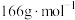 )
)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】Ba(NO3)2常用于军事上生产绿色信号弹、曳光弹等。某生产BaCO3的化工厂生产排出大量的钡泥(主要含有BaCO3、BaSO3、Ba(FeO2)2等,该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),部分工艺流程如下:
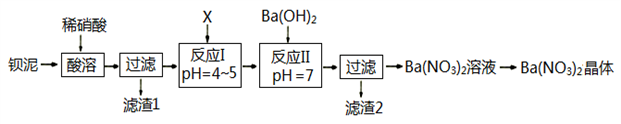
已知:pH=3.2时,可使Fe3+沉淀完全;
请回答下列问题:
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌、过滤、洗涤。试用离子方程式 说明提纯原理:______________________________ 。
(2)酸溶时,Ba(FeO2)2与HNO3反应的化学方程式为_______________________________ 。
(3)该厂结合本厂实际,化合物X最好 选用_________
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.BaCO3
(4)滤渣1和滤渣2洗涤产生的废液不能直接排入环境,原因是_______________________ 。
(5)①反应I需调节溶液pH值范围在4~5,目的是________________________________ 。
②验证该步骤中沉淀已完全的实验操作是_____________________________________ 。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为_____________ 。(提示:M(Ba(NO3)2)= 261 g/mol,M(BaSO4)= 233 g/mol)

已知:pH=3.2时,可使Fe3+沉淀完全;
请回答下列问题:
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌、过滤、洗涤。试用
(2)酸溶时,Ba(FeO2)2与HNO3反应的化学方程式为
(3)该厂结合本厂实际,化合物X
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.BaCO3
(4)滤渣1和滤渣2洗涤产生的废液不能直接排入环境,原因是
(5)①反应I需调节溶液pH值范围在4~5,目的是
②验证该步骤中沉淀已完全的实验操作是
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:反应Ⅰ中所有金属元素均以离子形式存在。有关常数:Ksp[Al(OH)3]=1.0×10-33、Ksp[Fe(OH)3]=3.0×10-39、Ksp[Mn(OH)2]=2.0×10-13、Ksp[Zn(OH)2]=1.0×10-17、Ksp(MnCO3)=2.0×10-11、Ka1(H2CO3)=4.0×10-7、Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式____________________________ 。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是___________ 。
(3)反应Ⅲ中MnO2的作用是_______________________ ,若反应后溶液中Mn2+、Zn2+均为0.1mol·L-1,需调节溶液pH范围为_______________ (溶液中,当一种离子的浓度小于10-6mol/L时可认为已不存在),X可以是_________ 。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式________________________ 。本工艺可以循环利用的物质有MnO2、Zn和_________ 。
(5)MnCO3有多种用途。废水处理领域中常用NH4HCO3溶液将Mn2+转化为MnCO3,该反应的离子方程式为______ 。试通过题述有关数据简要计算说明该反应能进行的原因:____________________________ 。

已知:反应Ⅰ中所有金属元素均以离子形式存在。有关常数:Ksp[Al(OH)3]=1.0×10-33、Ksp[Fe(OH)3]=3.0×10-39、Ksp[Mn(OH)2]=2.0×10-13、Ksp[Zn(OH)2]=1.0×10-17、Ksp(MnCO3)=2.0×10-11、Ka1(H2CO3)=4.0×10-7、Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是
(3)反应Ⅲ中MnO2的作用是
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式
(5)MnCO3有多种用途。废水处理领域中常用NH4HCO3溶液将Mn2+转化为MnCO3,该反应的离子方程式为
您最近一年使用:0次
【推荐3】钛酸钡被誉为“电子陶瓷工业的支柱”。工业制取方法如图,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O],煅烧后可获得钛酸钡粉体。
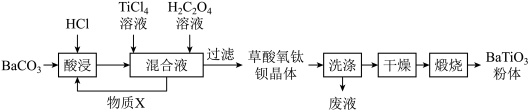
(1)酸浸时发生的反应的离子方程式为___ 。
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是___ 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为___ 。可循环使用的物质X是___ (填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:___ 。
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气态产物有CO、___ 。
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.59×10-9,请问至少需要___ mol•L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。

(1)酸浸时发生的反应的离子方程式为
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是
(3)加入H2C2O4溶液时,发生反应的化学方程式为
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气态产物有CO、
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.59×10-9,请问至少需要
您最近一年使用:0次