回答下列问题:
(1)化学反应中伴随着能量变化。下列属于吸热反应的是____ (填序号)。
a.燃烧CO b.C与CO2反应
c.铝和稀盐酸反应 d.液态水变为水蒸气
(2)氨气中氢含量高,是一种优良的小分子储氢载体,且胺全、易储运。
相关化学键的键能数据
则:①2NH3(g) N2(g)+3H2(g) △H=
N2(g)+3H2(g) △H=____ kJ·mol-1。
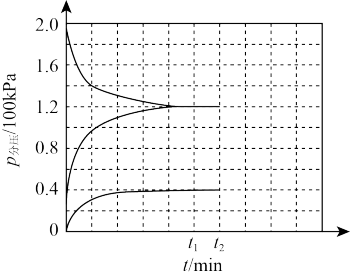
②某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。在该温度下,用分压表示的平衡常数Kp=___ 。(已知:分压=总压×该组分物质的量分数)
(3)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1
b)CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
c)CH4(g) C(s)+2H2(g) △H3
C(s)+2H2(g) △H3
d)2CO(g) CO2(g)+C(s) △H4
CO2(g)+C(s) △H4
e)CO(g)+H2(g) H2O(g)+C(s) △H5
H2O(g)+C(s) △H5
①根据盖斯定律,反应a的△H1=___ (写出一个代数式即可)。
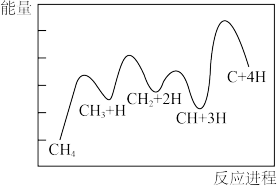
②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___ 步进行,其中,第___ 步的正反应活化能最大。
③某学生应用平衡原理对b)CO2(g)+H2(g) CO(g)+H2O(g) △H2>0的反应进行研究。向一恒温恒容的密闭容器中充入1 mol CO2和2 mol H2发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
CO(g)+H2O(g) △H2>0的反应进行研究。向一恒温恒容的密闭容器中充入1 mol CO2和2 mol H2发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是___ (填字母)。
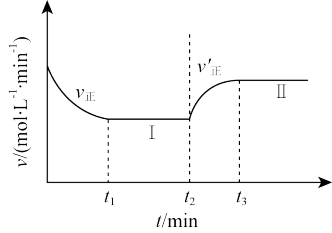
A.容器内压强不变,表明反应达到平衡
B.t2时改变的条件:向容器中加入CO或加入H2O(g)
C.t2时若升高温度或增大压强,均有利于提高CO2的转化率
D.平衡常数K:K(Ⅱ)<K(Ⅰ)
(1)化学反应中伴随着能量变化。下列属于吸热反应的是
a.燃烧CO b.C与CO2反应
c.铝和稀盐酸反应 d.液态水变为水蒸气
(2)氨气中氢含量高,是一种优良的小分子储氢载体,且胺全、易储运。
相关化学键的键能数据
| 化学键 | N≡N | H—H | N—H |
| 键能E/(kJ·mol-1) | 946 | 436.0 | 390.8 |
则:①2NH3(g)
 N2(g)+3H2(g) △H=
N2(g)+3H2(g) △H=②某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。在该温度下,用分压表示的平衡常数Kp=

(3)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1b)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2c)CH4(g)
 C(s)+2H2(g) △H3
C(s)+2H2(g) △H3d)2CO(g)
 CO2(g)+C(s) △H4
CO2(g)+C(s) △H4e)CO(g)+H2(g)
 H2O(g)+C(s) △H5
H2O(g)+C(s) △H5①根据盖斯定律,反应a的△H1=
②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

③某学生应用平衡原理对b)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2>0的反应进行研究。向一恒温恒容的密闭容器中充入1 mol CO2和2 mol H2发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
CO(g)+H2O(g) △H2>0的反应进行研究。向一恒温恒容的密闭容器中充入1 mol CO2和2 mol H2发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B.t2时改变的条件:向容器中加入CO或加入H2O(g)
C.t2时若升高温度或增大压强,均有利于提高CO2的转化率
D.平衡常数K:K(Ⅱ)<K(Ⅰ)
更新时间:2022-03-05 13:59:28
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】随着科技的进步,合理利用资源保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:
则该反应的△H=___________ kJ·mol-1
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为:CO(g)+2H2(g) ⇌CH3 OH(g) △H<O
在一定条件下,将1 mol CO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH2OH的体积分数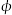 (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:
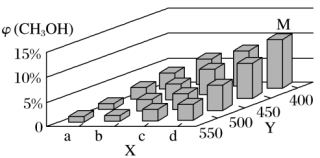
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___________ 。
②某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________ 。
(3)合成甲醇所需的氢气,工业上常从一种合成气(主要成分为CO2、H2)中分离。H2提纯过程示意图如下:

①吸收池中发生反应的离子方程式是___________ 。
②用电极反应式和离子方程式表示K2CO3溶液的再生原理___________ 。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
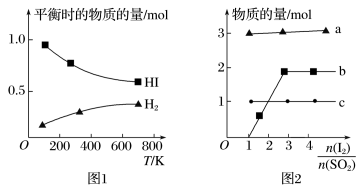
①反应H2(g)+I2(g)⇌ 2HI(g)的△H=___________ 0(填“大于”或“小于”)。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-⇌I3-,图2中曲线b代表的微粒是___________ (填微粒符号),由图2可知,要提高碘的还原率,除控制温度外,还可以采取的措施是___________ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为:CO(g)+2H2(g) ⇌CH3 OH(g) △H<O
在一定条件下,将1 mol CO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH2OH的体积分数
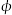 (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②某同学认为上图中Y轴表示温度,你认为他判断的理由是
(3)合成甲醇所需的氢气,工业上常从一种合成气(主要成分为CO2、H2)中分离。H2提纯过程示意图如下:

①吸收池中发生反应的离子方程式是
②用电极反应式和离子方程式表示K2CO3溶液的再生原理
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)⇌ 2HI(g)的△H=
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-⇌I3-,图2中曲线b代表的微粒是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】现代社会的一切活动都离不开能量,化学反应发生物质变化的同时伴随着能量的变化,是人类获取能量的重要途径。回答下列问题:
(1)汽车尾气中NO生成过程的能量变化如图所示。1 mol 和1 mol
和1 mol  完全反应生成NO会
完全反应生成NO会___________ (填“吸收”或“放出”)___________ kJ能量。
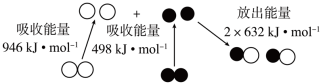
1 mol (g)和1 mol
(g)和1 mol  (g)反应生成2 mol NO(g)过程中的能量变化
(g)反应生成2 mol NO(g)过程中的能量变化
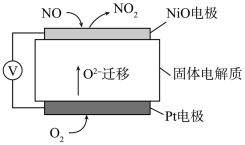
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示, 可在固体电解质中自由移动。则NiO电极上发生的是
可在固体电解质中自由移动。则NiO电极上发生的是___________ (填“氧化”或“还原”)反应;Pt电极上的电极反应式为___________ 。
(3)一种新型催化剂能使NO和CO发生反应: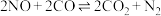 。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
①表中a=___________ ;能验证温度对化学反应速率影响规律的是___________ (填实验编号)。
②实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线___________ (填“甲”或“乙”)

(1)汽车尾气中NO生成过程的能量变化如图所示。1 mol
 和1 mol
和1 mol  完全反应生成NO会
完全反应生成NO会
1 mol
 (g)和1 mol
(g)和1 mol  (g)反应生成2 mol NO(g)过程中的能量变化
(g)反应生成2 mol NO(g)过程中的能量变化(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示,
 可在固体电解质中自由移动。则NiO电极上发生的是
可在固体电解质中自由移动。则NiO电极上发生的是
(3)一种新型催化剂能使NO和CO发生反应:
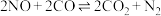 。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。| 实验编号 | T/℃ | NO初始浓度( ) ) | CO初始浓度( ) ) | 催化剂的比表面积(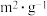 ) ) |
| Ⅰ | 280 | 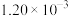 |  | 82 |
| Ⅱ | 280 | 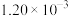 |  | 124 |
| Ⅲ | 350 | a |  | 82 |
①表中a=
②实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

您最近一年使用:0次
【推荐3】雾䨣已经成为部分城市发展的障碍。雾䨪形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有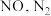 与
与 生成
生成 的过程如下:
的过程如下:
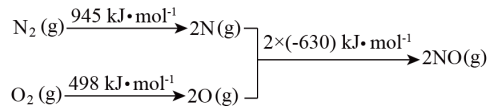
① 与
与 的总能量比
的总能量比 的总能量
的总能量_______ (填“高”或“低”)。
②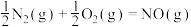 的
的
_______ 。
③ 与
与 反应的热化学方程式可以表示为
反应的热化学方程式可以表示为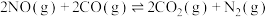 ;
; ,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的
,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的 与
与 转化成无害物质排出。上述反应在使用“催化转化器”后,
转化成无害物质排出。上述反应在使用“催化转化器”后, 值
值_______ (填“增大”、“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气: 。如图是该反应的能量变化图:
。如图是该反应的能量变化图:
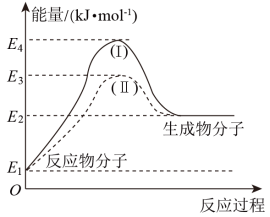
①通过图中信息可判断反应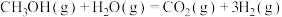 的
的
_______ (填“>”、“=”或“<”)0。
②图中途径(Ⅱ)的条件是_______ ,途径(Ⅰ)的反应热_______ (填“>”、“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
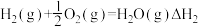
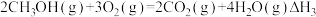
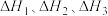 三者的关系式为:
三者的关系式为:_______ 。
(1)汽车尾气中含有
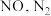 与
与 生成
生成 的过程如下:
的过程如下: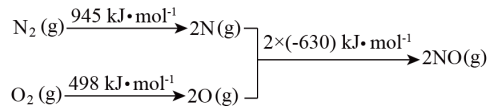
①
 与
与 的总能量比
的总能量比 的总能量
的总能量②
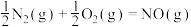 的
的
③
 与
与 反应的热化学方程式可以表示为
反应的热化学方程式可以表示为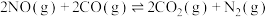 ;
; ,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的
,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的 与
与 转化成无害物质排出。上述反应在使用“催化转化器”后,
转化成无害物质排出。上述反应在使用“催化转化器”后, 值
值(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:
 。如图是该反应的能量变化图:
。如图是该反应的能量变化图:
①通过图中信息可判断反应
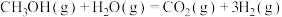 的
的
②图中途径(Ⅱ)的条件是
③已知下列两个热化学方程式:
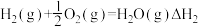
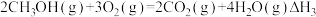
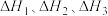 三者的关系式为:
三者的关系式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】工业合成氨的反应为N2(g)+3H2(g)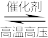 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为__________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?_______________ 。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是________ mol/(L·min),氢气的转化率为________ 。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________ 。
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡________ (填正向,逆向,不)移动,正反应速率将________ (增大,减小,不变)。
 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:(1)若1 mol氮气完全反应生成氨气可放出的能量为
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】过氧化钙晶体(CaO2⋅8H2O,微溶于水,不溶于乙醇、乙醚)是重要的化学品,常用作杀菌剂、防腐剂、化妆品的添加剂等。实验室以石灰石(含有少量铁、硅的氧化物)为原料制备CaO2的实验流程如下:
(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、 溶液沉钙等步骤。
溶液沉钙等步骤。
①“调pH除铁”后,需用如图所示的热抽滤装置除去 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是___________ 。 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为___________ 。
(2)“制备”过程所用装置如下图所示:___________ ,若用乙装置制备NH3,,写出反应的化学方程式:___________ 。
②仪器X的名称为___________ 。
③“制备” 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是___________ 。生成 的离子方程式为
的离子方程式为___________ ;CaCl2与H2O2直接反应不易发生,制备时加入适量氨水有利于CaO2生成,其原因可能是___________ 。
(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。

(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、
 溶液沉钙等步骤。
溶液沉钙等步骤。①“调pH除铁”后,需用如图所示的热抽滤装置除去
 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是
 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为(2)“制备”过程所用装置如下图所示:

②仪器X的名称为
③“制备”
 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是 的离子方程式为
的离子方程式为(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。
| A.滴定时应一直观察滴定管中溶液体积的变化 |
| B.当滴入半滴酸性KMnO4溶液后,溶液颜色从无色刚好变为浅红色,且半分钟内不变色,表示已经到达滴定终点 |
| C.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测定结果偏小 |
| D.读取KMnO4溶液体积时,滴定前俯视读数,滴定后仰视读数,则测定结果偏大 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】将产能过剩的乙酸在特定催化剂作用下和氢气反应生成乙醇,其反应原理如下:CH3COOH(g)+2H2(g)⇌CH3CH2OH(g)+H2O(g) △H1
已知:298k和100kPa时物质的燃烧热:
1.根据以上燃烧热,计算该反应在298k和100kPa的△H1时,需补充_______ 。
A.水的汽化热 B.乙酸、乙醇和水的汽化热 C.反应物的汽化热
2.一定温度下,将不同量的原料通入恒压密闭容器中,测出平衡时的热量变化
则,该温度下,△H1=_______kJ·mol–1。
3.该反应在_______能向正反应方向自发进行。
4.250℃,恒压绝热密闭容器中充入一定量CH3COOH和H2,下列条件能判断反应达到平衡状态的是_______。
上述反应发生时还伴随有副反应发生,生成少量乙酸乙酯:CH3COOH(g)+CH3CH2OH(g)⇌CH3COOCH2CH3(g)+H2O(g) △H2<0
已知:①该副反应的热效应很小;
②S表示产物选择性,乙醇、乙酸乙酯选择性表示为:
S(乙醇)= ;S(乙酸乙酯)=
;S(乙酸乙酯)=
当nH2(g):n(CH3COOH)=10:1时,下图表示2Mpa,平衡时S(乙醇)、S(乙酸乙酯)随温度的变化以及250℃,平衡时S(乙醇)、S(乙酸乙酯)随压强的变化:_______ 。
A.a B.c C.d
6.曲线b是S(乙醇)随温度变化的曲线,解释b的变化趋势。_______ 。
7.150℃,在催化剂作用下,H2和CH3COOH反应一段时间后,S(乙醇)位于m点,不改变反应时间和温度,一定能提高S(乙醇)的措施是_______ 。(任写一条)
8.一定温度和压强下,向初始体积为1L的密闭容器中通入2molH2(g)和1molCH3COOH(g),同时发生主反应和副反应,测定平衡时n[H2O(g)]=0.8mol,体积减小20%,则平衡时n(CH3COOH)=_______ mol、c(H2)=_______ mol·L–1。主反应的平衡常数K=_______ 。
已知:298k和100kPa时物质的燃烧热:
| 物质 | CH3COOH(l) | H2(g) | CH3CH2OH(l) |
| 燃烧热/kJ·mol–1 | –871 | –286 | –1367 |
A.水的汽化热 B.乙酸、乙醇和水的汽化热 C.反应物的汽化热
2.一定温度下,将不同量的原料通入恒压密闭容器中,测出平衡时的热量变化
| 实验编号 | 反应物投入量 | 平衡时, 热量变化 | |||
| CH3CH2OH(g) | H2(g) | CH3CH2OH(g) | H2O(g) | ||
| I | 1mol | 2mol | 0 | 0 | 放热xkJ |
| II | 0 | 0 | 1mol | 1mol | 吸收ykJ |
| A.x+y | B.x-y | C.-(x+y) | D.y-x |
| A.任何温度下 | B.较低温度下 | C.较高温度下 | D.无法确定 |
| A.混合气体的密度保持不变 | B.v(H2)正:v(H2O)正=2:1 |
| C.n(CH3COOH):n(H2)=1:2 | D.反应体系的温度保持不变 |
上述反应发生时还伴随有副反应发生,生成少量乙酸乙酯:CH3COOH(g)+CH3CH2OH(g)⇌CH3COOCH2CH3(g)+H2O(g) △H2<0
已知:①该副反应的热效应很小;
②S表示产物选择性,乙醇、乙酸乙酯选择性表示为:
S(乙醇)=
 ;S(乙酸乙酯)=
;S(乙酸乙酯)=
当nH2(g):n(CH3COOH)=10:1时,下图表示2Mpa,平衡时S(乙醇)、S(乙酸乙酯)随温度的变化以及250℃,平衡时S(乙醇)、S(乙酸乙酯)随压强的变化:

A.a B.c C.d
6.曲线b是S(乙醇)随温度变化的曲线,解释b的变化趋势。
7.150℃,在催化剂作用下,H2和CH3COOH反应一段时间后,S(乙醇)位于m点,不改变反应时间和温度,一定能提高S(乙醇)的措施是
8.一定温度和压强下,向初始体积为1L的密闭容器中通入2molH2(g)和1molCH3COOH(g),同时发生主反应和副反应,测定平衡时n[H2O(g)]=0.8mol,体积减小20%,则平衡时n(CH3COOH)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】NOx、CO、SO2等大气污染气体的处理和利用是世界各国研究的热点问题。
(1)已知:
I.
II. 2NO(g)+O2(g) 2NO2(g) ΔH1
2NO2(g) ΔH1
2SO2(g)+O2(g) 2SO3(g) ΔH2 =-196.6 kJ·mol-1
2SO3(g) ΔH2 =-196.6 kJ·mol-1
① ΔH1 =________________ kJ·mol-1。
② 写出NO2气体与SO2气体反应生成SO3气体和NO气体的热化学方程式________ 。
(2)煤炭燃烧过程中释放出大量的SO2,严重破坏生态环境。燃烧过程中加入石灰石可以把硫元素以CaSO4的形式固定,从而降低SO2的排放,该反应的化学方程式是______ 。
(3)煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。发生的两个相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g) CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
资料:①反应Ⅰ和反应Ⅱ同时发生 ②反应Ⅰ的速率大于反应Ⅱ的速率
请回答下列问题:
① 下列反应过程能量变化示意图正确的是_______________ 。

② 图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有_________ (填字母)。
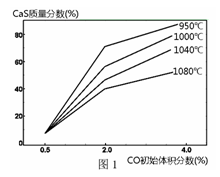
A. 向该反应体系中投入石灰石
B. 在合适的温度区间内控制较低的反应温度
C. 提高CO的初始体积百分数
D. 提高反应体系的温度
③ 图2表示恒温恒容条件下反应体系中c(SO2)随时间t变化的总趋势图。请从化学反应原理的角度解释c(SO2)先增加后降低的原因_______ 。

(1)已知:
I.

II. 2NO(g)+O2(g)
 2NO2(g) ΔH1
2NO2(g) ΔH12SO2(g)+O2(g)
 2SO3(g) ΔH2 =-196.6 kJ·mol-1
2SO3(g) ΔH2 =-196.6 kJ·mol-1① ΔH1 =
② 写出NO2气体与SO2气体反应生成SO3气体和NO气体的热化学方程式
(2)煤炭燃烧过程中释放出大量的SO2,严重破坏生态环境。燃烧过程中加入石灰石可以把硫元素以CaSO4的形式固定,从而降低SO2的排放,该反应的化学方程式是
(3)煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。发生的两个相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1反应Ⅱ:CaSO4(s)+4CO(g)
 CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1
CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1资料:①反应Ⅰ和反应Ⅱ同时发生 ②反应Ⅰ的速率大于反应Ⅱ的速率
请回答下列问题:
① 下列反应过程能量变化示意图正确的是

② 图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有

A. 向该反应体系中投入石灰石
B. 在合适的温度区间内控制较低的反应温度
C. 提高CO的初始体积百分数
D. 提高反应体系的温度
③ 图2表示恒温恒容条件下反应体系中c(SO2)随时间t变化的总趋势图。请从化学反应原理的角度解释c(SO2)先增加后降低的原因

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】CO、H2是重要的工业原料,在高温、催化剂存在的条件下,可用甲烷 和水蒸气为原料制取它:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH0
CO(g)+3H2(g) ΔH0
(1)已知:
① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② CH4(g)+1.5O2(g)=CO(g)+2H2O(g) ΔH2=-564kJ·mol-1。
则ΔH0 =_____ 。
(2)一定温度下,将一定量甲烷与水蒸气的混合气体置于某密闭容器中发生反应 生成 CO、H2,测得反应体系中平衡时的某种量值 X 与温度(T)、压强(P)之间的关系如图 所示:
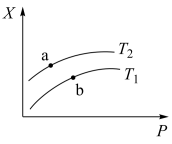
若 X 表示 CH4的百分含量,则 T1_________ T2(填“>”“<”“无法确定”,下同),X 还可 以表示_____ (在下列选项中选填序号),a、b 两点的平衡常数 K(a) ____ K(b)。
A.混合气体的平均摩尔质量 B.CO 的产率 C.ΔH 值
(3)若在 T3时将 4mol H2O(g)与 a mol CH4置于 2L 恒容密闭容器中,测得 CO 的 浓度(mol/L)与时间 t(min)的关系如图 所示。
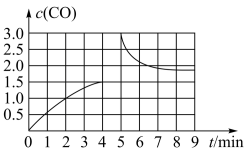
①反应 4min 后达平衡, 反应 4min 内用 H2浓度变化表示的反应速率 v(H2)=__________________
②若在第 5 分钟时改变条件,CO 浓度变化曲线如图 所示,则改变条件可能是____________
(4)从焓变角度上看,反应 CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)_____ (填“具 有”或“不具有”)自发性。
 CO(g)+3H2(g) ΔH0
CO(g)+3H2(g) ΔH0(1)已知:
① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② CH4(g)+1.5O2(g)=CO(g)+2H2O(g) ΔH2=-564kJ·mol-1。
则ΔH0 =
(2)一定温度下,将一定量甲烷与水蒸气的混合气体置于某密闭容器中发生反应 生成 CO、H2,测得反应体系中平衡时的某种量值 X 与温度(T)、压强(P)之间的关系如图 所示:

若 X 表示 CH4的百分含量,则 T1
A.混合气体的平均摩尔质量 B.CO 的产率 C.ΔH 值
(3)若在 T3时将 4mol H2O(g)与 a mol CH4置于 2L 恒容密闭容器中,测得 CO 的 浓度(mol/L)与时间 t(min)的关系如图 所示。

①反应 4min 后达平衡, 反应 4min 内用 H2浓度变化表示的反应速率 v(H2)=
②若在第 5 分钟时改变条件,CO 浓度变化曲线如图 所示,则改变条件可能是
(4)从焓变角度上看,反应 CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氮、碳化合物转化是环境科学研究热点课题之一。“双碳”目标大背景下,采取高效经济方式利用CO2对人类社会发展具有重要意义。
(1)CO2催化加氢可合成乙烯,反应为2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。_______ (用Ka、Kb、Kc表示)。
②表示C2H4体积分数随温度变化的曲线是_______ (填“k”“l”“m”“n”)。
③若d表示240℃时某时刻H2的体积分数,保持温度不变,则反应向_______ (填“正”或“逆”)反应方向进行。
(2)低碳烯烃是基础有机化工原料,工业上可利用合成气间接或直接制取。其间接制取的主要反应方程式如下:
CO(g)+2H2(g)⇌CH3OH(l) ΔH1=-116kJ·mol-1
2CH3OH(l)⇌C2H4(g)+2H2O(l) ΔH2=-35kJ·mol-1
H2O(g)⇌H2O(l) ΔH3=-44kJ·mol-1
①写出用CO(g)和H2(g)直接制取低碳烯烃C2H4(g)和H2O(g)的热化学方程式:_______ 。
②将He、CO和H2以体积比为1∶1∶2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图所示,则p1_______ p2(填“>”“<”或“=”),M点的正反应速率_______ N点的逆反应速率(填“>”“<”或“=”)。在500K,压强为p1的条件下,该反应的Kp=_______ (列出计算式)。
(1)CO2催化加氢可合成乙烯,反应为2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
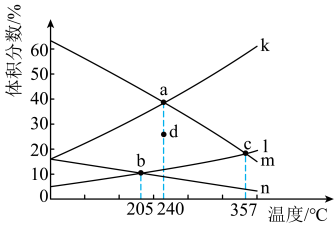
②表示C2H4体积分数随温度变化的曲线是
③若d表示240℃时某时刻H2的体积分数,保持温度不变,则反应向
(2)低碳烯烃是基础有机化工原料,工业上可利用合成气间接或直接制取。其间接制取的主要反应方程式如下:
CO(g)+2H2(g)⇌CH3OH(l) ΔH1=-116kJ·mol-1
2CH3OH(l)⇌C2H4(g)+2H2O(l) ΔH2=-35kJ·mol-1
H2O(g)⇌H2O(l) ΔH3=-44kJ·mol-1
①写出用CO(g)和H2(g)直接制取低碳烯烃C2H4(g)和H2O(g)的热化学方程式:
②将He、CO和H2以体积比为1∶1∶2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图所示,则p1
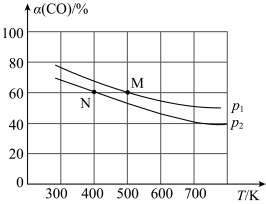
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】在一定体积的密闭容器中,进行如下化学反应:
CO2(g) +H2(g) CO (g) +H2O (g)
CO (g) +H2O (g)
其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________ 。
(2)该反应为________ 反应(填“吸热”“放热”)。
(3)能说明该反应达到化学平衡状态的是________。
(4)某温度下,平衡浓度符合下式: 3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为_____ ℃。
(5)830℃时,在1L密闭容器中分别投入lmolH2和lmolCO2反应达到化学平衡时,CO2的转化率为_________ ;保持温度不变,在平衡体系中再充入1molH2和lmolCO2重新达到化学平衡时,CO2的平衡转化率________ (填“增大”、“减小”或“不变”)
CO2(g) +H2(g)
 CO (g) +H2O (g)
CO (g) +H2O (g)其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)能说明该反应达到化学平衡状态的是________。
| A.容器中压强不变 | B.混合气体中c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
(5)830℃时,在1L密闭容器中分别投入lmolH2和lmolCO2反应达到化学平衡时,CO2的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】油气开采、石油化工、煤化工等行业的废气中均含有硫化氢,需要将其回收处理并加以利用。
Ⅰ.高温热分解法:

(1)升高温度,该反应的化学平衡常数___________ (填“变大”“变小”或“不变”)。
(2)工业上,通常在等温、等压条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会___________ (填“增大”“减小”或“不变”),利用平衡常数与浓度商的关系说明理由:___________ 。
Ⅱ.克劳斯法:
已知:




(3)用克劳斯法处理 ,若生成1mol
,若生成1mol  (g),放出热量
(g),放出热量___________ kJ。
(4)用克劳斯法处理 时,研究人员对反应条件对
时,研究人员对反应条件对 产率的影响进行了如下研究。
产率的影响进行了如下研究。
①其他条件相同时,相同时间内, 产率随温度的变化如图所示。由图可见,随着温度升高,
产率随温度的变化如图所示。由图可见,随着温度升高, 产率先增大后减小,原因是
产率先增大后减小,原因是___________ 。

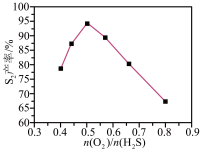
②其他条件相同时,相同时间内, 产率随
产率随 值的变化如图所示。
值的变化如图所示。 过高不利于提高
过高不利于提高 产率,可能的原因是
产率,可能的原因是___________ 。
Ⅰ.高温热分解法:


(1)升高温度,该反应的化学平衡常数
(2)工业上,通常在等温、等压条件下将
 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会Ⅱ.克劳斯法:

已知:




(3)用克劳斯法处理
 ,若生成1mol
,若生成1mol  (g),放出热量
(g),放出热量(4)用克劳斯法处理
 时,研究人员对反应条件对
时,研究人员对反应条件对 产率的影响进行了如下研究。
产率的影响进行了如下研究。①其他条件相同时,相同时间内,
 产率随温度的变化如图所示。由图可见,随着温度升高,
产率随温度的变化如图所示。由图可见,随着温度升高, 产率先增大后减小,原因是
产率先增大后减小,原因是
②其他条件相同时,相同时间内,
 产率随
产率随 值的变化如图所示。
值的变化如图所示。 过高不利于提高
过高不利于提高 产率,可能的原因是
产率,可能的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】Ⅰ.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1。
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1。
①该反应在低温下___ (填“能”或“不能”)自发进行。
②写出该反应的平衡常数表达式:____ 。
Ⅱ.甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。

①A、B两点对应的压强大小关系是pA___ pB(填“>”“<”或“=”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是___ 。
③下列叙述能说明上述反应能达到化学平衡状态的是___ (填字母)。
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(3)在p1压强、T1℃时,该反应的平衡常数K=___ ,再加入1.0molCO后重新到达平衡,则CO的转化率___ (填“增大”“不变”或“减小”)。
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,n(CO):0.1mol、n(H2):0.2mol、n(CH3OH):0.2mol,此时v正___ v逆(填“>”“<”或“=”)。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)
 H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1。
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1。①该反应在低温下
②写出该反应的平衡常数表达式:
Ⅱ.甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应:CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示。
①A、B两点对应的压强大小关系是pA
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(3)在p1压强、T1℃时,该反应的平衡常数K=
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,n(CO):0.1mol、n(H2):0.2mol、n(CH3OH):0.2mol,此时v正
您最近一年使用:0次



