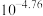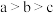如图为某实验测得0.10mol·L-1NaHCO3溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是
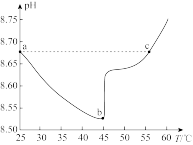

A.ab段,pH减小说明升温促进了HCO 的电离,同时抑制了HCO 的电离,同时抑制了HCO 的水解 的水解 |
| B.b点溶液恰好显中性 |
| C.a点溶液的c(OH-)比c点溶液的小 |
| D.a点时,Kw<Ka1(H2CO3)·Ka2(H2CO3) |
更新时间:2022-04-04 16:15:53
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】下列有关说法正确的是( )
| A.常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小 |
| B.常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| C.在酸碱中和滴定实验中,锥形瓶未用待测液润洗会对实验结果造成影响 |
| D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是


| A.b点溶液pH=5,此时酸碱恰好中和 |
| B.a~b点导电能力增强,说明HR为弱酸 |
| C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) |
| D.b~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】某温度下,向 的蒸馏水中加入
的蒸馏水中加入 晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
 的蒸馏水中加入
的蒸馏水中加入 晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是| A.该温度低于25℃ |
B.该温度下加入等体积 的NaOH溶液可使该溶液恰好呈中性 的NaOH溶液可使该溶液恰好呈中性 |
C.加入 晶体促进了水的电离 晶体促进了水的电离 |
D.由水电离出来的 的浓度是 的浓度是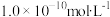 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,下列各组离子一定能在指定溶液中大量共存的是
A.加入铝产生氢气的溶液: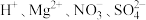 |
B.澄清透明的溶液: |
C.能使甲基橙试液显红色的溶液: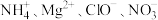 |
D.水电离的 的溶液: 的溶液: |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】室温下,通过下列实验探究 溶液的性质(假设实验前后溶液体积不变)。
溶液的性质(假设实验前后溶液体积不变)。
下列说法正确的是
 溶液的性质(假设实验前后溶液体积不变)。
溶液的性质(假设实验前后溶液体积不变)。| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测定  溶液的pH,测得pH约为5 溶液的pH,测得pH约为5 |
| 2 | 向  溶液中加入 溶液中加入 溶液,产生沉淀 溶液,产生沉淀 |
| 3 | 向  溶液中通入足量的 溶液中通入足量的 ,产生红褐色沉淀 ,产生红褐色沉淀 |
| 4 | 向  溶液中 溶液中 溶液,产生浅黄色沉淀 溶液,产生浅黄色沉淀 |
A.  溶液中存在: 溶液中存在: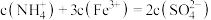 |
B.实验2中沉淀成分仅为 |
C.实验3得到的溶液中有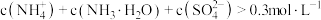 |
D.实验4中发生反应的离子方程式为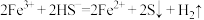 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
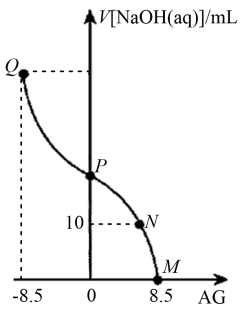
【推荐2】化学上常用 表示溶液中的
表示溶液中的 。25℃时,用
。25℃时,用 的
的 溶液滴定
溶液滴定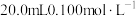 的
的 溶液,
溶液, 与V[NaOH(aq)] (所加
与V[NaOH(aq)] (所加 溶液的体积)的关系如图所示,下列说法错误的是
溶液的体积)的关系如图所示,下列说法错误的是
 表示溶液中的
表示溶液中的 。25℃时,用
。25℃时,用 的
的 溶液滴定
溶液滴定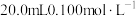 的
的 溶液,
溶液, 与V[NaOH(aq)] (所加
与V[NaOH(aq)] (所加 溶液的体积)的关系如图所示,下列说法错误的是
溶液的体积)的关系如图所示,下列说法错误的是
A.25℃时, 的电离常数 的电离常数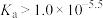 |
B. 点时, 点时,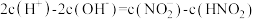 |
C. 点时,加入 点时,加入 溶液的体积大于 溶液的体积大于 |
D. 点时,溶液中 点时,溶液中 的数量级为 的数量级为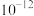 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】水溶液中甘氨酸盐酸盐(HOOCCH2NH2 ·HCl)可看作是二元酸,溶液中存在以下平衡:


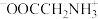 +H+ Ka1
+H+ Ka1
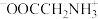
 -OOCCH2NH2+H+ Ka2
-OOCCH2NH2+H+ Ka2
25°C时,用1. 0mol/L NaOH溶液滴定100mL 1. 0mol/L的甘氨酸盐酸盐溶液,滴定曲线变化如图所示。下列说法不正确的是



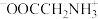 +H+ Ka1
+H+ Ka1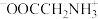
 -OOCCH2NH2+H+ Ka2
-OOCCH2NH2+H+ Ka225°C时,用1. 0mol/L NaOH溶液滴定100mL 1. 0mol/L的甘氨酸盐酸盐溶液,滴定曲线变化如图所示。下列说法不正确的是

| A.Ka1的数量级为10-3 |
| B.水的电离程度: B<C<D |
C.B点时c(  ) =a, D点时c(-OOCCH2NH2 )=b,则a=b ) =a, D点时c(-OOCCH2NH2 )=b,则a=b |
D.pH=7时,溶液中: c(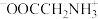 )>c(-OOCCH2NH2)>c( )>c(-OOCCH2NH2)>c( ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】电位滴定法的原理:反应终点被测离子浓度的数量级发生突跃,指示电极电位也发生突跃。室温下,用 的
的 标准溶液滴定相同浓度的
标准溶液滴定相同浓度的 溶液,测得电极电位的变化与滴入
溶液,测得电极电位的变化与滴入 溶液体积的关系如图所示(
溶液体积的关系如图所示( 的
的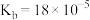 )。
)。
 的
的 标准溶液滴定相同浓度的
标准溶液滴定相同浓度的 溶液,测得电极电位的变化与滴入
溶液,测得电极电位的变化与滴入 溶液体积的关系如图所示(
溶液体积的关系如图所示( 的
的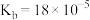 )。
)。
A.a点溶液水电离出的 等于 等于 |
B.b点溶液中的离子浓度大小顺序为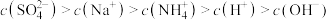 |
C.c点溶液 ,则溶液中粒浓度满足 ,则溶液中粒浓度满足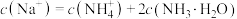 |
D.d点溶液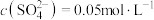 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】对下列溶液的分析,说法不正确 的是
A. 时, 时, 的 的 溶液,升高温度, 溶液,升高温度, 变大 变大 |
B.向 溶液中通 溶液中通 气体,溶液中存在 气体,溶液中存在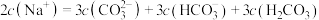 时,溶液中的溶质为等物质的量的 时,溶液中的溶质为等物质的量的 和 和 |
C.等体积等物质的量浓度的 溶液和 溶液和 溶液,后者所含阳离子总数多 溶液,后者所含阳离子总数多 |
D. 时,等 时,等 的 的 溶液和 溶液和 溶液按体积比 溶液按体积比 混合, 混合, 不变 不变 |
您最近一年使用:0次

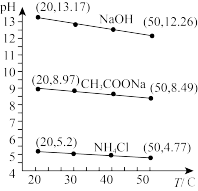
 )+c(Na+)
)+c(Na+)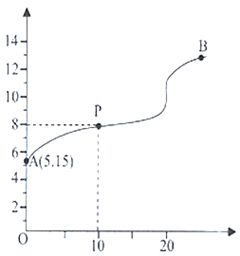
 的
的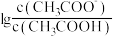 随pH的变化关系如图所示(取
随pH的变化关系如图所示(取 )。
)。