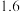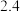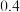氢能是理想的清洁能源,资源丰富。以太阳能为热源分解 ,经由热化学铁氧化合物循环分解水制
,经由热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:

(1)过程Ⅰ: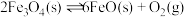
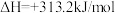
①过程Ⅰ需要将 不断分离出去,目的是
不断分离出去,目的是_______ 。
②一定温度下,在容积可变的密闭容器中,该反应已达到平衡。下列说法正确的是_______ (填字母标号)。
a.容器内气体密度和相对分子质量都不再改变b.升高温度,容器内气体密度变大
c.向容器中通入 ,
, 转化率不变d.缩小容器容积,
转化率不变d.缩小容器容积, 浓度变大
浓度变大
(2)已知 的燃烧热是
的燃烧热是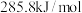 ,则液态水通过过程Ⅱ转化的热化学方程式为
,则液态水通过过程Ⅱ转化的热化学方程式为_______ 。
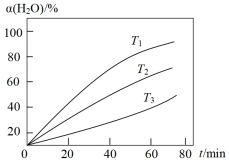
(3)其他条件不变时,过程Ⅱ在不同温度下, 的转化率随时间的变化
的转化率随时间的变化 曲线如图所示,温度
曲线如图所示,温度 、
、 、
、 由大到小的关系是
由大到小的关系是_______ ,判断依据是_______ 。
(4)科研人员研制出透氧膜,它允许电子和 同时透过,可实现水连续分解制
同时透过,可实现水连续分解制 ,工作时
,工作时 、
、 分别在透氧膜两侧反应。工作原理如图所示:
分别在透氧膜两侧反应。工作原理如图所示:
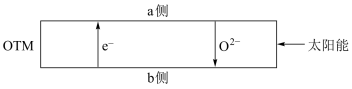
CO在_______ 侧反应(填“a”或“b”),另一侧的电极反应式为_______ 。
 ,经由热化学铁氧化合物循环分解水制
,经由热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
(1)过程Ⅰ:
①过程Ⅰ需要将
 不断分离出去,目的是
不断分离出去,目的是②一定温度下,在容积可变的密闭容器中,该反应已达到平衡。下列说法正确的是
a.容器内气体密度和相对分子质量都不再改变b.升高温度,容器内气体密度变大
c.向容器中通入
 ,
, 转化率不变d.缩小容器容积,
转化率不变d.缩小容器容积, 浓度变大
浓度变大(2)已知
 的燃烧热是
的燃烧热是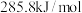 ,则液态水通过过程Ⅱ转化的热化学方程式为
,则液态水通过过程Ⅱ转化的热化学方程式为(3)其他条件不变时,过程Ⅱ在不同温度下,
 的转化率随时间的变化
的转化率随时间的变化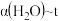 曲线如图所示,温度
曲线如图所示,温度 、
、 、
、 由大到小的关系是
由大到小的关系是
(4)科研人员研制出透氧膜,它允许电子和
 同时透过,可实现水连续分解制
同时透过,可实现水连续分解制 ,工作时
,工作时 、
、 分别在透氧膜两侧反应。工作原理如图所示:
分别在透氧膜两侧反应。工作原理如图所示:
CO在
更新时间:2022-05-25 23:13:55
|
相似题推荐
【推荐1】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)科学家们经过探索实践,建立了如图所示的CO2新循环体系:

根据上图分析,下列相关说法错误的是___________
(2)研究证明,CO2可作为合成甲烷的原料,已知:
①CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH=-41kJ·mol-1
②C(s)+2H2(g)⇌CH4(g) ΔH=-73kJ·mol-1
③2CO(g)⇌C(s)+CO2(g) ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:___________ 。
(3)工业上有一种“降碳”方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在容积为2L密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
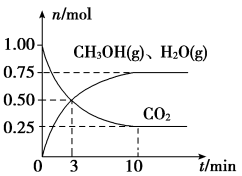
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________ ,平衡时CO2的转化率为___________ ,平衡时甲醇的体积分数=___________ 。
②下列措施可以增大CO2平衡转化率的是___________ 。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.扩大容器的容积
F.将水蒸气从体系中分离
③一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点___________ (填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是___________ 。
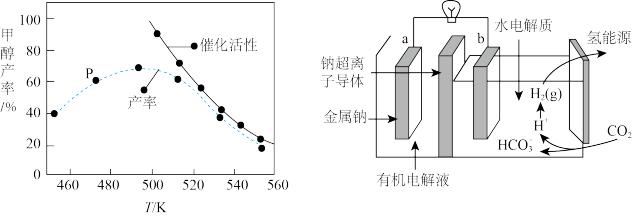
(4)碳排放是影响气候变化的重要因素之一、最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。
①系统工作时,有机电解液___________ (填“能”或“不能”)用含水·电解液替换。
②写出二氧化碳生成氢气的电极反应式___________ 。
(1)科学家们经过探索实践,建立了如图所示的CO2新循环体系:

根据上图分析,下列相关说法错误的是___________
| A.化学变化中质量和能量都是守恒的 |
| B.CO2和H2生成甲烷的反应中原子利用率为100% |
| C.将CO2还原为甲醇能有效促进“碳中和” |
| D.无机物和有机物可以相互转化 |
①CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH=-41kJ·mol-1
②C(s)+2H2(g)⇌CH4(g) ΔH=-73kJ·mol-1
③2CO(g)⇌C(s)+CO2(g) ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(3)工业上有一种“降碳”方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在容积为2L密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施可以增大CO2平衡转化率的是
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.扩大容器的容积
F.将水蒸气从体系中分离
③一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点

(4)碳排放是影响气候变化的重要因素之一、最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。
①系统工作时,有机电解液
②写出二氧化碳生成氢气的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】2020年9月22日,中国向全世界宣布努力争取在2060年实现碳中和。这对于改善环境,实现绿色发展至关重要。碳中和可以简单理解为 的排放总量和减少总量相当。
的排放总量和减少总量相当。 的回收和综合利用成为碳中和重点研究课题。结合所学知识回答下列问题:
的回收和综合利用成为碳中和重点研究课题。结合所学知识回答下列问题:
(1)下列措施有利于大气中 减少的是
减少的是___________ ;
a.植树造林,利用光合作用把 转化为
转化为
b.大力推广使用干冰实现人工增雨,缓解旱情
c.减少化石燃料的使用,从源头上降低 的排放
的排放
(2)研究发现可利用 与
与 制备重要化工原料“合成气”(CO、
制备重要化工原料“合成气”(CO、 ),科学家提出制备“合成气”反应历程分两步:
),科学家提出制备“合成气”反应历程分两步:
反应①: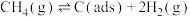 (慢反应)
(慢反应)
反应②: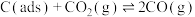 (快反应)
(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

① 与
与 制备“合成气”的热化学方程式
制备“合成气”的热化学方程式___________ ;②能量变化图中:
___________  (填“>”“<”或“=”);
(填“>”“<”或“=”);
(3)利用铜基配合物1,10-phenanthroline-Cu催化剂电催化 还原制备碳基燃料包括CO、烷烃和酸等)是减少
还原制备碳基燃料包括CO、烷烃和酸等)是减少 在大气中累积和实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
在大气中累积和实现可再生能源有效利用的关键手段之一,其装置原理如图所示。

阳极的电极反应式为___________ ,电池工作过程中,若右侧只产生1.5mol HCOOH时,通过质子交换膜的酸性电解质溶液
___________ mol。
 的排放总量和减少总量相当。
的排放总量和减少总量相当。 的回收和综合利用成为碳中和重点研究课题。结合所学知识回答下列问题:
的回收和综合利用成为碳中和重点研究课题。结合所学知识回答下列问题:(1)下列措施有利于大气中
 减少的是
减少的是a.植树造林,利用光合作用把
 转化为
转化为
b.大力推广使用干冰实现人工增雨,缓解旱情
c.减少化石燃料的使用,从源头上降低
 的排放
的排放(2)研究发现可利用
 与
与 制备重要化工原料“合成气”(CO、
制备重要化工原料“合成气”(CO、 ),科学家提出制备“合成气”反应历程分两步:
),科学家提出制备“合成气”反应历程分两步:反应①:
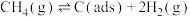 (慢反应)
(慢反应)反应②:
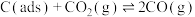 (快反应)
(快反应)上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

①
 与
与 制备“合成气”的热化学方程式
制备“合成气”的热化学方程式
 (填“>”“<”或“=”);
(填“>”“<”或“=”);(3)利用铜基配合物1,10-phenanthroline-Cu催化剂电催化
 还原制备碳基燃料包括CO、烷烃和酸等)是减少
还原制备碳基燃料包括CO、烷烃和酸等)是减少 在大气中累积和实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
在大气中累积和实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
阳极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔHl =-76.0 kJ·mol-1
ⅱ. C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = +113.4 kJ·mol-1
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) ΔH3 =_________ kJ·mol-1。
(2)在反应i中,每放出38.0 kJ热量,有______ g FeO被氧化。
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
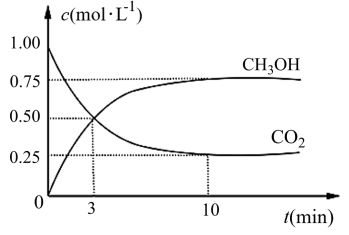
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=________ mol·(L·min) -1。
(4)氢气的转化率=________________________ 。
(5)该反应的平衡常数为__________________________ (保留小数点后2位)。
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
(7)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________ c2的关系(填“>”、“<”或“=”)。
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)将该吸收液蒸干,灼烧至恒重,所得固体的成分是_________ (填化学式)。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔHl =-76.0 kJ·mol-1
ⅱ. C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = +113.4 kJ·mol-1
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) ΔH3 =
(2)在反应i中,每放出38.0 kJ热量,有
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=
(4)氢气的转化率=
(5)该反应的平衡常数为
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.再充入1 mol H2 | D.将H2O(g)从体系中分离出去 |
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)将该吸收液蒸干,灼烧至恒重,所得固体的成分是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0。已知该反应在2404℃时的平衡常数K=6.4×10-3。回答下列问题:
2NO(g) ΔH>0。已知该反应在2404℃时的平衡常数K=6.4×10-3。回答下列问题:
(1)该反应的平衡常数表达式为K=______________________________________ 。
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时N2的转化率是______ %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L、3.0×10-3mol/L,此时反应______________ (填“处于化学平衡状态”“正向进行”或“逆向进行”)。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_________ 。____________ (填“变大”“变小”或“不变”)。
 2NO(g) ΔH>0。已知该反应在2404℃时的平衡常数K=6.4×10-3。回答下列问题:
2NO(g) ΔH>0。已知该反应在2404℃时的平衡常数K=6.4×10-3。回答下列问题:(1)该反应的平衡常数表达式为K=
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时N2的转化率是
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L、3.0×10-3mol/L,此时反应
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0,如图表示反应速率(v)随时间(t)变化关系,则t2、t3时刻外界条件改变依次为
2Z(g);ΔH<0,如图表示反应速率(v)随时间(t)变化关系,则t2、t3时刻外界条件改变依次为_______ 、_______ 。

(2)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
①该反应的平衡常数表达式K=_______ ,△H_______ 0(填“<”“ >”“ =”);
②1200℃时反应C(g)+D(g) A(g)+B(g),则该反应的平衡常数值为
A(g)+B(g),则该反应的平衡常数值为_______ 。
③830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时c(A)=_______ mol·L-1,若反应经一段时间后,达到平衡时A的转化率为_______ ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_______ ;(填“增大”、“减小” “不变”)
(1)某密闭容器中发生如下反应:X(g)+3Y(g)
 2Z(g);ΔH<0,如图表示反应速率(v)随时间(t)变化关系,则t2、t3时刻外界条件改变依次为
2Z(g);ΔH<0,如图表示反应速率(v)随时间(t)变化关系,则t2、t3时刻外界条件改变依次为
(2)已知A(g)+B(g)
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| |温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
①该反应的平衡常数表达式K=
②1200℃时反应C(g)+D(g)
 A(g)+B(g),则该反应的平衡常数值为
A(g)+B(g),则该反应的平衡常数值为③830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时c(A)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】Ⅰ.已知 和
和 之间发生可逆反应:
之间发生可逆反应: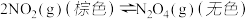 。
。
(1)如图是在一定温度下,某固定容积的密闭容器中充入一定量的 气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是
气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是___________ 。
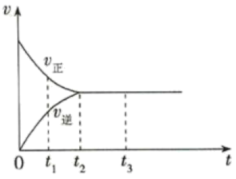
a.t1时,反应未达到平衡, 浓度在减小
浓度在减小
b.t2时,反应达到平衡,反应不再进行
c. ,各物质浓度不再变化
,各物质浓度不再变化
d. ,各物质的浓度相等
,各物质的浓度相等
e. ,
, 浓度增大
浓度增大
f.反应过程中气体的颜色不变
Ⅱ.某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
(2)在上述5组实验中,测定锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间 进行判断,其反应速率最快的实验是___________ (填实验序号)。
(3)对于锌和稀硫酸的反应,实验1和2表明,___________ 对反应速率有影响。
(4)进行实验2时,该小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示。
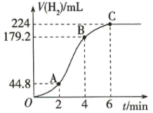
在OA、AB、BC三段中反应速率最快的是___________ ,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=___________ 。
 和
和 之间发生可逆反应:
之间发生可逆反应: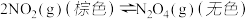 。
。(1)如图是在一定温度下,某固定容积的密闭容器中充入一定量的
 气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是
气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是
a.t1时,反应未达到平衡,
 浓度在减小
浓度在减小b.t2时,反应达到平衡,反应不再进行
c.
 ,各物质浓度不再变化
,各物质浓度不再变化d.
 ,各物质的浓度相等
,各物质的浓度相等e.
 ,
, 浓度增大
浓度增大f.反应过程中气体的颜色不变
Ⅱ.某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
| 实验序号 | 锌的质量/g | 锌的状态 | 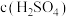 /mol·L-1 /mol·L-1 | 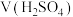 /mL /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴 溶液 溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴 溶液 溶液 |
(3)对于锌和稀硫酸的反应,实验1和2表明,
(4)进行实验2时,该小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示。

在OA、AB、BC三段中反应速率最快的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为 。
。
①该反应在常温下______ (填“能”或“不能”)自发进行。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是_________ (填序号,下同)。
a.容器中的压强不变
b.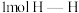 键断裂的同时,断裂
键断裂的同时,断裂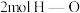 键
键
c.
d.密闭容器的容积不再改变
(2)将不同量的 和
和 分别通入体积为
分别通入体积为 的恒容密闭容器中,进行反应
的恒容密闭容器中,进行反应
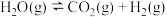 ,得到如下2组数据:
,得到如下2组数据:
①实验1中从反应开始至平衡以 表示的平均反应速率为
表示的平均反应速率为
_______ (取小数点后两位,下同)。
②该反应的正反应为_______ (填“吸”或“放”)热反应,实验2条件下平衡常数
_______ 。
(3)目前工业上有一种方法是用 来生产甲醇一定条件下发生反应:
来生产甲醇一定条件下发生反应: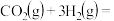
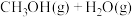 ,如图表示该反应进行过程中能量(单位为
,如图表示该反应进行过程中能量(单位为 )的变化:在体积为
)的变化:在体积为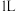 的恒容密闭容器中,充入
的恒容密闭容器中,充入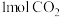 和
和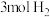 ,达到平衡后下列措施中能使
,达到平衡后下列措施中能使 浓度增大的是
浓度增大的是_______ 。

a.升高温度 b.充入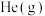 ,使体系压强增大
,使体系压强增大
c.将 从体系中分离出来 d.再充入
从体系中分离出来 d.再充入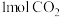 和
和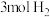
(1)将水蒸气通过红热的炭即可产生水煤气。反应为
 。
。①该反应在常温下
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变
b.
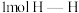 键断裂的同时,断裂
键断裂的同时,断裂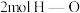 键
键c.

d.密闭容器的容积不再改变
(2)将不同量的
 和
和 分别通入体积为
分别通入体积为 的恒容密闭容器中,进行反应
的恒容密闭容器中,进行反应
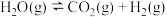 ,得到如下2组数据:
,得到如下2组数据:实验组 | 温度/ | 起始量/mol | 平衡量/mol | 达到平衡所需数据/min | ||
|
|
|
| |||
1 | 650 | 2 | 4 |
|
| 6 |
2 | 900 | 1 | 2 |
|
| 3 |
 表示的平均反应速率为
表示的平均反应速率为
②该反应的正反应为

(3)目前工业上有一种方法是用
 来生产甲醇一定条件下发生反应:
来生产甲醇一定条件下发生反应: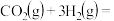
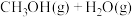 ,如图表示该反应进行过程中能量(单位为
,如图表示该反应进行过程中能量(单位为 )的变化:在体积为
)的变化:在体积为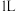 的恒容密闭容器中,充入
的恒容密闭容器中,充入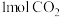 和
和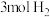 ,达到平衡后下列措施中能使
,达到平衡后下列措施中能使 浓度增大的是
浓度增大的是
a.升高温度 b.充入
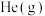 ,使体系压强增大
,使体系压强增大c.将
 从体系中分离出来 d.再充入
从体系中分离出来 d.再充入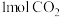 和
和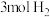
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】请回答下列问题:
(1)用如图所示装置进行如下实验:

①在检查装置的气密性后,向试管a中加入10mL 6mol·L-1的稀HNO3和1g铜片,立即用带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式_______ 、_______ 。
②在实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于_______ ,当反应进行一段时间后速率又逐渐减慢,原因是_______ 。
③欲较快地制得NO,可采取的措施是_______ (填写字母序号)。
a.加热 b.使用铜粉 c.稀释HNO3 d.增大硝酸的浓度
(2)合成CH3OH的一种反应为:CO(g)+2H2(g) CH3OH(g)。一定条件下,将1mol CO和2mol H2在1L容器中发生上述反应,经过2min反应生成了amolCH3OH(反应前后体积不变)。
CH3OH(g)。一定条件下,将1mol CO和2mol H2在1L容器中发生上述反应,经过2min反应生成了amolCH3OH(反应前后体积不变)。
①此时CO的浓度为_______ mol/L。
②2min内用H2表示该反应的速率为v(H2)=_______ mol/(L·min)。
③一定能说明该反应达到平衡的标志是_______ (填写字母序号)。
a.CO、CH3OH的浓度相等 b.2v(CO)=v(H2)
c.混合气体的密度保持不变 d.混合气体的平均摩尔质量不再改变
(1)用如图所示装置进行如下实验:

①在检查装置的气密性后,向试管a中加入10mL 6mol·L-1的稀HNO3和1g铜片,立即用带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式
②在实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于
③欲较快地制得NO,可采取的措施是
a.加热 b.使用铜粉 c.稀释HNO3 d.增大硝酸的浓度
(2)合成CH3OH的一种反应为:CO(g)+2H2(g)
 CH3OH(g)。一定条件下,将1mol CO和2mol H2在1L容器中发生上述反应,经过2min反应生成了amolCH3OH(反应前后体积不变)。
CH3OH(g)。一定条件下,将1mol CO和2mol H2在1L容器中发生上述反应,经过2min反应生成了amolCH3OH(反应前后体积不变)。①此时CO的浓度为
②2min内用H2表示该反应的速率为v(H2)=
③一定能说明该反应达到平衡的标志是
a.CO、CH3OH的浓度相等 b.2v(CO)=v(H2)
c.混合气体的密度保持不变 d.混合气体的平均摩尔质量不再改变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在2L的恒容密闭容器中充入1molCO和2molH2,一定条件下发生反应:
COg2H2g=CH3OHg,测得和 CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。___________ 。平衡时H2的转化率为___________ 。
(2)下列措施能增大反应速率的是___________ (填字母)。
(3)下列描述中能说明上述反应达到平衡状态的是___________。
(4)已知断开 1molCO(g)和 2molH2(g)中的化学键需要吸收的能量为 1924kJ,则断开 1mol CH3OH(g)中的化学键所需要吸收___________ kJ 的能量。
COg2H2g=CH3OHg,测得和 CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。

(2)下列措施能增大反应速率的是___________ (填字母)。
| A.升高温度 | B.降低压强 | C.减小 CH3OH 的浓度 | D.加入合适的催化剂 |
(3)下列描述中能说明上述反应达到平衡状态的是___________。
| A.CO、H2和CH3OH 三种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内消耗 2molH2 的同时生成 1molCH3OH |
(4)已知断开 1molCO(g)和 2molH2(g)中的化学键需要吸收的能量为 1924kJ,则断开 1mol CH3OH(g)中的化学键所需要吸收
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】氯化铍(BeCl2)是一种无色针状或板状晶体,易潮解,易升华。已知氯气、碳和氧化铍高温条件下反应生成氯化铍和一氧化碳,某实验小组利用下图所示装置制备 。请回答下列问题:
。请回答下列问题:

已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
② 熔融可离子化。
熔融可离子化。
(1)装置A中仪器X的名称是___________ ,装置C中的试剂M为___________ (填名称)。
(2)按气流从左到右的方向,上述装置的合理连接顺序为___________ (填仪器接口的小写字母,装置可重复使用),装置A中反应的离子方程式为___________ 。
(3)装置E中反应的化学方程式为___________ ,两仪器连接处使用粗导气管,而不用细导气管的原因是___________ 。
(4)装置B的作用是___________ 。
(5)工业上电解 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为___________ 。
 。请回答下列问题:
。请回答下列问题:
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
②
 熔融可离子化。
熔融可离子化。(1)装置A中仪器X的名称是
(2)按气流从左到右的方向,上述装置的合理连接顺序为
(3)装置E中反应的化学方程式为
(4)装置B的作用是
(5)工业上电解
 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知1到18号元素中的X、Y、Z、W、R五种元素,元素X的一种核素不含中子,Y的最外层电子数是次外层电子数的两倍,Z的最外层电子数比Y多2,W的原子失去1个电子后与 具有相同的电子层结构,R的原子序数为17。回答下列问题:
具有相同的电子层结构,R的原子序数为17。回答下列问题:
(1)元素Y的元素符号__________ ;Z的离子结构示意图__________ 。
(2)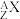 是一种化学用语,用来表示核素。元素X的某核素与不含中子的核素互称同位素,则这种核素可表示为
是一种化学用语,用来表示核素。元素X的某核素与不含中子的核素互称同位素,则这种核素可表示为__________ (任写一种,X用元素符号表示)。
(3)化合物 与
与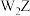 反应的化学方程式
反应的化学方程式____________________ 。
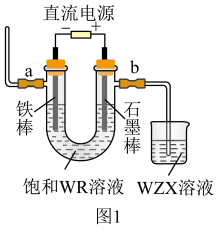
(4)图1为教材中模拟工业制备 的装置,通电后,U型管内发生的反应的化学方程式为(R用相应元素符号表示)
的装置,通电后,U型管内发生的反应的化学方程式为(R用相应元素符号表示)____________________ ,在两电极区分别滴入2滴酚酞溶液,观察到溶液变红现象的是__________ 极区(选填“a”、“b”)。
(5)多种含R元素的化合物因为具有强氧化性,常用于杀菌、消毒、漂白。
① 时,将气体
时,将气体 溶于水形成“
溶于水形成“ (气体)—
(气体)— (水溶液)”体系,体系中
(水溶液)”体系,体系中 (溶液)、
(溶液)、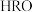 和
和 三者的物质的量分数(
三者的物质的量分数( )随
)随 变化的关系如图2所示。已知
变化的关系如图2所示。已知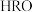 的杀菌能力比
的杀菌能力比 强,用
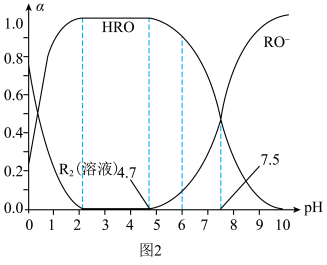
强,用 处理饮用水时,杀菌效果最强的
处理饮用水时,杀菌效果最强的 范围为
范围为__________ (填字母)。
A.0~2 B.2~4.7 C.4.7~7.5 D.7.5~10
②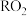 的杀菌效果比
的杀菌效果比 好。常用的制备
好。常用的制备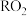 的反应原理可用下面的化学方程式表示,在方程式中标出电子转移的方向和数目:
的反应原理可用下面的化学方程式表示,在方程式中标出电子转移的方向和数目: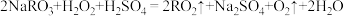
______ ;等物质的量的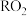 杀菌效果是
杀菌效果是 的
的__________ 倍(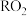 与
与 消毒杀菌后均被还原为
消毒杀菌后均被还原为 ,杀菌效果与单位物质的量的氧化剂得电子的物质的量有关)。
,杀菌效果与单位物质的量的氧化剂得电子的物质的量有关)。
 具有相同的电子层结构,R的原子序数为17。回答下列问题:
具有相同的电子层结构,R的原子序数为17。回答下列问题:(1)元素Y的元素符号
(2)
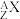 是一种化学用语,用来表示核素。元素X的某核素与不含中子的核素互称同位素,则这种核素可表示为
是一种化学用语,用来表示核素。元素X的某核素与不含中子的核素互称同位素,则这种核素可表示为(3)化合物
 与
与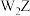 反应的化学方程式
反应的化学方程式(4)图1为教材中模拟工业制备
 的装置,通电后,U型管内发生的反应的化学方程式为(R用相应元素符号表示)
的装置,通电后,U型管内发生的反应的化学方程式为(R用相应元素符号表示)
(5)多种含R元素的化合物因为具有强氧化性,常用于杀菌、消毒、漂白。
①
 时,将气体
时,将气体 溶于水形成“
溶于水形成“ (气体)—
(气体)— (水溶液)”体系,体系中
(水溶液)”体系,体系中 (溶液)、
(溶液)、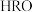 和
和 三者的物质的量分数(
三者的物质的量分数( )随
)随 变化的关系如图2所示。已知
变化的关系如图2所示。已知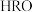 的杀菌能力比
的杀菌能力比 强,用
强,用 处理饮用水时,杀菌效果最强的
处理饮用水时,杀菌效果最强的 范围为
范围为A.0~2 B.2~4.7 C.4.7~7.5 D.7.5~10

②
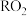 的杀菌效果比
的杀菌效果比 好。常用的制备
好。常用的制备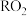 的反应原理可用下面的化学方程式表示,在方程式中标出电子转移的方向和数目:
的反应原理可用下面的化学方程式表示,在方程式中标出电子转移的方向和数目: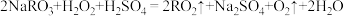
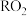 杀菌效果是
杀菌效果是 的
的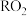 与
与 消毒杀菌后均被还原为
消毒杀菌后均被还原为 ,杀菌效果与单位物质的量的氧化剂得电子的物质的量有关)。
,杀菌效果与单位物质的量的氧化剂得电子的物质的量有关)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:
Ⅰ.
 kJ⋅mol
kJ⋅mol ;
;
Ⅱ.
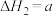 kJ⋅mol
kJ⋅mol ;
;
Ⅲ.
 kJ⋅mol
kJ⋅mol 。
。
(1)
___________ 。
(2)将2.0 mol 和3.0 mol
和3.0 mol  通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得
通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
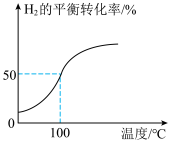
①100℃时反应达到平衡所需的时间为5 min,则反应从起始至5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ ;平衡后向容器中再通入3 mol Ar,平衡___________ (填“正向”“逆向”或“不”)移动。
②100℃时,反应Ⅱ的平衡常数
___________ 。
③若改变条件使平衡常数增大,则从改变条件至再次平衡正反应速率的变化为___________ 。
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除稀硫酸和甲醇这种污染,其原理如下:通电后,将 氧化成
氧化成 ,下图然后以
,下图然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。
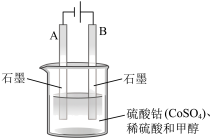
①写出阳极的电极反应式:___________ 。
②写出除去甲醇的离子方程式:___________ 。
 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:Ⅰ.

 kJ⋅mol
kJ⋅mol ;
;Ⅱ.

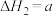 kJ⋅mol
kJ⋅mol ;
;Ⅲ.

 kJ⋅mol
kJ⋅mol 。
。(1)

(2)将2.0 mol
 和3.0 mol
和3.0 mol  通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得
通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
①100℃时反应达到平衡所需的时间为5 min,则反应从起始至5 min内,用
 表示该反应的平均反应速率为
表示该反应的平均反应速率为②100℃时,反应Ⅱ的平衡常数

③若改变条件使平衡常数增大,则从改变条件至再次平衡正反应速率的变化为
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除稀硫酸和甲醇这种污染,其原理如下:通电后,将
 氧化成
氧化成 ,下图然后以
,下图然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。
①写出阳极的电极反应式:
②写出除去甲醇的离子方程式:
您最近一年使用:0次