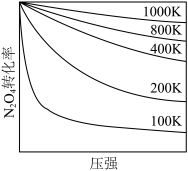
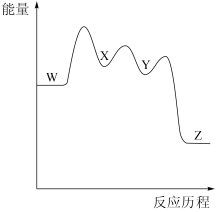
溴丁烷水解的能量变化与反应历程如图所示:
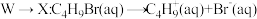
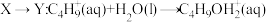
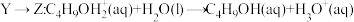
下列说法错误的是

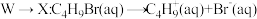
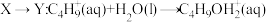
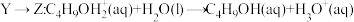
下列说法错误的是
A. 的反应过程为决速步骤 的反应过程为决速步骤 |
B.向体系中加入强碱, 的转化率减小 的转化率减小 |
C.反应 的 的 |
D.向 中加入 中加入 充分反应,产物中有 充分反应,产物中有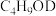 生成 生成 |
更新时间:2022-06-20 16:01:13
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】一定条件下,1-苯基丙炔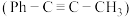 与HCl发生催化加成,反应如下:
与HCl发生催化加成,反应如下:
反应Ⅰ: 产物A:
产物A: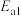 ;
;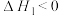
反应Ⅱ: 产物B:
产物B: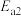 ;
;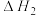
反应Ⅲ: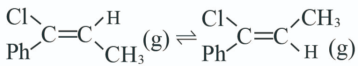 ;
;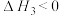
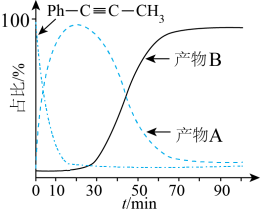
T℃,向密闭容器中通入2molPh-C≡C-CH3(g)和3molHCl(g),平衡时测得Ph-C≡C-CH3(g)的转化率为 ,反应Ⅲ的平衡常数
,反应Ⅲ的平衡常数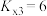 ,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
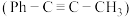 与HCl发生催化加成,反应如下:
与HCl发生催化加成,反应如下:反应Ⅰ:
 产物A:
产物A: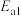 ;
;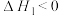
反应Ⅱ:
 产物B:
产物B: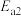 ;
;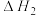
反应Ⅲ:
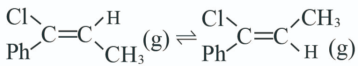 ;
;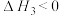
T℃,向密闭容器中通入2molPh-C≡C-CH3(g)和3molHCl(g),平衡时测得Ph-C≡C-CH3(g)的转化率为
 ,反应Ⅲ的平衡常数
,反应Ⅲ的平衡常数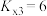 ,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
A.活化能: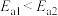 |
B.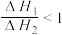 |
C.T℃反应的平衡常数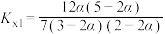 |
| D.若保持温度和压强不变,再向容器中通N2,反应I的化学平衡将逆向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】由金属单质和氯气反应得到 和
和 的能量关系如图所示(M=Ca、Ba)。下列说法不正确的是
的能量关系如图所示(M=Ca、Ba)。下列说法不正确的是
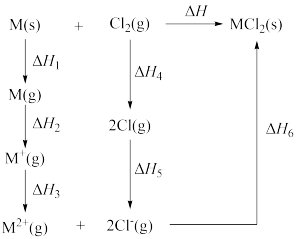
 和
和 的能量关系如图所示(M=Ca、Ba)。下列说法不正确的是
的能量关系如图所示(M=Ca、Ba)。下列说法不正确的是
A.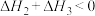 |
B. |
C.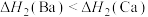 |
D.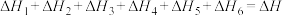 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
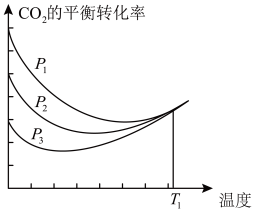
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】科学工作者结合实验与计算机模拟结果,研究了在 催化剂表面上
催化剂表面上 与
与 的反应历程,前三步历程如图所示,其中吸附在
的反应历程,前三步历程如图所示,其中吸附在 催化剂表面上的物种用“·”标注、Ts表示过渡态。
催化剂表面上的物种用“·”标注、Ts表示过渡态。
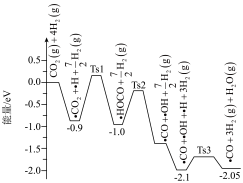
下列有关叙述正确的是
 催化剂表面上
催化剂表面上 与
与 的反应历程,前三步历程如图所示,其中吸附在
的反应历程,前三步历程如图所示,其中吸附在 催化剂表面上的物种用“·”标注、Ts表示过渡态。
催化剂表面上的物种用“·”标注、Ts表示过渡态。
下列有关叙述正确的是
A.前三步总反应的 |
| B.·HOCO转化为·CO和·OH为吸热过程 |
| C.催化剂通过参与化学反应,能降低反应的活化能,也能改变反应热 |
D.历程中活化能(能垒)最小的反应方程式为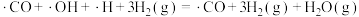 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】一定条件下,1-苯基丙炔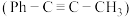 与HCl发生催化加成,反应如下:
与HCl发生催化加成,反应如下:
反应Ⅰ: 产物A:
产物A: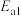 ;
;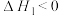
反应Ⅱ: 产物B:
产物B: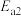 ;
;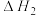
反应Ⅲ: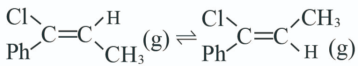 ;
;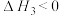
T℃,向密闭容器中通入2molPh-C≡C-CH3(g)和3molHCl(g),平衡时测得Ph-C≡C-CH3(g)的转化率为 ,反应Ⅲ的平衡常数
,反应Ⅲ的平衡常数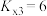 ,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是

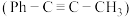 与HCl发生催化加成,反应如下:
与HCl发生催化加成,反应如下:反应Ⅰ:
 产物A:
产物A: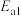 ;
;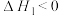
反应Ⅱ:
 产物B:
产物B: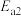 ;
;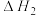
反应Ⅲ:
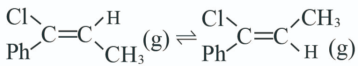 ;
;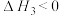
T℃,向密闭容器中通入2molPh-C≡C-CH3(g)和3molHCl(g),平衡时测得Ph-C≡C-CH3(g)的转化率为
 ,反应Ⅲ的平衡常数
,反应Ⅲ的平衡常数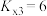 ,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
A.活化能: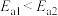 |
B.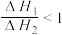 |
C.T℃反应的平衡常数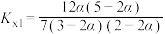 |
| D.若保持温度和压强不变,再向容器中通N2,反应I的化学平衡将逆向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】一定条件下,1-苯基丙炔(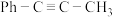 )与HCl发生催化加成,反应如下:
)与HCl发生催化加成,反应如下:
反应Ⅰ:Ph-C≡C-CH3(g)+HCl(g)
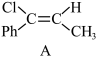 (g)产物A;
(g)产物A;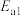 :
:
反应Ⅱ:Ph-C≡C-CH3(g)+HCl(g)
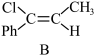 (g)产物B;
(g)产物B; :
:
反应Ⅲ: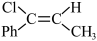 (g)
(g)
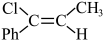 (g);
(g);
T℃,向密闭容器中通入 和3molHCl(g),平衡时测得
和3molHCl(g),平衡时测得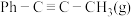 的转化率为α,反应Ⅲ的平衡常数
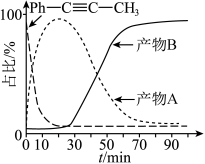
的转化率为α,反应Ⅲ的平衡常数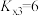 ,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
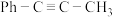 )与HCl发生催化加成,反应如下:
)与HCl发生催化加成,反应如下:反应Ⅰ:Ph-C≡C-CH3(g)+HCl(g)

 (g)产物A;
(g)产物A;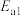 :
:
反应Ⅱ:Ph-C≡C-CH3(g)+HCl(g)

 (g)产物B;
(g)产物B; :
:
反应Ⅲ:
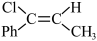 (g)
(g)
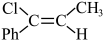 (g);
(g);
T℃,向密闭容器中通入
 和3molHCl(g),平衡时测得
和3molHCl(g),平衡时测得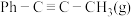 的转化率为α,反应Ⅲ的平衡常数
的转化率为α,反应Ⅲ的平衡常数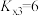 ,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
,反应过程中有机物的物质的量分数随时间变化如图。下列说法错误的是
A.活化能: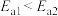 |
B.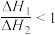 |
C.T℃反应Ⅰ的平衡常数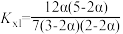 |
D.若保持温度和压强不变,再向容器中通 ,反应Ⅰ的化学平衡将逆向移动 ,反应Ⅰ的化学平衡将逆向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】已知:A(g)+2B(g) 3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
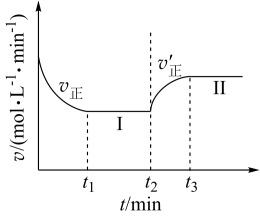
 3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
| A.容器内压强不变,表明反应达到平衡 |
| B.t2时改变的条件:向容器中加入B |
| C.平衡时A的浓度:c(II)>c(I) |
| D.平衡常数K:K(II)<K(I) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】已知:。向体积可变的密闭容器中充入一定量的CH4(g)和O2(g)发生反应,CH4(g)的平衡转化率与温度(T)和压强(p)的关系如下图所示(已知T1>T2)。
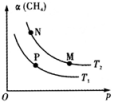
下列说法正确的是

下列说法正确的是
| A.该反应的△H>0 |
| B.M、N两点的H2的物质的量浓度:c(M)>c(N) |
| C.温度不变时,增大压强可由N点到P点 |
| D.N、P两点的平衡常数:K(N)<K(P) |
您最近一年使用:0次