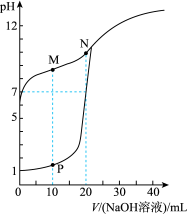
下列叙述错误的是
| A.若反应CN-+HF=HCN+F-可以发生,则可判断Ka(HF)>Ka(HCN) |
B.加水稀释0.1 mol/LCH3COOH溶液,溶液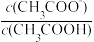 的值增大 的值增大 |
C.相同物质的量浓度的①CH3COONH4②NH4Fe(SO4)2③(NH4)2SO4④(NH4)2CO3四种溶液中c( ):③>④>①>② ):③>④>①>② |
| D.常温下,pH=3的HNO3和pH=12的Ba(OH)2溶液按体积比为9:1混合,所得混合液pH=10 |
更新时间:2022-07-21 08:28:43
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】25℃时将pH= 3的强酸与pH= 12的强碱溶液混合( 忽略混合时溶液体积变化),所得溶液pH=10,则强酸与强碱的体积比是
| A.1:9 | B.9:1 | C.1:11 | D.11:1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在室温下,一列等体积的酸和碱溶液混合后,pH一定大于7的是
| A.pH=3的HNO3与pH=11的KOH溶液 |
| B.pH=3的醋酸与pH=11的KOH溶液 |
| C.pH=3的硫酸与pH=11的NaOH溶液 |
| D.pH=3的盐酸与pH=11的氨水 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】已知:常温下,HCOOH的酸性强于CH3COOH。现将 pH=3,体积均为V0的两种酸溶液分别加水稀释至体积 V,pH 随lg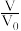 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是

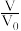 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
| A.溶液中水的电离程度:a>b>c>d |
| B.a 点的两种酸溶液分别与 NaOH 恰好完全中和后,溶液中n(Na+)相同 |
| C.曲线I表示CH3COOH溶液的变化曲线 |
| D.同温下 pH 相同的 NaOH 溶液、CH3COONa 溶液、HCOONa 溶液、NaHCO3溶液的浓度:c(NaOH)<c(NaHCO3)<c(CH3COONa)<c(HCOONa) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】某弱酸溶液中存在电离平衡HA H++A-,下列叙述不正确的是:
H++A-,下列叙述不正确的是:
 H++A-,下列叙述不正确的是:
H++A-,下列叙述不正确的是:| A.溶液中离子浓度的关系满足:c(H+) = c(OH-)+c(A-) |
| B.常温下,加入NaA固体可使HA的电离常数增大 |
| C.HA溶液中加少量的NaA固体,平衡逆向移动 |
| D.0.10mol/L的HA溶液中加水稀释,溶液中c(OH-)增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列关于盐类的水解的说法正确的是
①热的纯碱溶液去除油污的效果好
② 溶液呈酸性的原因是由于溶液中
溶液呈酸性的原因是由于溶液中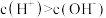
③在显碱性的 溶液中,由水电离的
溶液中,由水电离的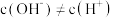
④水电离出的 和
和 与盐电离出的弱酸根离子或弱碱阳离子结合,引起盐溶液呈酸碱性
与盐电离出的弱酸根离子或弱碱阳离子结合,引起盐溶液呈酸碱性
⑤天然弱碱性水呈碱性的原因是其中含有较多的 、
、 等离子
等离子
⑥焊接金属时用浓的 溶液除锈与盐类水解无关
溶液除锈与盐类水解无关
⑦生活中用泡沫灭火器扑灭小型火灾,运用了盐类的水解原理
⑧在滴有酚酞的 溶液中慢慢滴入
溶液中慢慢滴入 溶液,溶液的红色逐渐褪去
溶液,溶液的红色逐渐褪去
①热的纯碱溶液去除油污的效果好
②
 溶液呈酸性的原因是由于溶液中
溶液呈酸性的原因是由于溶液中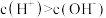
③在显碱性的
 溶液中,由水电离的
溶液中,由水电离的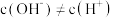
④水电离出的
 和
和 与盐电离出的弱酸根离子或弱碱阳离子结合,引起盐溶液呈酸碱性
与盐电离出的弱酸根离子或弱碱阳离子结合,引起盐溶液呈酸碱性⑤天然弱碱性水呈碱性的原因是其中含有较多的
 、
、 等离子
等离子⑥焊接金属时用浓的
 溶液除锈与盐类水解无关
溶液除锈与盐类水解无关⑦生活中用泡沫灭火器扑灭小型火灾,运用了盐类的水解原理
⑧在滴有酚酞的
 溶液中慢慢滴入
溶液中慢慢滴入 溶液,溶液的红色逐渐褪去
溶液,溶液的红色逐渐褪去| A.①②④⑦⑧ | B.③⑤⑥ | C.②③⑦⑧ | D.①④⑤⑦ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】借助pH传感器测得0.1mol/LNaHCO3溶液在先升温、后降温过程中pH变化如下图所示:

下列有关实验数据的分析中,不合理 的是

下列有关实验数据的分析中,
A.图1中25℃时,溶液中存在关系:c(HCO )> c(H2CO3) > c(CO )> c(H2CO3) > c(CO ) ) |
B.图2中降温过程,溶液pH逐渐增大,可能是HCO 或CO 或CO 水解平衡正移所致 水解平衡正移所致 |
C.图1中45~60℃过程,溶液pH逐渐增大,可能是NaHCO3分解,c(CO )逐渐增大导致的结果 )逐渐增大导致的结果 |
D.图1中25~45℃过程,溶液pH逐渐减小,说明HCO 及水的电离平衡正移对pH影响大于HCO 及水的电离平衡正移对pH影响大于HCO 水解平衡正移对pH的影响 水解平衡正移对pH的影响 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】NA用表示阿伏加 德罗常数的数值,下列说法正确的是
| A.1L 1mol·L-1的氯化铁溶液中,若Cl-的数目为3NA,则Fe3+的数目为NA |
| B.1molN2和3 molH2在一定条件下充分反应,转移电子数目为6NA的 |
| C.将1 mol Cl2通入水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA |
| D.室温下,1LpH=1的CH3COOH溶液中含有0.1NA个H+ |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】苯甲酸(C6H5COOH)是一种有机弱酸,下列说法正确的是
| A.常温下,0.1mol/L的C6H5COONa溶液的pH=13 |
| B.相同温度下,相同浓度的盐酸与苯甲酸溶液的pH:盐酸<苯甲酸溶液 |
| C.中和等体积等物质的量浓度的盐酸与苯甲酸溶液,所需NaOH的量:盐酸>苯甲酸溶液 |
| D.C6H5COONa溶液中存在关系:c(C6H5COO—)=c(Na+)=c(H+)=c(OH—) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】电解质溶液导电能力越强,电导率越大,常温下用0.1000 mol ·L-1NaOH溶液分别滴定10.00 mL浓度均为0.1000 mol ·L-1的盐酸和亚硝酸(HNO2)溶液(已知亚硝酸在常温下pKa= -lgKa=3.3 ,酸性强于乙酸) ,利用传感器测得滴定过程中溶液的电导率如图(1)所示(溶液混合后体积变化忽略不计)。下列说法正确的是


| A.c、d两点溶液中离子总浓度相等 |
B.e点溶液中c( ) +c(HNO2) +c(Na+)=0.2000 mol·L-1 ) +c(HNO2) +c(Na+)=0.2000 mol·L-1 |
| C.a点溶液和d点溶液的混合后溶液的pH <7 |
| D.乙酸、亚硝酸加水稀释时,溶液的电导率变化如图(2)所示,则曲线Ⅰ表示亚硝酸 |
您最近一年使用:0次