合成气是一种重要的化工原料气,主要组分为CO和H2。用甲烷、二氧化碳自热重整可制备合成气,反应原理如下:
反应I:CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
反应II:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
反应III:CH4(g)+H2O(g) CO(g)+3H2(g) △H3=+205.9kJ·mol-1
CO(g)+3H2(g) △H3=+205.9kJ·mol-1
反应IV:CO2(g)+H2(g) CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4
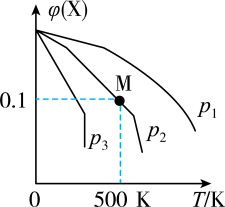
不同温度下,向体积为VL的含少量O2的恒压容器按照n(CO2):n(CH4)=1投料,实验测得不同压强下平衡时 随温度的变化关系如图所示。下列说法正确的是
随温度的变化关系如图所示。下列说法正确的是

反应I:CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1反应II:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
2CO(g)+2H2(g) △H2=+247.1kJ·mol-1反应III:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H3=+205.9kJ·mol-1
CO(g)+3H2(g) △H3=+205.9kJ·mol-1反应IV:CO2(g)+H2(g)
 CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4不同温度下,向体积为VL的含少量O2的恒压容器按照n(CO2):n(CH4)=1投料,实验测得不同压强下平衡时
 随温度的变化关系如图所示。下列说法正确的是
随温度的变化关系如图所示。下列说法正确的是
| A.△H4=-41.2kJ·mol-1 |
| B.某温度下,反应II的平衡常数随压强增大而减小 |
| C.由图可知,p1>p2>p3 |
| D.压强为p2时,T>Tm后,升高温度对反应IV的促进作用更大 |
更新时间:2022-09-26 16:59:40
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】氮肥保障了现代农业的丰收。根据下图的循环过程,有关硫酸铵和氯化铵的说法正确的是
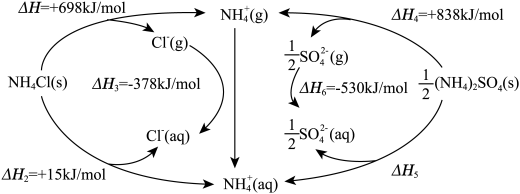

A. |
| B.硫酸铵晶体中只含离子键不含共价键 |
C.氯化铵晶体溶于水的过程: |
D.可以通过 的受热分解实验测得 的受热分解实验测得 的数据 的数据 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】Li2O是离子晶体,从如图的Born−Haber循环可得出Li2O晶格能为
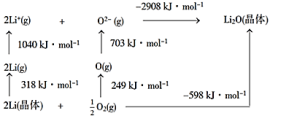

| A.598kJ·mol−1 | B.-598KJ·mol−1 | C.1168kJ·mol−1 | D.2908kJ·mol−1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是
A.已知 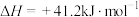 能自发进行,则该反应 能自发进行,则该反应 |
B.反应 用E表示键能,则该反应 用E表示键能,则该反应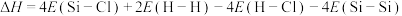 |
C.一定温度下,将 和 和 分别投入1L恒压容器和同体积的恒容容器中,均达平衡后,反应放热前者多(已知: 分别投入1L恒压容器和同体积的恒容容器中,均达平衡后,反应放热前者多(已知:  ) ) |
D.如果反应 , , ,则该反应在任何温度下都可以快速完成 ,则该反应在任何温度下都可以快速完成 |
您最近一年使用:0次
【推荐2】下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 验证压强对化学平衡的影响 | 先将注射器充满 气体,然后将活塞往里推压缩体积 气体,然后将活塞往里推压缩体积 | 侧面观察到注射器内气体颜色加深,证明加压平衡朝生成 气体的方向移动 气体的方向移动 |
| B | 证明苯酚与溴水发生反应 | 向苯酚饱和溶液中滴加少量溴水,充分振荡 | 出现白色沉淀,说明苯酚与溴发生了反应 |
| C | 确定某钠盐的成分 | 向某钠盐中滴加浓盐酸,并将产生的气体通入品红溶液 | 品红溶液褪色,说明该钠盐一定为 或者 或者 |
| D | 比较羟基的活泼性 | 将大小相同的金属钠分别投入到水和乙醇中 | 钠与水反应比钠与乙醇反应剧烈,说明乙醇羟基中氢原子不如水分子中的氢原子活泼 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
【推荐3】一刚性密闭容器内部有一不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充入SO2和O2两种气体,且SO2和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
左室 CO(气)+H2O(气) CO2(气)+H2(气)△H<0
CO2(气)+H2(气)△H<0
右室 2SO2(气)+O2(气) 2SO3(气) △H<0
2SO3(气) △H<0
反应开始时活塞停留在离左端点3/7处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间。下列叙述正确的是
左室 CO(气)+H2O(气)
 CO2(气)+H2(气)△H<0
CO2(气)+H2(气)△H<0 右室 2SO2(气)+O2(气)
 2SO3(气) △H<0
2SO3(气) △H<0反应开始时活塞停留在离左端点3/7处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间。下列叙述正确的是

| A.右室气体反应前后的压强之比为4:3 |
| B.反应达平衡时气体SO2的转化率为75% |
| C.平衡时再向左室中充入与原物质的量之比相同的CO和H2O气体,达平衡时,CO的物质的量分数不变 ,SO2的物质的量分数变大 |
| D.若原容器中左右两室起始时充入的各物质的量均为原来的两倍,达平衡时,活塞相对于中间位置将偏左 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】科学家研究出一种新的催化剂能有效处理汽车尾气,其反应的化学方程式为: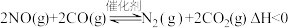 ,若反应在恒容密闭容器中进行,由该反应相关图象作出的判断正确的是
,若反应在恒容密闭容器中进行,由该反应相关图象作出的判断正确的是
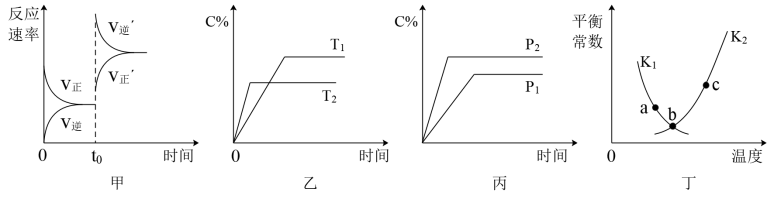
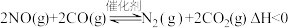 ,若反应在恒容密闭容器中进行,由该反应相关图象作出的判断正确的是
,若反应在恒容密闭容器中进行,由该反应相关图象作出的判断正确的是
| A.甲图中改变的反应条件为升温 |
B.乙图中温度 ,纵坐标可代表NO的百分含量 ,纵坐标可代表NO的百分含量 |
C.丙图中压强 ,纵坐标可代表NO的体积分数 ,纵坐标可代表NO的体积分数 |
| D.丁图中a、b、c三点只有b点已经达到平衡状态 |
您最近一年使用:0次
【推荐2】电石 主要成分为
主要成分为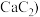 是重要的基本化工原料。已知
是重要的基本化工原料。已知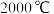 时,电石生产原理如下:
时,电石生产原理如下:
 平衡常数
平衡常数
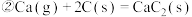
 平衡常数
平衡常数
以下说法不正确的是( )
 主要成分为
主要成分为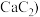 是重要的基本化工原料。已知
是重要的基本化工原料。已知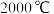 时,电石生产原理如下:
时,电石生产原理如下:  平衡常数
平衡常数
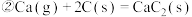
 平衡常数
平衡常数
以下说法不正确的是( )
A.反应 |
B.反应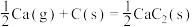 平衡常数 平衡常数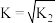 |
C.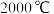 时增大压强, 时增大压强, 减小、 减小、 增大 增大 |
D.反应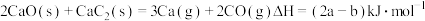 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】某可逆反应a A(g)+bB(g)  cC(g),在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量n与时间t的关系曲线如下图所示。
cC(g),在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量n与时间t的关系曲线如下图所示。
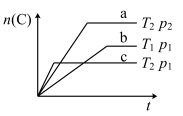
据图分析,以下正确的是
 cC(g),在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量n与时间t的关系曲线如下图所示。
cC(g),在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量n与时间t的关系曲线如下图所示。
据图分析,以下正确的是
| A.c>a+b,正反应为吸热反应 |
| B.c>a+b,正反应为放热反应 |
| C.c<a+b,逆反应为吸热反应 |
| D.c<a+b,逆反应为放热反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】根据下列有关图象,说法正确的是

| A.由图Ⅰ知,该反应的△H>0 | B.由图Ⅱ知,该反应为放热反应 |
| C.由图Ⅲ知,t3时一定是采取降低反应温度的措施 | D.由图Ⅲ知,反应在t6时,NH3体积分数最大 |
您最近一年使用:0次




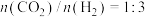 加入一恒压密闭容器中反应,达到平衡时,氢气、甲醇和一氧化碳的分压有如下关系:
加入一恒压密闭容器中反应,达到平衡时,氢气、甲醇和一氧化碳的分压有如下关系: ,下列说法正确的是
,下列说法正确的是 的平衡转化率为
的平衡转化率为
 之值为
之值为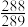
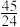
 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断不正确的是(
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断不正确的是(