完成下列填空
(1)下图表示反应
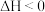 的反应速率与时间的关系,回答下列问题:
的反应速率与时间的关系,回答下列问题:
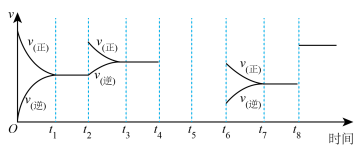
①由图可知 、
、 、
、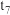 、
、 时都达到了平衡状态,
时都达到了平衡状态, 、
、 时都改变了外在条件,则
时都改变了外在条件,则 时改变的条件为
时改变的条件为_______ ;
②若在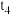 时对该反应进行加压,在
时对该反应进行加压,在 时达到了平衡状态,请在图中画出反应速率在
时达到了平衡状态,请在图中画出反应速率在 时间段的变化趋势。
时间段的变化趋势。_________
(2)某化学科研小组研究在其他条件不变时,改变某一外界条件对反应 化学平衡的影响,得到如图所示的图像(p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数),回答下列问题:
化学平衡的影响,得到如图所示的图像(p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数),回答下列问题:
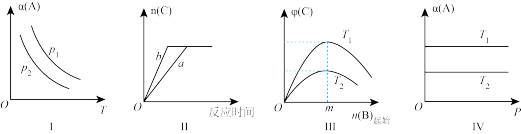
①在Ⅰ中,若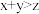 ,则
,则
_______  (填“>”“<”或“=”)
(填“>”“<”或“=”)
②在Ⅱ中,若a→b为使用合适的催化剂,则A的转化率_______ (填“增大”“减小”或“不变”);
③在Ⅲ中,随着B的起始物质的量的增加,在m点时,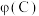 达到最大值,则m点反应物A与B的投料量比为
达到最大值,则m点反应物A与B的投料量比为_______ ;
④在Ⅳ中,若 ,则该反应的平衡常数
,则该反应的平衡常数
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(1)下图表示反应

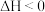 的反应速率与时间的关系,回答下列问题:
的反应速率与时间的关系,回答下列问题:
①由图可知
 、
、 、
、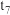 、
、 时都达到了平衡状态,
时都达到了平衡状态, 、
、 时都改变了外在条件,则
时都改变了外在条件,则 时改变的条件为
时改变的条件为②若在
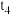 时对该反应进行加压,在
时对该反应进行加压,在 时达到了平衡状态,请在图中画出反应速率在
时达到了平衡状态,请在图中画出反应速率在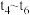 时间段的变化趋势。
时间段的变化趋势。(2)某化学科研小组研究在其他条件不变时,改变某一外界条件对反应
 化学平衡的影响,得到如图所示的图像(p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数),回答下列问题:
化学平衡的影响,得到如图所示的图像(p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数),回答下列问题:
①在Ⅰ中,若
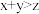 ,则
,则
 (填“>”“<”或“=”)
(填“>”“<”或“=”)②在Ⅱ中,若a→b为使用合适的催化剂,则A的转化率
③在Ⅲ中,随着B的起始物质的量的增加,在m点时,
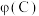 达到最大值,则m点反应物A与B的投料量比为
达到最大值,则m点反应物A与B的投料量比为④在Ⅳ中,若
 ,则该反应的平衡常数
,则该反应的平衡常数
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
更新时间:2022-11-10 16:49:02
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】乙酸是基本的有机化工原料,乙酸制氢具有重要意义,制氢过程发生如下反应:
热裂解反应I:CH3COOH(g)⇌2CO(g)+2H2(g) ΔH1
脱羧基反应Ⅱ:CH3COOH(g)⇌CO2(g)+CH4(g) ΔH2
在恒容密闭容器中,加入一定量乙酸蒸气制氢,在相同时间测得温度与气体产率的关系如图:
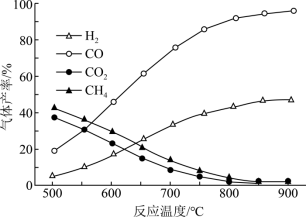
(1)约650℃之前,氢气产率低于甲烷的原因是_______ 。
(2)分析图像知该容器中还发生了其他的副反应,理由是_______ 。
(3)若保持其他条件不变,在乙酸蒸气中掺杂一定量水,氢气的产率显著提高,而CO的产率下降,请用化学方程式表示可能发生的反应:_______ 。
热裂解反应I:CH3COOH(g)⇌2CO(g)+2H2(g) ΔH1
脱羧基反应Ⅱ:CH3COOH(g)⇌CO2(g)+CH4(g) ΔH2
在恒容密闭容器中,加入一定量乙酸蒸气制氢,在相同时间测得温度与气体产率的关系如图:

(1)约650℃之前,氢气产率低于甲烷的原因是
(2)分析图像知该容器中还发生了其他的副反应,理由是
(3)若保持其他条件不变,在乙酸蒸气中掺杂一定量水,氢气的产率显著提高,而CO的产率下降,请用化学方程式表示可能发生的反应:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH)。该反应的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是________ 。
A.CO2和CH3OH的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数 ȹ(CH3OH)与反应温度T的关系如图,则上述CO2转化为甲醇的反应的△H_____ 0(填“>”、“<”、“=”)
(3)上述反应在实际生产中采用的温度是300℃,其目的是_________________ 。
(4)300℃时,将CO2与H2按1∶3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图所示。回答问题:
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是_______ 。
A.CO2的浓度减小 B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1∶3 D.H2的体积分数减小
②B点平衡混合气体的平均摩尔质量为_______________ (保留一位小数)。
 CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是
A.CO2和CH3OH的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数 ȹ(CH3OH)与反应温度T的关系如图,则上述CO2转化为甲醇的反应的△H

(3)上述反应在实际生产中采用的温度是300℃,其目的是
(4)300℃时,将CO2与H2按1∶3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图所示。回答问题:

①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是
A.CO2的浓度减小 B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1∶3 D.H2的体积分数减小
②B点平衡混合气体的平均摩尔质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】近几年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)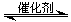 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中V(正)、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题:


①0—6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”);
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)________T(15) (填“<”、“>”或“=”)。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。下图E,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g) + NO2(g) + 2NH3(g) 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。
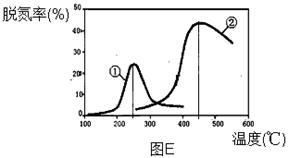
①该反应的△S 0,△H 0(填“>”、“=”或“<”)。
②以下说法正确的是 。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
③已知:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O;NO + NO2 + 2NaOH = 2NaNO2 + H2O标况下V升NO和NO2的混合气体通100mLNaOH溶液恰好完全反应,则NO和NO2的体积比是 ,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)
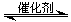 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中V(正)、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)

 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0—6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”);
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)________T(15) (填“<”、“>”或“=”)。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。下图E,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g) + NO2(g) + 2NH3(g)
 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。
①该反应的△S 0,△H 0(填“>”、“=”或“<”)。
②以下说法正确的是 。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
③已知:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O;NO + NO2 + 2NaOH = 2NaNO2 + H2O标况下V升NO和NO2的混合气体通100mLNaOH溶液恰好完全反应,则NO和NO2的体积比是
 ,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】多晶硅是制作光伏电池的关键材料。将SiCl4氢化为SiHCl3的热化学方程式为:3SiCl4+2H2(g)+Si(s) 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0
(1)该反应是____________ 反应(填吸热、放热)
(2)在相同条件,相同时间t时,不同温度下该反应中SiCl4转化率如图所示。下列叙述正确的是________________ (填序号)。
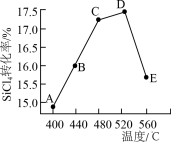
a.相同时间t内,A点的平均反应速率大于B点
b.相同时间t时,B点:v正>v逆
c.相同时间t时,v逆:C点大于A点
d.工业生产中采用了适宜温度:480~520°C
(3)为了增大化学反应速率,除加入催化剂、升高温度外还可以采用哪些方法和措施:___ 。(只写出一条)
 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0(1)该反应是
(2)在相同条件,相同时间t时,不同温度下该反应中SiCl4转化率如图所示。下列叙述正确的是

a.相同时间t内,A点的平均反应速率大于B点
b.相同时间t时,B点:v正>v逆
c.相同时间t时,v逆:C点大于A点
d.工业生产中采用了适宜温度:480~520°C
(3)为了增大化学反应速率,除加入催化剂、升高温度外还可以采用哪些方法和措施:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】 、CO、
、CO、 的过度排放会对环境和人体健康带来极大的危害,工业上可采取多种方法减少这些有害气体的排放。汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:
的过度排放会对环境和人体健康带来极大的危害,工业上可采取多种方法减少这些有害气体的排放。汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:
 ,可减少尾气中有害气体排放。
,可减少尾气中有害气体排放。
I.已知 是放热反应,将CO和NO按不同比例投入一密闭容器中,控制一定温度(
是放热反应,将CO和NO按不同比例投入一密闭容器中,控制一定温度( 或
或 ),发生反应达到平衡时,所得的混合气体中含
),发生反应达到平衡时,所得的混合气体中含 的体积分数随
的体积分数随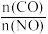 的变化曲线如图所示。
的变化曲线如图所示。

(1)图中a、b、c、d中对应NO转化率最大的是___________。
(2)
___________  (填“
(填“ ”或“
”或“ ”或“
”或“ ”)。
”)。
Ⅱ.已知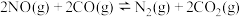 的
的 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
(3)该可逆反应的平衡常数表达式为___________ 。
(4)若平衡后降低温度,则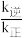
___________ (填“增大”、“不变”或“减小”)
(5)甲醇燃料可替代汽油、柴油,用于各种机动车。已知:在25℃和101kPa,1mol液态 完全燃烧生成
完全燃烧生成 和水蒸气时放出的热量为638kJ。1mol液态水转变成1mol气态水时吸收44kJ的热量。写出表示甲醇燃烧热的热化学反应方程式
和水蒸气时放出的热量为638kJ。1mol液态水转变成1mol气态水时吸收44kJ的热量。写出表示甲醇燃烧热的热化学反应方程式___________ 。
 、CO、
、CO、 的过度排放会对环境和人体健康带来极大的危害,工业上可采取多种方法减少这些有害气体的排放。汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:
的过度排放会对环境和人体健康带来极大的危害,工业上可采取多种方法减少这些有害气体的排放。汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:
 ,可减少尾气中有害气体排放。
,可减少尾气中有害气体排放。I.已知
 是放热反应,将CO和NO按不同比例投入一密闭容器中,控制一定温度(
是放热反应,将CO和NO按不同比例投入一密闭容器中,控制一定温度( 或
或 ),发生反应达到平衡时,所得的混合气体中含
),发生反应达到平衡时,所得的混合气体中含 的体积分数随
的体积分数随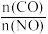 的变化曲线如图所示。
的变化曲线如图所示。
(1)图中a、b、c、d中对应NO转化率最大的是___________。
| A.a | B.b | C.c | D.d |
(2)

 (填“
(填“ ”或“
”或“ ”或“
”或“ ”)。
”)。Ⅱ.已知
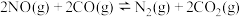 的
的 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。(3)该可逆反应的平衡常数表达式为
(4)若平衡后降低温度,则
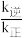
(5)甲醇燃料可替代汽油、柴油,用于各种机动车。已知:在25℃和101kPa,1mol液态
 完全燃烧生成
完全燃烧生成 和水蒸气时放出的热量为638kJ。1mol液态水转变成1mol气态水时吸收44kJ的热量。写出表示甲醇燃烧热的热化学反应方程式
和水蒸气时放出的热量为638kJ。1mol液态水转变成1mol气态水时吸收44kJ的热量。写出表示甲醇燃烧热的热化学反应方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】根据外界条件对化学平衡的影响回答下列问题:
(1)碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I−(aq) I3-(aq),下列说法不正确的是
I3-(aq),下列说法不正确的是_____ (填字母序号,下同)。
a.上述体系中加入苯,平衡不移动
b.可运用该反应原理除去硫粉中少量的碘单质
c.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
d.加入AgNO3溶液平衡向左移动
(2)某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
①下列分析正确的是_____ 。
a.平衡后,加入N2,该反应的ΔH增大
b.平衡后,加入催化剂,该反应的ΔH不变
c.平衡后,充入NH3,新平衡时,NH3的百分含量变大
d.若反应前充入的N2与H2物质的量相等,达平衡时N2的转化率比H2的高
②欲提高H2的转化率,下列措施可行的是_____ 。
a.缩小容器体积
b.向容器中按原比例再充入N2和H2
c.向容器中再充入惰性气体
d.改变反应的催化剂
e.液化NH3并分离
(1)碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I−(aq)
 I3-(aq),下列说法不正确的是
I3-(aq),下列说法不正确的是a.上述体系中加入苯,平衡不移动
b.可运用该反应原理除去硫粉中少量的碘单质
c.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
d.加入AgNO3溶液平衡向左移动
(2)某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。①下列分析正确的是
a.平衡后,加入N2,该反应的ΔH增大
b.平衡后,加入催化剂,该反应的ΔH不变
c.平衡后,充入NH3,新平衡时,NH3的百分含量变大
d.若反应前充入的N2与H2物质的量相等,达平衡时N2的转化率比H2的高
②欲提高H2的转化率,下列措施可行的是
a.缩小容器体积
b.向容器中按原比例再充入N2和H2
c.向容器中再充入惰性气体
d.改变反应的催化剂
e.液化NH3并分离
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。已知:3H2(g)+CO2(g)⇌CH3OH(g)+H2O(g) ΔH=-48.9kJ/mol
(1)为提高CH3OH转化率,理论上应采用的条件是________ (填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[ ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
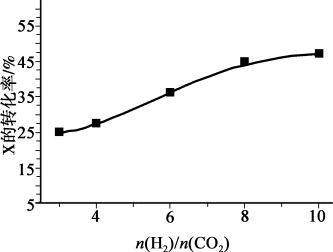
反应物X是_________ (填“CO2”或“H2”),理由是_________ 。
(3)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol,这段时间内H2的平均速率为______ ,化学平衡常数K=___ 。
(1)为提高CH3OH转化率,理论上应采用的条件是
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[
 ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
反应物X是
(3)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol,这段时间内H2的平均速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】某实验室模拟反应 ,在密闭容器中加入足量的C和一定量的
,在密闭容器中加入足量的C和一定量的 气体,维持温度为
气体,维持温度为 ,如图为不同压强下该反应经过相同时间
,如图为不同压强下该反应经过相同时间 的转化率随着压强变化的示意图。请从动力学角度分析,
的转化率随着压强变化的示意图。请从动力学角度分析,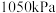 前,反应中
前,反应中 的转化率随着压强增大而增大的原因为
的转化率随着压强增大而增大的原因为_______ ;在 时,
时, 的体积分数为
的体积分数为_______ 。

 ,在密闭容器中加入足量的C和一定量的
,在密闭容器中加入足量的C和一定量的 气体,维持温度为
气体,维持温度为 ,如图为不同压强下该反应经过相同时间
,如图为不同压强下该反应经过相同时间 的转化率随着压强变化的示意图。请从动力学角度分析,
的转化率随着压强变化的示意图。请从动力学角度分析,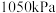 前,反应中
前,反应中 的转化率随着压强增大而增大的原因为
的转化率随着压强增大而增大的原因为 时,
时, 的体积分数为
的体积分数为
您最近一年使用:0次



