硫酸是一种重要的基本化工产品。
(1)接触法制硫酸的第一步是将黄铁矿(FeS2)和氧气加入沸腾炉中发生如下反应:4FeS2(s)+11O2(g)= 2Fe2O3(s)+8SO2(g) ΔH < 0 ;为了提高黄铁矿的利用率,可以采取的措施是_______ ,_______ (任答两点)。
(2)将SO2和O2通入接触室,在催化剂(V2O5)的作用下发生如下反应:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-98 kJ·mol-1。回答下列问题:
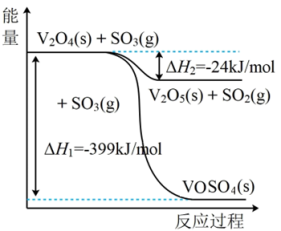
①钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_______ 。
②能说明2SO2(g)+O2(g)⇌2SO3(g)在绝热恒容条件下已达到平衡状态的是_______ 。
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.体系温度不再改变 D.容器内密度保持不变
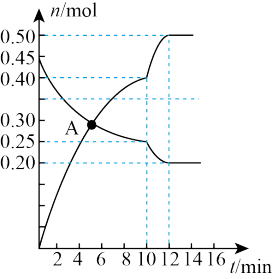
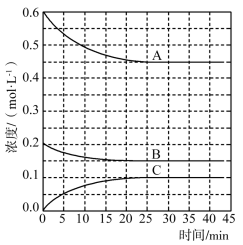
③400℃时,若向2 L体积恒定的密闭容器中充入物质的量之比是2∶1的SO2和O2发生反应,其中O2、SO3物质的量随时间变化的曲线如图所示。图中A点v正_______ (填“>”“<”或“=”)v逆;达平衡后,反应前和反应后的压强比是_______ ;第10 min时,外界改变的条件可能是_______ (填字母)。
A.加合适催化剂 B.增大O2的物质的量 C.减小SO2的物质的量
D.升高温度 E.降低温度 F.充入Ar
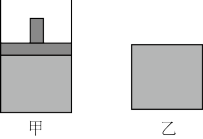
(3)将1mol的SO2和1molO2分别充入下面的两个体积相同的容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应,在反应过程中维持体系温度不变。达平衡时SO2的转化率甲_______ 乙(填“>”“<”或“=”)。
(1)接触法制硫酸的第一步是将黄铁矿(FeS2)和氧气加入沸腾炉中发生如下反应:4FeS2(s)+11O2(g)= 2Fe2O3(s)+8SO2(g) ΔH < 0 ;为了提高黄铁矿的利用率,可以采取的措施是
(2)将SO2和O2通入接触室,在催化剂(V2O5)的作用下发生如下反应:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-98 kJ·mol-1。回答下列问题:
①钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:

②能说明2SO2(g)+O2(g)⇌2SO3(g)在绝热恒容条件下已达到平衡状态的是
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.体系温度不再改变 D.容器内密度保持不变
③400℃时,若向2 L体积恒定的密闭容器中充入物质的量之比是2∶1的SO2和O2发生反应,其中O2、SO3物质的量随时间变化的曲线如图所示。图中A点v正

A.加合适催化剂 B.增大O2的物质的量 C.减小SO2的物质的量
D.升高温度 E.降低温度 F.充入Ar
(3)将1mol的SO2和1molO2分别充入下面的两个体积相同的容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应,在反应过程中维持体系温度不变。达平衡时SO2的转化率甲

更新时间:2022-11-08 16:35:35
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】二氯化碳利用具有十分重要的意义,科学家有以下几个设想。
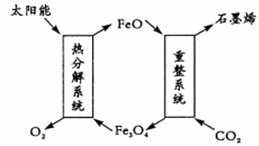
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如下:
①Fe3O4中Fe的化合价是+ 2和__________ ;
②重整系统发生反应的化学方程式为______________________________ 。
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g) C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
① 其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将_____________ (填“增大”、“ 减小”或“不变”);
②△H________ 0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4________ H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq) NH4+ (aq) +OH-(aq) △H1=a kJ•mol-1
NH4+ (aq) +OH-(aq) △H1=a kJ•mol-1
CO2 (g) + H2O(l) H2CO3 (aq) △H2=bkJ•mol-1
H2CO3 (aq) △H2=bkJ•mol-1
H2CO3(aq) + OH-(aq) HCO3-(aq) + H2O(l) △H3=ckJ•mol-1
HCO3-(aq) + H2O(l) △H3=ckJ•mol-1
则利用NH3• H2O吸收CO2制备NH4HCO3的热化学方程式为_____________________________ ;
②已知常温下相关数据如表:
则反应NH4++HCO3-+H2O NH3• H2O+ H2CO3的平衡常数k=
NH3• H2O+ H2CO3的平衡常数k=___________ 。
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如下:
①Fe3O4中Fe的化合价是+ 2和
②重整系统发生反应的化学方程式为
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)
 C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。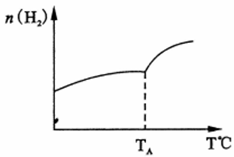
① 其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将
②△H
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq)
 NH4+ (aq) +OH-(aq) △H1=a kJ•mol-1
NH4+ (aq) +OH-(aq) △H1=a kJ•mol-1CO2 (g) + H2O(l)
 H2CO3 (aq) △H2=bkJ•mol-1
H2CO3 (aq) △H2=bkJ•mol-1H2CO3(aq) + OH-(aq)
 HCO3-(aq) + H2O(l) △H3=ckJ•mol-1
HCO3-(aq) + H2O(l) △H3=ckJ•mol-1则利用NH3• H2O吸收CO2制备NH4HCO3的热化学方程式为
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5mol • L-1 |
Ka1(H2CO3) | 4×10-7mol • L-1 |
Ka2(H2CO3) | 4×10-11mol • L-1 |
则反应NH4++HCO3-+H2O
 NH3• H2O+ H2CO3的平衡常数k=
NH3• H2O+ H2CO3的平衡常数k=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】大气环境中NOx的减量化排放受到国内外广泛关注。利用碳还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g)。回答下列问题:
N2(g)+CO2(g)。回答下列问题:
(1)该反应在常温下可以自发进行,则反应的△H________ 0(填“>”“=”或“<”)'有利于提高NO平衡转化率的条件是____________ (任写一条)。
(2)以上反应可分为如下四步反应方程,写出其中第三步的反应:
第一步:2NO=(NO)2
第二步:(NO)2+C=N2O+C(O)
第三步:_________________
第四步:2C(O)=C+CO2
(3)对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L。不同温度下,测得第2小时NO去除率如图所示:
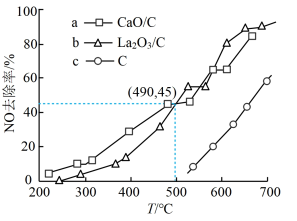
①据图分析,温度490°C以下,三种情况下反应的活化能最小的是________ 用a、b、c表示);CaO/C、La2O3/C去除NO效果比C更好,其依据是________ (写一条)。
②上述实验中,490°C时,若测得CaO/C对NO的去除率为60%,则可能采取的措施是________ 。
A.及时分离出CO2 B.压缩体积
C.恒容下,向体系中通入氦气 D.改良优化了催化剂
③在CaO/C、490°C条件下0~2 h内的平均反应速率v(NO)=_______ mol•L-1•h-1,该温度下此反应的平衡常数为121,则反应达平衡时NO的去除率为________ (保留二位有效数字)。
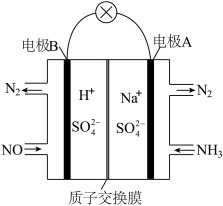
(4)利用电化学原理处理NOx也是重要的研究方向,如下装置图中正极的电极反应式为:_________ 。
 N2(g)+CO2(g)。回答下列问题:
N2(g)+CO2(g)。回答下列问题:(1)该反应在常温下可以自发进行,则反应的△H
(2)以上反应可分为如下四步反应方程,写出其中第三步的反应:
第一步:2NO=(NO)2
第二步:(NO)2+C=N2O+C(O)
第三步:
第四步:2C(O)=C+CO2
(3)对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L。不同温度下,测得第2小时NO去除率如图所示:

①据图分析,温度490°C以下,三种情况下反应的活化能最小的是
②上述实验中,490°C时,若测得CaO/C对NO的去除率为60%,则可能采取的措施是
A.及时分离出CO2 B.压缩体积
C.恒容下,向体系中通入氦气 D.改良优化了催化剂
③在CaO/C、490°C条件下0~2 h内的平均反应速率v(NO)=
(4)利用电化学原理处理NOx也是重要的研究方向,如下装置图中正极的电极反应式为:

您最近一年使用:0次
【推荐3】H2S作为一种有毒气体,广泛存在于石油化工、冶金等行业的废气中,脱除气体中的硫化氢对于保护环境、合理利用资源有着现实而重要的意义。请回答下列问题:
(1)H2S的空间构型为_______ 。
(2)用H2S和天然气生成CS2的反应为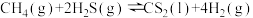
已知:Ⅰ.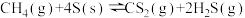
 ;
;
Ⅱ.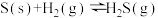
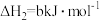 ;
;
Ⅲ.
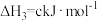 ;
;
则反应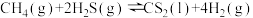 的
的
_______  (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。
(3)800℃时,将一定量的H2S气体充入恒容密闭容器中,发生反应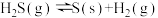 ,t min后达到化学平衡,测得容器中
,t min后达到化学平衡,测得容器中 与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度
与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度_______ mol/L,该温度下,反应的化学平衡常数
_______ 。
(4)向恒压容器中充入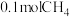 和
和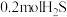 ,发生反应
,发生反应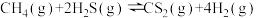 ,不同温度下,
,不同温度下, 的平衡转化率(%)与温度(℃)的关系如图所示:
的平衡转化率(%)与温度(℃)的关系如图所示:

①该反应的活化能:E正_______ E逆(填“>”“<”或“=”)
②若初始容积为V0 L,1200℃反应达到平衡时,容器的容积为_______ L(用含V0的代数式表示)。
③1200℃时,欲提高 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是_______ (填选项字母)。
A.增大压强 B.再充入 C.再充入H2S D.充入He E.使用高效催化剂
C.再充入H2S D.充入He E.使用高效催化剂
(1)H2S的空间构型为
(2)用H2S和天然气生成CS2的反应为
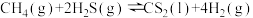
已知:Ⅰ.
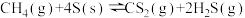
 ;
;Ⅱ.
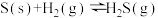
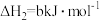 ;
;Ⅲ.

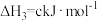 ;
;则反应
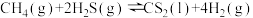 的
的
 (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。(3)800℃时,将一定量的H2S气体充入恒容密闭容器中,发生反应
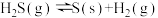 ,t min后达到化学平衡,测得容器中
,t min后达到化学平衡,测得容器中 与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度
与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度
(4)向恒压容器中充入
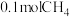 和
和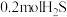 ,发生反应
,发生反应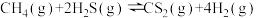 ,不同温度下,
,不同温度下, 的平衡转化率(%)与温度(℃)的关系如图所示:
的平衡转化率(%)与温度(℃)的关系如图所示:
①该反应的活化能:E正
②若初始容积为V0 L,1200℃反应达到平衡时,容器的容积为
③1200℃时,欲提高
 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是A.增大压强 B.再充入
 C.再充入H2S D.充入He E.使用高效催化剂
C.再充入H2S D.充入He E.使用高效催化剂
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】MgO可用于回收烟气中的SO2,其流程如下:

已知:1.Mg(OH)2难溶于水,MgSO3微溶于水,Mg(HSO3)2和MgSO4易溶于水。
2.“过滤”所得固体和回收液中均含有MgSO3和MgSO4。
(1)“熟化”时将MgO和H2O转化为Mg(OH)2悬浊液。与Mg(OH)2固体相比,Mg(OH)2悬浊液脱硫效果更好,原因是___________ 。
(2)“过滤”所得回收液可再次用于“脱硫”。
①回收液含MgSO3和MgSO4,其中可继续吸收SO2的是___________ (填化学式)。
②为测定回收液中硫元素的含量,请补充完整实验方案:
取一定体积的回收液,___________ ,洗涤、干燥,得一定质量的BaSO4沉淀。(须使用的试剂有:3%H2O2溶液、0.2mol·L-1BaCl2溶液)
(3)“脱硫”时部分SO2与Mg(OH)2悬浊液在O2作用下转化为MgSO4,反应的化学方程式为___________ 。
(4)“焙烧”MgSO3和MgSO4混合物时,通入适量CO能增大SO2的回收产量,原因是______ 。
(5)使用该方法回收烟气中的SO2时,理论上___________ (填“需要”或“不需要”)补充MgO,原因是___________ 。

已知:1.Mg(OH)2难溶于水,MgSO3微溶于水,Mg(HSO3)2和MgSO4易溶于水。
2.“过滤”所得固体和回收液中均含有MgSO3和MgSO4。
(1)“熟化”时将MgO和H2O转化为Mg(OH)2悬浊液。与Mg(OH)2固体相比,Mg(OH)2悬浊液脱硫效果更好,原因是
(2)“过滤”所得回收液可再次用于“脱硫”。
①回收液含MgSO3和MgSO4,其中可继续吸收SO2的是
②为测定回收液中硫元素的含量,请补充完整实验方案:
取一定体积的回收液,
(3)“脱硫”时部分SO2与Mg(OH)2悬浊液在O2作用下转化为MgSO4,反应的化学方程式为
(4)“焙烧”MgSO3和MgSO4混合物时,通入适量CO能增大SO2的回收产量,原因是
(5)使用该方法回收烟气中的SO2时,理论上
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】向容积为2L的密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g) Y(g)+3Z(g)。经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,回答下列问题:
Y(g)+3Z(g)。经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,回答下列问题:
(1)用Y表示的化学反应速率为___ 。
(2)X的转化率为___ ,Z的平衡浓度为___ 。
(3)能加快反应速率的措施是___ 。
①升高温度②容器体积不变,充入惰性气体Ar③使用催化剂④容器压强不变,充入惰性气体Ar⑤将容器体积缩小一半
(4)能够说明该反应达到平衡的标志是___ 。
①容器内混合气体的密度保持不变②容器内混合气体的压强保持不变③Z、Y的浓度之比为3:1④容器内混合气体的相对分子质量保持不变⑤单位时间内断开3nmolZ—Z键的同时生成nmolY—Y
 Y(g)+3Z(g)。经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,回答下列问题:
Y(g)+3Z(g)。经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,回答下列问题:(1)用Y表示的化学反应速率为
(2)X的转化率为
(3)能加快反应速率的措施是
①升高温度②容器体积不变,充入惰性气体Ar③使用催化剂④容器压强不变,充入惰性气体Ar⑤将容器体积缩小一半
| A.①②③④ | B.①③④ | C.①④⑤ | D.①③⑤ |
①容器内混合气体的密度保持不变②容器内混合气体的压强保持不变③Z、Y的浓度之比为3:1④容器内混合气体的相对分子质量保持不变⑤单位时间内断开3nmolZ—Z键的同时生成nmolY—Y
| A.①②④ | B.②④⑤ | C.③④⑤ | D.①②⑤ |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】Ⅰ、某实验小组对H2O2的分解做了如下探究:将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:
(1)写出大试管中发生反应的化学方程式:___________ ,
(2)实验结果表明,催化剂的催化效果与___________ 有关。
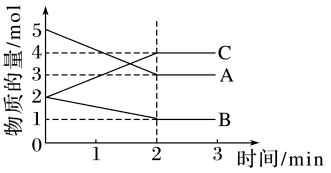
Ⅱ、某可逆反应在体积为5L的密闭容器中进行,0~3min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。
(3)该反应的化学方程式为___________ 。
(4)能说明该反应已达到平衡状态的是___________ (填字母)。
a、v(A)=2v(B)
b、容器内压强保持不变
c、混合气体的平均摩尔质量保持不变
d、容器内混合气体的密度保持不变
e、B的体积分数不变
(5)在密闭容器里,通入amolA(g)、bmolB(g)、cmolC(g),发生上述反应,当改变下列条件时,反应速率会减小的是___________ (填序号)。
①降低温度②加入催化剂③增大容器体积④移走部分A⑤恒容时,充入氦气
(6)一定温度下,氧化铁可与一氧化碳发生反应:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)。在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成单质铁11.2g。10min内v(CO)=___________ 。
(7)下列4个数据是在不同条件下测得的合成氨反应速率,其中反应最快的是___________(填字母)。
(8)在2Z(g)+Y(g) 3X(s)中,恒容时,下列情况能说明该反应已达到平衡状态的是
3X(s)中,恒容时,下列情况能说明该反应已达到平衡状态的是___________ (填字母)。
a、v(Z)正=2v(Y)逆
b、容器内压强保持不变
c、混合气体的平均摩尔质量保持不变
d、容器内混合气体的密度保持不变
e、Z的物质的量分数不变
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与
Ⅱ、某可逆反应在体积为5L的密闭容器中进行,0~3min内各物质的物质的量的变化情况如图所示(A、B、C均为气体)。

(3)该反应的化学方程式为
(4)能说明该反应已达到平衡状态的是
a、v(A)=2v(B)
b、容器内压强保持不变
c、混合气体的平均摩尔质量保持不变
d、容器内混合气体的密度保持不变
e、B的体积分数不变
(5)在密闭容器里,通入amolA(g)、bmolB(g)、cmolC(g),发生上述反应,当改变下列条件时,反应速率会减小的是
①降低温度②加入催化剂③增大容器体积④移走部分A⑤恒容时,充入氦气
(6)一定温度下,氧化铁可与一氧化碳发生反应:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)。在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成单质铁11.2g。10min内v(CO)=
(7)下列4个数据是在不同条件下测得的合成氨反应速率,其中反应最快的是___________(填字母)。
| A.v(H2)=0.1mol/(L∙min) | B.v(N2)=0.1mol/(L∙min) |
| C.v(NH3)=0.15mol/(L∙min) | D.v(N2)=0.002mol/(L∙s) |
 3X(s)中,恒容时,下列情况能说明该反应已达到平衡状态的是
3X(s)中,恒容时,下列情况能说明该反应已达到平衡状态的是a、v(Z)正=2v(Y)逆
b、容器内压强保持不变
c、混合气体的平均摩尔质量保持不变
d、容器内混合气体的密度保持不变
e、Z的物质的量分数不变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】合成氨所需H2取自CH4,CH4和O2作用成CO2、H2(反应①),然而CH4和O2反应还能生成CO2、H2O(反应②),当有水生成时,H2O和CH4反应(反应③)。下表 为三个反应在不同温度下的平衡常数K。
(1)反应①的平衡常数K①的表达式为_______________ 。
(2)反应①②③的平衡常数K①、K②、K③之间的关系为K②=_____________ (用含K①、 K③的式子表示)。反应①②③的反应焓变:ΔH①、ΔH②、ΔH③之间的关系为ΔH①= _____________ (用含ΔH②、ΔH③的式子表示)。
(3)恒温条件下,反应③的能量与反应进程关系应对应下图中的_____________ ,反应② 的能量与反应进程关系应对应下图中的_____________ 。

(4)为使反应尽可能按生成H2的方向进行,若只考虑反应③,且不降低反应速率,可采 取__________ 措施;若只考虑反应①②,除采取控温措施外,还可采取_____________ (写出两条措施即可)。
(5)250℃时,以镍合金为催化剂,发生CO2(g)+CH4(g) 2CO(g)+2H2(g),向40L 的密闭容器中通入6molCO2(g)和6molCH4(g),平衡时测得体系中CH4的体积分数 为10%,则混合气体的密度为
2CO(g)+2H2(g),向40L 的密闭容器中通入6molCO2(g)和6molCH4(g),平衡时测得体系中CH4的体积分数 为10%,则混合气体的密度为______ g/L,CO2的转化率为__________ (保留三位有效数字)。
反应温度 | 400K | 600K | 800K | 1000K | 1200K |
①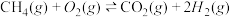 | 2.2×1046 | 2.8×1032 | 3.2×1025 | 2.5×1021 | ---- |
②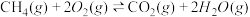 | 5.5×10104 | 5.5×1069 | 1.8×1052 | 6.3×1041 | ---- |
③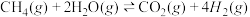 | ---- | 1.4×10-5 | 5.3×10-2 | 7.8 | 2.2×103 |
(1)反应①的平衡常数K①的表达式为
(2)反应①②③的平衡常数K①、K②、K③之间的关系为K②=
(3)恒温条件下,反应③的能量与反应进程关系应对应下图中的

(4)为使反应尽可能按生成H2的方向进行,若只考虑反应③,且不降低反应速率,可采 取
(5)250℃时,以镍合金为催化剂,发生CO2(g)+CH4(g)
 2CO(g)+2H2(g),向40L 的密闭容器中通入6molCO2(g)和6molCH4(g),平衡时测得体系中CH4的体积分数 为10%,则混合气体的密度为
2CO(g)+2H2(g),向40L 的密闭容器中通入6molCO2(g)和6molCH4(g),平衡时测得体系中CH4的体积分数 为10%,则混合气体的密度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F.Haber从1902年开始研究N2和H2直接合成NH3.在1.01×105 Pa、250 ℃时,将1 mol N2和1 mol H2加入a L刚性容器中充分反应,测得NH3体积分数为0.04;其他条件不变,温度升高至450 ℃,测得NH3体积分数为0.025,则可判断合成氨反应为_______ (填“吸热”或“放热”)反应。
(2)在1.01×105 Pa、250 ℃时,将2 mol N2和2 mol H2加入a L密闭容器中充分反应,H2平衡转化率可能为_______(填标号)。
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
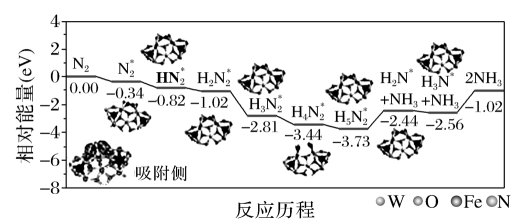
需要吸收能量最大的能垒(活化能)E=_______ eV,该步骤的化学方程式为_______
(4)T ℃时,在恒温恒容的密闭条件下发生反应:N2(g)+3H2(g) 2NH3(g)反应过程中各物质浓度的变化曲线如图所示:表示N2浓度变化的曲线是
2NH3(g)反应过程中各物质浓度的变化曲线如图所示:表示N2浓度变化的曲线是_______ (填“A”、“B”或“C”)。与(1)中的实验条件(1.01×105 Pa、450 ℃)相比,改变的条件可能是_______ 。
(1)德国化学家F.Haber从1902年开始研究N2和H2直接合成NH3.在1.01×105 Pa、250 ℃时,将1 mol N2和1 mol H2加入a L刚性容器中充分反应,测得NH3体积分数为0.04;其他条件不变,温度升高至450 ℃,测得NH3体积分数为0.025,则可判断合成氨反应为
(2)在1.01×105 Pa、250 ℃时,将2 mol N2和2 mol H2加入a L密闭容器中充分反应,H2平衡转化率可能为_______(填标号)。
| A.=4% | B.<4% | C.4%~7% | D.>11.5% |

需要吸收能量最大的能垒(活化能)E=
(4)T ℃时,在恒温恒容的密闭条件下发生反应:N2(g)+3H2(g)
 2NH3(g)反应过程中各物质浓度的变化曲线如图所示:表示N2浓度变化的曲线是
2NH3(g)反应过程中各物质浓度的变化曲线如图所示:表示N2浓度变化的曲线是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】在如图所示的恒温、恒压密闭容器中加入2 mol X和2 mol Y,发生如下反应并达到平衡(X、Y状态未知):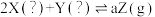 。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a=_______ 。
(2)平衡时Y的转化率=_______ 。
(3)X的状态为_______ (填“气态”或“非气态”)。
(4)下列叙述中,能说明上述反应达到平衡状态的是_______ (填标号)。
a.气体密度不变
b.单位时间内消耗2 mol X,同时生成a mol Z
c.Y的转化率不再变化
d.Z的浓度不再变化
(5)已知:
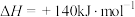

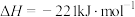
写出 和焦炭、氯气反应生成液态
和焦炭、氯气反应生成液态 和CO气体的热化学方程式:
和CO气体的热化学方程式:_______ 。
(6)依据下表信息,要精制含少量 杂质的
杂质的 ,可采用
,可采用_______ 方法。
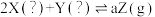 。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
(1)a=
(2)平衡时Y的转化率=
(3)X的状态为
(4)下列叙述中,能说明上述反应达到平衡状态的是
a.气体密度不变
b.单位时间内消耗2 mol X,同时生成a mol Z
c.Y的转化率不再变化
d.Z的浓度不再变化
(5)已知:

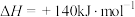

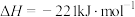
写出
 和焦炭、氯气反应生成液态
和焦炭、氯气反应生成液态 和CO气体的热化学方程式:
和CO气体的热化学方程式:(6)依据下表信息,要精制含少量
 杂质的
杂质的 ,可采用
,可采用 |  | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
您最近一年使用:0次
【推荐1】依据图中氮元素及其化合物的转化关系,回答问题:

(1)图中X的化学式为____ ,从化合价上看,X与水反应所得产物具有___ 性(填“氧化”或“还原”)。
(2)已知化学反应N2+3H2 2NH3的能量变化如图所示,回答下列问题:
2NH3的能量变化如图所示,回答下列问题:
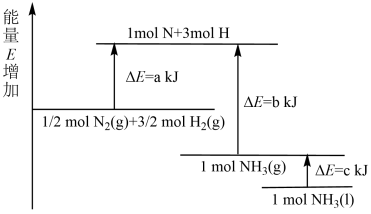
则0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程_______ (填“吸收”或“放出”)_____ kJ能量。
(3)在一个容积3L的密闭容器里进行如下反应N2(g)+3H2(g)⇌2NH3(g),反应开始时n(N2)=1.5mol,n(H2)=4.4mol,2min末n(H2)=0.8mol。
①前2min内用NH3表示该反应的反应速率_________________________ ;
②到2min末N2的转化率为______________________ ;
③下列条件能加快该反应的反应速率的有______________________ ;
A.保持体积不变,再向容器中充N2
B.保持体积不变,再向容器中充He
C.保持压强不变,再向容器中充He
D.选择合适的催化剂
④一段时间后,下列条件下能说明该反应已达到平衡状态的是:_______________ 。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N﹣H键的同时生成2n mol H﹣H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变

(1)图中X的化学式为
(2)已知化学反应N2+3H2
 2NH3的能量变化如图所示,回答下列问题:
2NH3的能量变化如图所示,回答下列问题:
则0.5 mol N2(g)和1.5 mol H2(g)生成1 mol NH3(g)的过程
(3)在一个容积3L的密闭容器里进行如下反应N2(g)+3H2(g)⇌2NH3(g),反应开始时n(N2)=1.5mol,n(H2)=4.4mol,2min末n(H2)=0.8mol。
①前2min内用NH3表示该反应的反应速率
②到2min末N2的转化率为
③下列条件能加快该反应的反应速率的有
A.保持体积不变,再向容器中充N2
B.保持体积不变,再向容器中充He
C.保持压强不变,再向容器中充He
D.选择合适的催化剂
④一段时间后,下列条件下能说明该反应已达到平衡状态的是:
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N﹣H键的同时生成2n mol H﹣H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】为实现“碳达峰”及“碳中和”,科学家利用多聚物来捕获 ,使
,使 与
与 在催化剂表面生成
在催化剂表面生成 和
和 ;其中涉及以下反应。
;其中涉及以下反应。
反应Ⅰ.
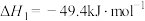

反应Ⅱ.


回答下列问题:
(1)已知

___________  。
。
(2)恒温恒容条件下,若 催化加氢制
催化加氢制 只发生反应Ⅰ,下列能说明反应Ⅰ达到化学平衡状态的
只发生反应Ⅰ,下列能说明反应Ⅰ达到化学平衡状态的___________ (填字母序号)。
a.平衡常数 不变
不变
b.单位时间内消耗 的同时生成
的同时生成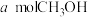
c. 的体积分数不再改变
的体积分数不再改变
d.密闭容器的体系压强不再改变
e.混合气体的密度不再改变
(3) 催化加氢制
催化加氢制 的一种反应历程如下图所示(吸附在催化剂表面的物质用*标注,如
的一种反应历程如下图所示(吸附在催化剂表面的物质用*标注,如 表示
表示 吸附在催化剂表面)
吸附在催化剂表面)
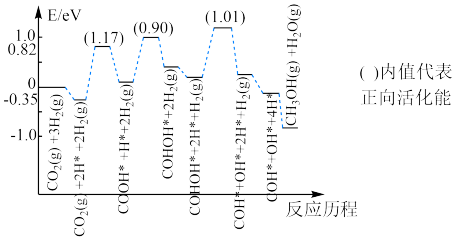
该反应历程中决速步反应的化学方程式为___________ 。
(4)在恒压密闭容器中充入6mol 与2mol
与2mol ,分别在1MPa和10MPa下反应。平衡体系中,CO及
,分别在1MPa和10MPa下反应。平衡体系中,CO及 的物质的量分数(%)与温度变化关系如图:
的物质的量分数(%)与温度变化关系如图:

①恒压条件下发生反应Ⅰ和Ⅱ,平衡后再充入惰性气体,反应Ⅱ平衡将___________ 移动(填“正向”、“逆向”或“不”)。
②表示10MPa时CO的物质的量分数随温度变化关系的曲线是___________ (填标号)。
③已知: 的选择性
的选择性 ,为提高
,为提高 的选择性,可采取的措施有
的选择性,可采取的措施有___________ (任写一条即可)。
④若反应经过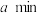 达到M点,且
达到M点,且 的选择性为50%,则平均反应速率
的选择性为50%,则平均反应速率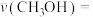
___________ 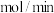 ,对反应Ⅰ,其正向反应速率N点
,对反应Ⅰ,其正向反应速率N点___________ M点(填“>”、“<”或“=”),在590℃时,反应Ⅰ的分压平衡常数
___________ 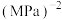 (列出计算式)。
(列出计算式)。
 ,使
,使 与
与 在催化剂表面生成
在催化剂表面生成 和
和 ;其中涉及以下反应。
;其中涉及以下反应。反应Ⅰ.

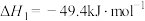

反应Ⅱ.



回答下列问题:
(1)已知


 。
。(2)恒温恒容条件下,若
 催化加氢制
催化加氢制 只发生反应Ⅰ,下列能说明反应Ⅰ达到化学平衡状态的
只发生反应Ⅰ,下列能说明反应Ⅰ达到化学平衡状态的a.平衡常数
 不变
不变 b.单位时间内消耗
 的同时生成
的同时生成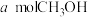
c.
 的体积分数不再改变
的体积分数不再改变 d.密闭容器的体系压强不再改变
e.混合气体的密度不再改变
(3)
 催化加氢制
催化加氢制 的一种反应历程如下图所示(吸附在催化剂表面的物质用*标注,如
的一种反应历程如下图所示(吸附在催化剂表面的物质用*标注,如 表示
表示 吸附在催化剂表面)
吸附在催化剂表面)
该反应历程中决速步反应的化学方程式为
(4)在恒压密闭容器中充入6mol
 与2mol
与2mol ,分别在1MPa和10MPa下反应。平衡体系中,CO及
,分别在1MPa和10MPa下反应。平衡体系中,CO及 的物质的量分数(%)与温度变化关系如图:
的物质的量分数(%)与温度变化关系如图:
①恒压条件下发生反应Ⅰ和Ⅱ,平衡后再充入惰性气体,反应Ⅱ平衡将
②表示10MPa时CO的物质的量分数随温度变化关系的曲线是
③已知:
 的选择性
的选择性 ,为提高
,为提高 的选择性,可采取的措施有
的选择性,可采取的措施有④若反应经过
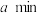 达到M点,且
达到M点,且 的选择性为50%,则平均反应速率
的选择性为50%,则平均反应速率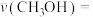
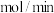 ,对反应Ⅰ,其正向反应速率N点
,对反应Ⅰ,其正向反应速率N点
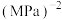 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】汽车尾气处理系统的催化转化器中发生的主要反应为: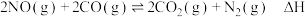 。回答下列与该反应有关的问题。
。回答下列与该反应有关的问题。
(1)在恒温恒容的密闭容器内充入一定量的NO和CO,发生上述反应。下列能说明反应达到平衡状态的是____________(填字母序号)。
(2)向甲、乙两个恒温、恒容(体积均为2L)的密闭容器内分别加入相同物质的量的NO和CO,在不同时刻测得两容器内NO的物质的量随时间的变化情况如下表:
①甲容器中0~120min内,用 表示的平均反应速率
表示的平均反应速率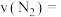
______  。
。
②
____  ,该反应的
,该反应的
______ 0。(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
③该反应能够自发进行的条件是______ (填“低温”“高温”或“任何温度”)。
④ 时,该反应的平衡常数
时,该反应的平衡常数
_______ 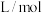 。
。
(3)T℃时,在密闭容器内充入一定量的NO和CO,发生上述反应,测得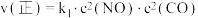 、
、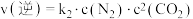 (
( 、
、 为速率常数)。NO的平衡转化率与温度、压强的关系如下图所示。
为速率常数)。NO的平衡转化率与温度、压强的关系如下图所示。

①压强 、
、 、
、 由小到大的顺序是
由小到大的顺序是_______ ,理由是_______________________ 。
②该反应的平衡常数
_____________ (用 、
、 表示)。
表示)。
③达到平衡后,压缩容器体积,在达到新的平衡之前,
______ 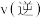 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
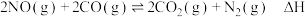 。回答下列与该反应有关的问题。
。回答下列与该反应有关的问题。(1)在恒温恒容的密闭容器内充入一定量的NO和CO,发生上述反应。下列能说明反应达到平衡状态的是____________(填字母序号)。
| A.容器内气体的密度不再改变 | B.容器内气体的平均摩尔质量不再改变 |
| C.容器内气体的压强不再改变 | D.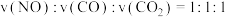 |
| 时间/min | 0 | 40 | 80 | 120 | 160 | |
甲容器恒温为 |  | 4.00 | 3.00 | 2.20 | 1.60 | 1.60 |
乙容器恒温为 |  | 4.00 | 2.90 | 2.00 | 2.00 | 2.00 |
 表示的平均反应速率
表示的平均反应速率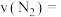
 。
。②

 ,该反应的
,该反应的
 ”、“
”、“ ”或“
”或“ ”)。
”)。③该反应能够自发进行的条件是
④
 时,该反应的平衡常数
时,该反应的平衡常数
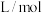 。
。(3)T℃时,在密闭容器内充入一定量的NO和CO,发生上述反应,测得
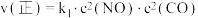 、
、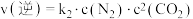 (
( 、
、 为速率常数)。NO的平衡转化率与温度、压强的关系如下图所示。
为速率常数)。NO的平衡转化率与温度、压强的关系如下图所示。
①压强
 、
、 、
、 由小到大的顺序是
由小到大的顺序是②该反应的平衡常数

 、
、 表示)。
表示)。③达到平衡后,压缩容器体积,在达到新的平衡之前,

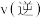 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
您最近一年使用:0次



