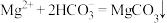人体血液存在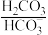 、
、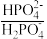 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值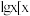 表示
表示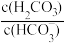 或
或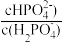 与pH的关系如图所示,已知碳酸
与pH的关系如图所示,已知碳酸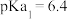 、磷酸
、磷酸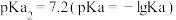 ,则下列说法正确的是
,则下列说法正确的是

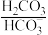 、
、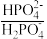 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值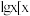 表示
表示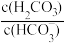 或
或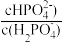 与pH的关系如图所示,已知碳酸
与pH的关系如图所示,已知碳酸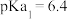 、磷酸
、磷酸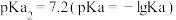 ,则下列说法正确的是
,则下列说法正确的是
A.曲线Ⅱ表示 与pH的变化关系 与pH的变化关系 |
B.当 时, 时,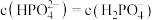 |
C.当pH增大时,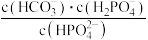 逐渐减小 逐渐减小 |
D. 的过程中,水的电离程度逐渐减小 的过程中,水的电离程度逐渐减小 |
更新时间:2022-09-14 16:25:33
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,向1L1.0mol·L-1的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2的物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法错误的是
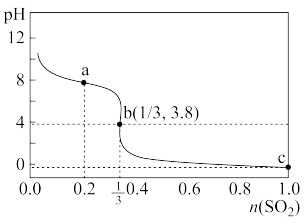

| A.常温下,HClO电离平衡常数的数量级为10—8 |
| B.水的电离程度:a>b>c |
C.b点溶液中:c(Cl—)+c(SO )=c(ClO—)+c(HClO) )=c(ClO—)+c(HClO) |
D.c点溶液中:c(Cl—)+c(ClO—)+2c(SO )+c(OH—)=c(H+)+c(Na+) )+c(OH—)=c(H+)+c(Na+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】室温下,向0.1mol/L的一元酸HA溶液中加入等浓度的NaOH溶液,相关组分的物质的量分数随溶液pH变化的曲线如图所示。下列说法正确的是


A.pH=4.75时,溶液中 | B.HA的电离常数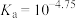 |
| C.水的电离程度:b>a>c | D.c点溶液中 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】常温下,向某二元弱酸 溶液中加入
溶液中加入 溶液调节溶液的
溶液调节溶液的 ,测得溶液中含R微粒占所有含R微粒的物质的量分数
,测得溶液中含R微粒占所有含R微粒的物质的量分数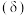 与溶液
与溶液 的关系如图所示。下列说法中错误的是
的关系如图所示。下列说法中错误的是

 溶液中加入
溶液中加入 溶液调节溶液的
溶液调节溶液的 ,测得溶液中含R微粒占所有含R微粒的物质的量分数
,测得溶液中含R微粒占所有含R微粒的物质的量分数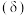 与溶液
与溶液 的关系如图所示。下列说法中错误的是
的关系如图所示。下列说法中错误的是
A. 溶液中, 溶液中, |
B.曲线②表示溶液中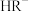 占所有含R微粒的物质的量分数的变化 占所有含R微粒的物质的量分数的变化 |
C.b点溶液中,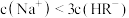 |
D.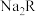 溶液中: 溶液中: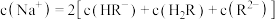 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】下列实验中,操作、现象及结论都正确,且有因果关系的是
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 溶液pH变大 | 稀释后, |
B | 取两支试管,分别加入2mL5%的双氧水,试管1中加入 | 试管1产生气泡快 | 加入 |
C | 向含有ZnS和 | 生成黑色沉淀 |
|
D | 用pH试纸分别测定同浓度 | 测得NaClO溶液pH大 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】25℃时,氢氰酸(HCN)的Ka=6.2×10-10,醋酸的Ka=1.75×10-5。下列说法正确的是
| A.25℃时,浓度相等的NaCN和HCN混合后,混合液呈酸性 |
| B.将浓度均为0.10mol·L-1的NaCN和HCN溶液加水稀释,两种溶液的pH均变大 |
| C.25℃时,HCN溶液中滴入醋酸溶液,则HCN的电离受到抑制 |
| D.25℃时,醋酸溶液中加一定量NaCN固体,调节pH=5,此时4c(CH3COO-)=7c(CH3COOH) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】氮及其化合物在生活和生产中占有重要的地位。肼( )是高能燃料,具有强还原性,溶于水生成的水合肼是二元弱碱,性质与
)是高能燃料,具有强还原性,溶于水生成的水合肼是二元弱碱,性质与 类似,常用作火箭发射的推进剂。常温下,
类似,常用作火箭发射的推进剂。常温下,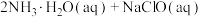
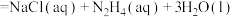 ,可用于生产
,可用于生产 。下列有关说法错误的是
。下列有关说法错误的是
 )是高能燃料,具有强还原性,溶于水生成的水合肼是二元弱碱,性质与
)是高能燃料,具有强还原性,溶于水生成的水合肼是二元弱碱,性质与 类似,常用作火箭发射的推进剂。常温下,
类似,常用作火箭发射的推进剂。常温下,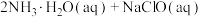
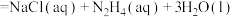 ,可用于生产
,可用于生产 。下列有关说法错误的是
。下列有关说法错误的是A.25℃时, 的 的 ,则2 ,则2 氨水中 氨水中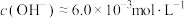 |
B.生产 时,向盛有NaClO溶液的烧瓶,逐滴加入氨水溶液,并用磁力器搅拌 时,向盛有NaClO溶液的烧瓶,逐滴加入氨水溶液,并用磁力器搅拌 |
C.推进剂反应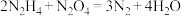 中,每生成标准状况下67.2L 中,每生成标准状况下67.2L  转移8mol电子 转移8mol电子 |
D. 与足量硫酸反应的化学方程式为 与足量硫酸反应的化学方程式为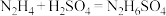 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】不能正确表示下列反应的离子方程式是
A.将少量氯气通入纯碱溶液中:Cl2+CO +H2O=Cl-+HCO +H2O=Cl-+HCO +HClO +HClO |
| B.将足量饱和Fe2(SO4)3溶液滴入Mg(OH)2浊液中:2Fe3++3Mg(OH)2=2Fe(OH)3+3Mg2+ |
C.向次氯酸钠溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO |
D.将少量溴水滴入过量Na2SO3溶液中:Br2+H2O+3SO =2Br-+2HSO =2Br-+2HSO +SO +SO |
您最近一年使用:0次

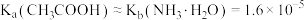 ,向10
,向10 浓度均为0.01
浓度均为0.01 的盐酸和醋酸的混合溶液中逐滴加入0.01
的盐酸和醋酸的混合溶液中逐滴加入0.01
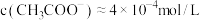
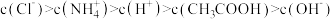
 溶液由
溶液由 稀释到
稀释到 ,测溶液pH
,测溶液pH 的水解程度增大
的水解程度增大 溶液2滴,试管2中加入
溶液2滴,试管2中加入
 时,双氧水分解反应的活化能较小
时,双氧水分解反应的活化能较小 的悬浊液中滴加
的悬浊液中滴加 溶液
溶液
 和NaClO溶液的pH
和NaClO溶液的pH 水解程度大于
水解程度大于
 在不同pH的
在不同pH的 (起始浓度为
(起始浓度为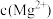 的变化。
的变化。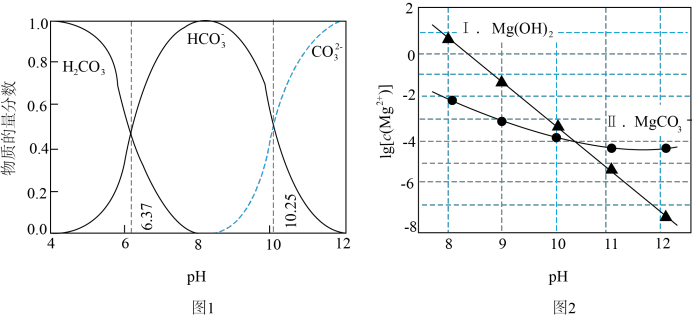
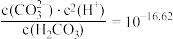
 时,一定存在
时,一定存在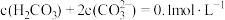
 、
、 ,无沉淀生成
,无沉淀生成 、
、 ,主要发生反应:
,主要发生反应: