我国科学家构建了新型催化剂“纳米片”(Co—N—C),该“纳米片“可用于氧化SO 和吸附Hg2+。回答下列问题:
和吸附Hg2+。回答下列问题:
(1)基态Co原子的价层电子排布式为___________ ,N、C、Co中第一电离能最大的是___________ (填元素符号)。
(2)在空气中SO 会被氧化成
会被氧化成 。
。 的空间构型是
的空间构型是___________ , 中S原子采用
中S原子采用___________ 杂化。
(3)氰气[(CN)2]称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则(CN)2分子中σ键、π键个数之比为___________ 。
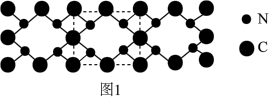
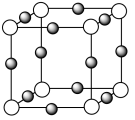
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如图1所示。它的化学式为___________ ,它的硬度超过金刚石的主要原因是___________ 。
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( ,
, ,
,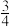 ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为___________ 。
 和吸附Hg2+。回答下列问题:
和吸附Hg2+。回答下列问题:(1)基态Co原子的价层电子排布式为
(2)在空气中SO
 会被氧化成
会被氧化成 。
。 的空间构型是
的空间构型是 中S原子采用
中S原子采用(3)氰气[(CN)2]称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则(CN)2分子中σ键、π键个数之比为
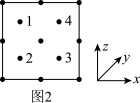
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如图1所示。它的化学式为

(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(
 ,
, ,
,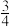 ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为
2022·福建·一模 查看更多[5]
(已下线)化学(福建B卷)-学易金卷:2023年高考第一次模拟考试浙江省舟山中学2022-2023学年高三上学期首考模拟卷(三)化学试题(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(15-19)(已下线)结构与性质甘肃省两县高中联考2023-2024学年高三上学期12月月考化学试题
更新时间:2022-12-15 11:16:57
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
【推荐1】腐蚀、防腐以及催化等化学化工过程都涉及金属纳米团簇的研究,团簇已经成为化学和材料研究的前沿和热点。金属纳米团簇最外层需要配体来稳定,常见有硫醇配体、磷配体和炔配体。卤素作为第二配体或第三配体,其体积比硫醇配体、磷配体和炔配体更小,在形成纳米团簇的过程中空间位阻更小,而且卤素与金、银具有较好的配位能力。
(1)银位于元素周期表第五周期第ⅠB族元素,其价电子排布式为______ 。
(2)金(Au)溶于王水的原理是金与强氧化性的硝酸生成微量的Au3+和NO,盐酸提供的Cl-与Au3+形成[AuCl4]-配离子,写出总反应的离子方程式:______ 。
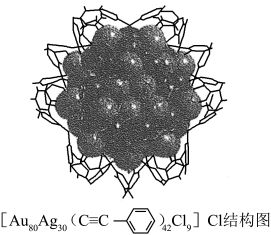
(3)[Au80Ag30(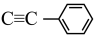 )42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是
)42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是______ 。
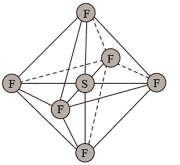
(4)第三周期部分主族元素的氟化物的熔点(见表)。
由表中数值可以判断AlF3晶体类型为_______ ,SiF4比SF6熔点低的原因______ ;SF6分子的空间构型为正八面体,如图所示,该分子的键角分别为______ ,它的二氯代物SF4Cl2有______ 种。
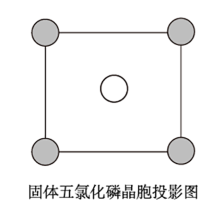
(5)固态五氯化磷为离子晶体,结构单元可以写作PCl 、PCl
、PCl ,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:
,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:______ ,若密度为dg/cm3,则晶胞参数a=_______ cm(已知阿伏加德罗常数的值为NA,列出计算式即可)
(1)银位于元素周期表第五周期第ⅠB族元素,其价电子排布式为
(2)金(Au)溶于王水的原理是金与强氧化性的硝酸生成微量的Au3+和NO,盐酸提供的Cl-与Au3+形成[AuCl4]-配离子,写出总反应的离子方程式:
(3)[Au80Ag30(
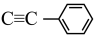 )42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是
)42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是
(4)第三周期部分主族元素的氟化物的熔点(见表)。
| 化合物 | NaF | AlF3 | SiF4 | SF6 |
| 熔点/℃ | 993 | 1040 | -90 | -50.5 |

(5)固态五氯化磷为离子晶体,结构单元可以写作PCl
 、PCl
、PCl ,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:
,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐2】配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。
(1)Cu+的基态核外电子排布式为___ 。
(2)BF 的空间构型为
的空间构型为___ ,与其互为等电子体的阴离子是___ 。
(3)C、N、B三种元素的电负性由小到大的顺序为___ 。
(4)[Cu(CH3CN)4]+中配位原子为___ 。
(5)Cu3N的晶胞结构如图所示,则N3-的配位数为___ 。
(1)Cu+的基态核外电子排布式为
(2)BF
 的空间构型为
的空间构型为(3)C、N、B三种元素的电负性由小到大的顺序为
(4)[Cu(CH3CN)4]+中配位原子为
(5)Cu3N的晶胞结构如图所示,则N3-的配位数为

您最近一年使用:0次
【推荐3】根据元素周期表中完整周期元素的性质,填写下列空白。
(1)第四周期元素中未成对电子数最多的元素符号是___________ ,其基态原子的简化电子排布式为___________ ,原子中所有电子占有___________ 个轨道,核外共有___________ 个不同运动状态的电子。
(2)杀虫剂 中阴离子的空间构型为
中阴离子的空间构型为___________ , 原子采取
原子采取___________ 杂化。
(3)用惰性电极电解第三周期原子半径最大的元素的氯化物的水溶液,其阳极反应的电极方程式为___________ 。电解一段时间后,阴极区
___________ (填“增大”、“减小”或“不变”)。
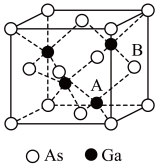
(4)原子晶体 的晶胞参数
的晶胞参数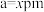 ,它的晶胞结构如图所示。该晶胞内部存在的共价键数为
,它的晶胞结构如图所示。该晶胞内部存在的共价键数为___________ ;该晶胞的密度为___________  。(阿伏加德罗常数用
。(阿伏加德罗常数用 表示,已知Ga:70As:75)。
表示,已知Ga:70As:75)。
(1)第四周期元素中未成对电子数最多的元素符号是
(2)杀虫剂
 中阴离子的空间构型为
中阴离子的空间构型为 原子采取
原子采取(3)用惰性电极电解第三周期原子半径最大的元素的氯化物的水溶液,其阳极反应的电极方程式为

(4)原子晶体
 的晶胞参数
的晶胞参数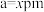 ,它的晶胞结构如图所示。该晶胞内部存在的共价键数为
,它的晶胞结构如图所示。该晶胞内部存在的共价键数为 。(阿伏加德罗常数用
。(阿伏加德罗常数用 表示,已知Ga:70As:75)。
表示,已知Ga:70As:75)。
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐1】原子序数小于等于36的Q、W、X、Y、Z五种元素,它们的原子序数依次增大,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含未成对电子数均为2,Z的基态原子核外电子有26种运动状态。回答下列问题(涉及元素时用对应的元素符号表示):
(1)Z的基态原子的电子排布式___________ ;从结构角度来看,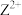 易被氧化成
易被氧化成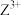 的原因是
的原因是___________ 。
(2)化合物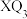 的沸点比化合物
的沸点比化合物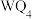 的高,其主要原因是
的高,其主要原因是___________ 。
(3)1molQWX与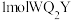 所含
所含 键数目之比为
键数目之比为___________ 。
(4)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为___________ 。
②预测该化合物熔点应___________ (填“高于”或“低于”)金刚石,理由是___________ 。
(5)写出少量Z单质和X的最高价氧化物的水化物的稀溶液反应的离子方程式:___________ 。
(1)Z的基态原子的电子排布式
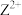 易被氧化成
易被氧化成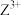 的原因是
的原因是(2)化合物
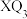 的沸点比化合物
的沸点比化合物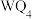 的高,其主要原因是
的高,其主要原因是(3)1molQWX与
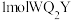 所含
所含 键数目之比为
键数目之比为(4)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为
②预测该化合物熔点应
(5)写出少量Z单质和X的最高价氧化物的水化物的稀溶液反应的离子方程式:
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】C、H、O、N是四种常见的非金属元素,其单质及化合物在诸多领域中都有广泛的应用。回答下列问题:
(1)基态碳原子的轨道表示式为___________ 。
(2)乙醇分子中碳原子的杂化方式为___________ ,1mol乙醇分子中含有 键的数目为
键的数目为___________ ( 为阿伏加德罗常数的值)。乙醇与水互溶,其原因是乙醇与水分子间形成氢键、
为阿伏加德罗常数的值)。乙醇与水互溶,其原因是乙醇与水分子间形成氢键、___________ 。
(3) 分子的空间构型为
分子的空间构型为___________ , 的键角
的键角___________ (填“>”或“<”) 的键角。
的键角。
(4)丙氨酸(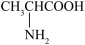 )是蛋白质中含量最高的α型氨基酸,该分子中含
)是蛋白质中含量最高的α型氨基酸,该分子中含___________ 个手性碳原子。
(1)基态碳原子的轨道表示式为
(2)乙醇分子中碳原子的杂化方式为
 键的数目为
键的数目为 为阿伏加德罗常数的值)。乙醇与水互溶,其原因是乙醇与水分子间形成氢键、
为阿伏加德罗常数的值)。乙醇与水互溶,其原因是乙醇与水分子间形成氢键、(3)
 分子的空间构型为
分子的空间构型为 的键角
的键角 的键角。
的键角。(4)丙氨酸(
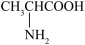 )是蛋白质中含量最高的α型氨基酸,该分子中含
)是蛋白质中含量最高的α型氨基酸,该分子中含
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:
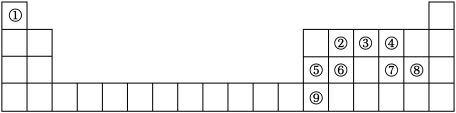
(1)⑤号元素基态原子最高能级的电子占据的原子轨道电子云轮廓为___________ 形。
(2)②③④号元素的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3)元素①②形成的一种化合物是石油化学工业重要的基本原料,写出该化合物中σ键与π键的数目之比为___________ 。
(4)元素⑦⑧可形成原子个数比为 的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式:
的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式:___________ 。
(5)元素③⑥形成的化合物是一种性质优良的无机非金属材料,具有熔点高,硬度大,电绝缘性好,化学性质稳定等性质,它的晶体类型是___________ 。
(6)元素⑨可形成的卤化物的熔点如表所示:
三种物质的熔点呈现以上规律的原因是___________ 。

(1)⑤号元素基态原子最高能级的电子占据的原子轨道电子云轮廓为
(2)②③④号元素的第一电离能由大到小的顺序为
(3)元素①②形成的一种化合物是石油化学工业重要的基本原料,写出该化合物中σ键与π键的数目之比为
(4)元素⑦⑧可形成原子个数比为
 的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式:
的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式:(5)元素③⑥形成的化合物是一种性质优良的无机非金属材料,具有熔点高,硬度大,电绝缘性好,化学性质稳定等性质,它的晶体类型是
(6)元素⑨可形成的卤化物的熔点如表所示:
| 卤化物 | 氟化物 | 氯化物 | 溴化物 |
| 熔点/℃ | 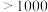 | 77.75 | 122.3 |
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】基于CH3NH3PbI3的有机-无机杂化钙钛矿被认为是下一代太阳能电池的可选材料之一、
(1)基态Pb原子中,电子占据的最高能级为___________ 。写出基态C原子的价电子排布图___________ 。
(2)合成CH3NH3PbI3需要使用的主要试剂有CH3NH2、HI、PbI2、DMF(结构如图所示)。
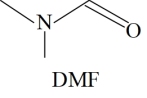
①PbI2分子的构型是___________ 。
②DMF中,N原子的杂化方式是___________ 。C、N、O三种元素第一电离能性从大到小的顺序是___________ 。DMF中存在的化学键键型不包括下列说法中的___________ (填序号)。
A. 极性键 B. 非极性键 C. 离子键 D. π键
(3)理想的钙钛矿晶胞如图所示
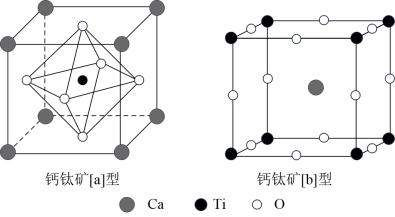
①从图中任意一种晶胞可确定钙钛矿的分子式是___________ ;
②设NA为阿伏加德罗常数的值,若已知钙钛矿[b]型的密度约为ρ g/cm3,则钙钛矿[b]型晶胞中两个O原子的最短距离是___________ nm。
(1)基态Pb原子中,电子占据的最高能级为
(2)合成CH3NH3PbI3需要使用的主要试剂有CH3NH2、HI、PbI2、DMF(结构如图所示)。

①PbI2分子的构型是
②DMF中,N原子的杂化方式是
A. 极性键 B. 非极性键 C. 离子键 D. π键
(3)理想的钙钛矿晶胞如图所示

①从图中任意一种晶胞可确定钙钛矿的分子式是
②设NA为阿伏加德罗常数的值,若已知钙钛矿[b]型的密度约为ρ g/cm3,则钙钛矿[b]型晶胞中两个O原子的最短距离是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐2】已知A、B、C、D、E、M是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是nsnnp2n;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。M是第四周期元素中未成对电子数最多的元素。
(1)请用元素符号完成下列空白。
①B、C、D、E四种元素中,简单离子半径最小的离子符号是___________ 。
②D、E两种元素的第一电离能___________ >___________ 。
(2)BC 的中心原子的价层电子对数为
的中心原子的价层电子对数为___________ ,VSEPR模型名称为___________ 。
(3)下表是A~M元素中某种元素的部分电离能,由此可判断该元素是___________ 。根据对角线规则,在短周期元素中,该元素的一些化学性质与元素___________ 的相似。
(4)某含M、Ca(钙)、O(氧)的化合物的立方晶胞如图所示。
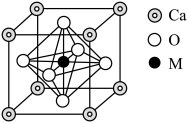
①M位于元素周期表的___________ 区,其基态原子的价层电子排布式为___________ 。
②该化合物的化学式是___________ 。
③Ca和M的最近距离为acm,晶体密度为ρg·cm-3.则阿伏加德罗常数(NA)为_______ mol-1(用代数式表示)。
(1)请用元素符号完成下列空白。
①B、C、D、E四种元素中,简单离子半径最小的离子符号是
②D、E两种元素的第一电离能
(2)BC
 的中心原子的价层电子对数为
的中心原子的价层电子对数为(3)下表是A~M元素中某种元素的部分电离能,由此可判断该元素是
| 某种元素 | 电离能I(kJ·mol-1) | ||||
| I1 | I2 | I3 | I4 | I5 | |
| 578 | 1817 | 2745 | 11575 | 14830 | |
(4)某含M、Ca(钙)、O(氧)的化合物的立方晶胞如图所示。

①M位于元素周期表的
②该化合物的化学式是
③Ca和M的最近距离为acm,晶体密度为ρg·cm-3.则阿伏加德罗常数(NA)为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】硼的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态硼原子的电子排布图为:_____ ;B、N、H的电负性由大到小的顺序为_____ 。
(2)科学家合成了一种含硼阴离子[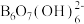 ],其结构如图1所示。其中硼原子的杂化方式为
],其结构如图1所示。其中硼原子的杂化方式为_______ ,该结构中共有_______ 种不同化学环境的氧原子。

图1
(3) 与
与 结合形成固态化合物
结合形成固态化合物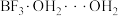 ,该物质在6.2℃时熔化电离出
,该物质在6.2℃时熔化电离出 和一种含硼阴离子
和一种含硼阴离子_______ (填离子符号); 空间构型为
空间构型为_______ 。
(1)基态硼原子的电子排布图为:
(2)科学家合成了一种含硼阴离子[
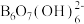 ],其结构如图1所示。其中硼原子的杂化方式为
],其结构如图1所示。其中硼原子的杂化方式为
图1
(3)
 与
与 结合形成固态化合物
结合形成固态化合物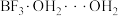 ,该物质在6.2℃时熔化电离出
,该物质在6.2℃时熔化电离出 和一种含硼阴离子
和一种含硼阴离子 空间构型为
空间构型为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】超分子笼PPC-2封装钌(Ru)纳米颗粒形成一种高效催化剂。PPC-2是由A、B、C三个组件拼装而成的正八面体超分子笼,结构示意如图。
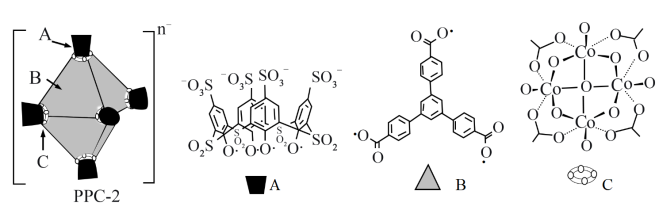
注:C组件中浅色原子由其他邻近组件提供。
(1)基态Co原子的价电子排布式为_______ 。
(2)组件A中所含四种元素的电负性由小到大的顺序为_______ 。
(3)组件B中碳原子的杂化类型为_______ 。
(4)组件C中Co原子位于相邻O原子构成的_______ 空隙中(填“四面体”或“八面体”)。
(5)每个组件C带一个单位负电荷,综合各组件所带电荷,计算PPC-2中n=_______ 。
(6)钌纳米颗粒进入PPC-2超分子笼后,钌晶体从六方堆积转化为面心立方堆积(晶胞参数为a pm)。超分子笼内钌晶体密度为_______ g·cm-3(用含a、NA的代数式表示)。

注:C组件中浅色原子由其他邻近组件提供。
(1)基态Co原子的价电子排布式为
(2)组件A中所含四种元素的电负性由小到大的顺序为
(3)组件B中碳原子的杂化类型为
(4)组件C中Co原子位于相邻O原子构成的
(5)每个组件C带一个单位负电荷,综合各组件所带电荷,计算PPC-2中n=
(6)钌纳米颗粒进入PPC-2超分子笼后,钌晶体从六方堆积转化为面心立方堆积(晶胞参数为a pm)。超分子笼内钌晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】钠离子电池是被认为在基于电网的储能系统中最具发展前景,双金属硫化物 空心纳米棒将有助于提高钠离子电池性能。回答下列问题:
空心纳米棒将有助于提高钠离子电池性能。回答下列问题:
(1) 位于第五周期,与N同主族,基态
位于第五周期,与N同主族,基态 的价电子排布图(轨道表达式)为
的价电子排布图(轨道表达式)为___________ ,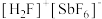 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 的空间构型为
的空间构型为___________ ,与 具有相同空间构型和键合形式的阴离子为
具有相同空间构型和键合形式的阴离子为___________ 。
(2) Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是___________ ,第一电离能由大到小的顺序是___________ 。
(3)与S同主族的元素有O、Se、Te等,它们氢化物的沸点大小为 ,其原因是
,其原因是___________ 。
(4)已知: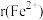 为
为 ,
, 为
为 。在隔绝空气条件下分别加热
。在隔绝空气条件下分别加热 和
和 ,实验测得
,实验测得 的分解温度低于
的分解温度低于 ,原因是
,原因是___________ 。
(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为___________ ;已知该晶体的密度为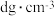 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
___________  (用含d和
(用含d和 的代数式表示)。
的代数式表示)。

 空心纳米棒将有助于提高钠离子电池性能。回答下列问题:
空心纳米棒将有助于提高钠离子电池性能。回答下列问题:(1)
 位于第五周期,与N同主族,基态
位于第五周期,与N同主族,基态 的价电子排布图(轨道表达式)为
的价电子排布图(轨道表达式)为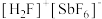 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 的空间构型为
的空间构型为 具有相同空间构型和键合形式的阴离子为
具有相同空间构型和键合形式的阴离子为(2) Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是
(3)与S同主族的元素有O、Se、Te等,它们氢化物的沸点大小为
 ,其原因是
,其原因是(4)已知:
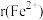 为
为 ,
, 为
为 。在隔绝空气条件下分别加热
。在隔绝空气条件下分别加热 和
和 ,实验测得
,实验测得 的分解温度低于
的分解温度低于 ,原因是
,原因是(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为
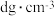 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
 (用含d和
(用含d和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】(1)2019年诺贝尔化学奖颁给了三位在锂电池领域做出突出贡献的科学家。
①基态锂原子核外有________ 种不同空间运动状态的电子。
②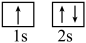 状态的锂到
状态的锂到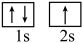 状态的锂所得的原子光谱是
状态的锂所得的原子光谱是________ 光谱。
③锂和铍相比,锂的第Ⅱ电离能________ (填“>”“<”或“=”)铍的第Ⅱ电离能。
(2)某锂离子电池的正极材料为 。
。
①基态 原子价层电子的电子排布图(轨道表达式)是
原子价层电子的电子排布图(轨道表达式)是________ 。
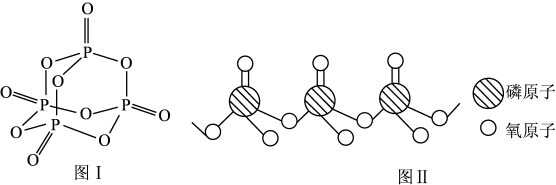
②磷元素是生物体不可缺少的元素之一,把一种填有 的苏打石灰玻璃移植到体内,钙离子和磷酸根离子在玻璃和骨头的间隙中溶出,有助于诱导新的骨骼生成。
的苏打石灰玻璃移植到体内,钙离子和磷酸根离子在玻璃和骨头的间隙中溶出,有助于诱导新的骨骼生成。 的结构如图I所示,其中
的结构如图I所示,其中 原子的杂化方式是
原子的杂化方式是________ , 是
是________ (填“极性”或“非极性”)分子。
③ 原子形成的含氧酸有很多种结构,图Ⅱ是某种多聚磷酸根的结构示意图。这种多聚磷酸的化学式为
原子形成的含氧酸有很多种结构,图Ⅱ是某种多聚磷酸根的结构示意图。这种多聚磷酸的化学式为________ (用 表示磷原子的个数)。
表示磷原子的个数)。
(3)某锂电池负极材料晶体中 嵌入两层石墨层中导致石墨堆积方式发生改变,形成如图Ⅲ所示的晶体结构。
嵌入两层石墨层中导致石墨堆积方式发生改变,形成如图Ⅲ所示的晶体结构。

①石墨是一种导体,但石墨的导电性只能沿石墨平面的方向,原因是________ 。
②已知最近碳一碳原子间的距离是 ,则最近锂一锂离子间的距离是
,则最近锂一锂离子间的距离是________  ;石墨层之间的距离是
;石墨层之间的距离是 (其中
(其中 ),
), 表示阿伏加 德罗常数的值,该晶体的密度是
表示阿伏加 德罗常数的值,该晶体的密度是________  (列出计算式即可)。
(列出计算式即可)。
①基态锂原子核外有
②
 状态的锂到
状态的锂到 状态的锂所得的原子光谱是
状态的锂所得的原子光谱是③锂和铍相比,锂的第Ⅱ电离能
(2)某锂离子电池的正极材料为
 。
。①基态
 原子价层电子的电子排布图(轨道表达式)是
原子价层电子的电子排布图(轨道表达式)是②磷元素是生物体不可缺少的元素之一,把一种填有
 的苏打石灰玻璃移植到体内,钙离子和磷酸根离子在玻璃和骨头的间隙中溶出,有助于诱导新的骨骼生成。
的苏打石灰玻璃移植到体内,钙离子和磷酸根离子在玻璃和骨头的间隙中溶出,有助于诱导新的骨骼生成。 的结构如图I所示,其中
的结构如图I所示,其中 原子的杂化方式是
原子的杂化方式是 是
是③
 原子形成的含氧酸有很多种结构,图Ⅱ是某种多聚磷酸根的结构示意图。这种多聚磷酸的化学式为
原子形成的含氧酸有很多种结构,图Ⅱ是某种多聚磷酸根的结构示意图。这种多聚磷酸的化学式为 表示磷原子的个数)。
表示磷原子的个数)。
(3)某锂电池负极材料晶体中
 嵌入两层石墨层中导致石墨堆积方式发生改变,形成如图Ⅲ所示的晶体结构。
嵌入两层石墨层中导致石墨堆积方式发生改变,形成如图Ⅲ所示的晶体结构。
①石墨是一种导体,但石墨的导电性只能沿石墨平面的方向,原因是
②已知最近碳一碳原子间的距离是
 ,则最近锂一锂离子间的距离是
,则最近锂一锂离子间的距离是 ;石墨层之间的距离是
;石墨层之间的距离是 (其中
(其中 ),
), 表示阿伏加 德罗常数的值,该晶体的密度是
表示阿伏加 德罗常数的值,该晶体的密度是 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次



