回答下列问题:
(1)有下列四种溶液①CH3COOH②HCl③H2SO4④NaHSO4。若四种溶液的c(H+)相同,其物质的量浓度的大小比较为___________ 。(用序号表示)。
(2)取0.1mol/LCH3COOH溶液,经测定溶液中c(CH3COO-)为 ,此温度下醋酸的电离常数Ka=
,此温度下醋酸的电离常数Ka=___________ 。
(3)将AlCl3溶液进行蒸干,得到的固体化学式为___________
(4)在日常生活中经常用Al2(SO4)3和NaHCO3混合溶液作灭火剂,请用离子方程式表示其灭火原理:___________
(5)常温下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为___________ 。
(6)某CuSO4溶液中含有Fe3+杂质,溶液中CuSO4的浓度为2.0mol/L,通常认为残留在溶液中的离子浓度小于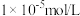 时即沉淀完全(注:lg2=0.3),已知
时即沉淀完全(注:lg2=0.3),已知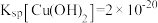 ,
,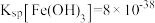 ,则:
,则:
①该溶液中的Fe3+刚好沉淀完全时溶液的pH为___________ ;
②该溶液中的Cu2+开始形成Cu(OH)2沉淀时的pH为___________ ;
(7)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________
(1)有下列四种溶液①CH3COOH②HCl③H2SO4④NaHSO4。若四种溶液的c(H+)相同,其物质的量浓度的大小比较为
(2)取0.1mol/LCH3COOH溶液,经测定溶液中c(CH3COO-)为
 ,此温度下醋酸的电离常数Ka=
,此温度下醋酸的电离常数Ka=(3)将AlCl3溶液进行蒸干,得到的固体化学式为
(4)在日常生活中经常用Al2(SO4)3和NaHCO3混合溶液作灭火剂,请用离子方程式表示其灭火原理:
(5)常温下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(6)某CuSO4溶液中含有Fe3+杂质,溶液中CuSO4的浓度为2.0mol/L,通常认为残留在溶液中的离子浓度小于
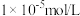 时即沉淀完全(注:lg2=0.3),已知
时即沉淀完全(注:lg2=0.3),已知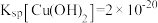 ,
,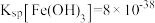 ,则:
,则:①该溶液中的Fe3+刚好沉淀完全时溶液的pH为
②该溶液中的Cu2+开始形成Cu(OH)2沉淀时的pH为
(7)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
更新时间:2022-12-09 08:11:28
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】(I)常温下,有四种溶液:①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液 ④0.1 mol·L-1 NaHCO3溶液
(1)溶液②呈___________ (填“酸”“碱”或“中”)性。其原因___________ (用离子方程式说明)。
(2)下列有关①和②两种溶液的说法正确的是___________ (填字母)。
a.两种溶液中c(CH3COO-)都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
(3)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3中HSO 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是___________ (填字母)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(II)已知25 ℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。使20 mL 0.10 mol·L-1的CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与20 mL 0.10 mol·L-1的NaHCO3溶液反应。
(4)反应结束后,所得溶液中c(SCN-)___________ (填“>”“=”或“<”)c(CH3COO-)。
(5)现有2.0×10-3 mol·L-1的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),测得25 ℃时平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示:
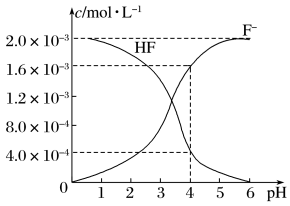
25 ℃时,HF的电离平衡常数Ka(HF)=___________ 。
(6)已知:25 ℃时,HCOOH的电离平衡常数K=1.77×10-4,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法正确的是___________(填字母)。
(1)溶液②呈
(2)下列有关①和②两种溶液的说法正确的是
a.两种溶液中c(CH3COO-)都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-)都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
(3)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3中HSO
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(II)已知25 ℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。使20 mL 0.10 mol·L-1的CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与20 mL 0.10 mol·L-1的NaHCO3溶液反应。
(4)反应结束后,所得溶液中c(SCN-)
(5)现有2.0×10-3 mol·L-1的氢氟酸溶液,调节溶液pH(忽略调节时体积变化),测得25 ℃时平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示:

25 ℃时,HF的电离平衡常数Ka(HF)=
(6)已知:25 ℃时,HCOOH的电离平衡常数K=1.77×10-4,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。下列说法正确的是___________(填字母)。
| A.向Na2CO3溶液中加入甲酸溶液无明显现象产生 |
| B.25 ℃时,向甲酸溶液中加入NaOH溶液,甲酸的电离程度和K均增大 |
C.向0.1 mol·L-1甲酸溶液中加入蒸馏水, 增大 增大 |
D.向碳酸中加入NaHCO3固体,溶液的pH、溶液中c(HCO )均增大 )均增大 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】金属钒在新能源动力电池中有重要作用。含钒尖晶石是钒渣中最主要的含钒物相,其主要成分有V2O3、FeO、Fe2O3、Al2O3、SiO2,采用以下工艺流程制备V2O5。
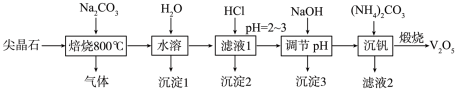
已知:溶液的酸性较强时,+5价钒主要以 的形式存在。
的形式存在。
(1)“焙烧”过程中被氧化的元素是___________ 。
(2)“焙烧"时,V2O3与Na2CO3反应的化学方程式是___________ 。
(3)“沉淀1”的成分是___________ 。
(4)“沉淀2”加热分解后固体产物的用途___________ (任写一种)。
(5)“沉钒”析出NH4VO3晶体时,需要加入过量(NH4)2CO3,其原因_____ (结合平衡移动原理解释)。
(6)沉钒过程中,沉钒率随溶液pH的变化如图1所示。沉钒率随溶液pH的增加先升高后降低的原因可能是___________ 。

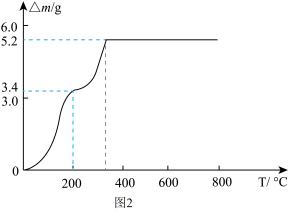
(7)取23.4 g NH4VO3固体加热时,固体减少的质量(△m)随温度的变化曲线如图2所示。加热到200℃时,产生气体的分子式是___________ 。

已知:溶液的酸性较强时,+5价钒主要以
 的形式存在。
的形式存在。(1)“焙烧”过程中被氧化的元素是
(2)“焙烧"时,V2O3与Na2CO3反应的化学方程式是
(3)“沉淀1”的成分是
(4)“沉淀2”加热分解后固体产物的用途
(5)“沉钒”析出NH4VO3晶体时,需要加入过量(NH4)2CO3,其原因
(6)沉钒过程中,沉钒率随溶液pH的变化如图1所示。沉钒率随溶液pH的增加先升高后降低的原因可能是

(7)取23.4 g NH4VO3固体加热时,固体减少的质量(△m)随温度的变化曲线如图2所示。加热到200℃时,产生气体的分子式是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
①CH3CH2OH(g)+1/2O2(g) CH3CHO(g)+H2O(g) ΔH1=
CH3CHO(g)+H2O(g) ΔH1=________ 。
②若反应2CH3CHO(g)+O2(g)⇌2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)⇌CH3COOH(g)+H2O(g) ΔH2________ (填“>”“<”或“=”)0。
(2)将一定量的CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)⇌2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是________ (填字母)。

(3)已知:25 ℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.75×10-5,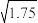 ≈1.3,lg 1.3≈0.1。
≈1.3,lg 1.3≈0.1。
①25 ℃,0.1 mol·L-1CH3COOH溶液的pH=______ ;将0.1 mol·L-1CH3COOH溶液与0.1 mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为_______________________________ 。
②25 ℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=________ 。(保留2位有效数字)
③25 ℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O⇌NH4++OH-的电离平衡________ (填“正向”“逆向”或“不”)移动;请用氨水和某种铵盐(其他试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质____________________________________ 。
(1)在一定温度和压强下,已知:
| 化学键 | C—H | C—O | O—H | C===O | O===O | C—C |
| 键能/(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)
 CH3CHO(g)+H2O(g) ΔH1=
CH3CHO(g)+H2O(g) ΔH1=②若反应2CH3CHO(g)+O2(g)⇌2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)⇌CH3COOH(g)+H2O(g) ΔH2
(2)将一定量的CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)⇌2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是

(3)已知:25 ℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.75×10-5,
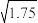 ≈1.3,lg 1.3≈0.1。
≈1.3,lg 1.3≈0.1。①25 ℃,0.1 mol·L-1CH3COOH溶液的pH=
②25 ℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=
③25 ℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O⇌NH4++OH-的电离平衡
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收
进行氯化处理以回收 、
、 等金属,工艺路线如图所示。
等金属,工艺路线如图所示。

已知: 易水解,水解时产生大量烟雾。
易水解,水解时产生大量烟雾。
回答下列问题:
(1)烧渣是 、
、 和
和 的混合物,“500℃焙烧”时发生反应的化学方程式为
的混合物,“500℃焙烧”时发生反应的化学方程式为___________ 。
(2)水浸前,先除去“500℃焙烧”时剩余的 的原因是
的原因是___________ 。
(3)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入 ,将温度升至90℃是为了提高沉淀反应速率和
,将温度升至90℃是为了提高沉淀反应速率和___________ 。得到碳酸锂沉淀的操作为___________ (填字母)。

a.静置,过滤 b.加热后,趁热过滤
c.蒸发浓缩、冷却结晶 d.蒸发结晶
(4)写出“850℃煅烧”时发生反应的化学方程式:___________ 。
(5)取100mL滤液2,其中 ,为使锂元素的回收率不低于70%,则至少应加入
,为使锂元素的回收率不低于70%,则至少应加入 固体的质量为
固体的质量为___________ g[已知 ]。
]。
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收
进行氯化处理以回收 、
、 等金属,工艺路线如图所示。
等金属,工艺路线如图所示。
已知:
 易水解,水解时产生大量烟雾。
易水解,水解时产生大量烟雾。回答下列问题:
(1)烧渣是
 、
、 和
和 的混合物,“500℃焙烧”时发生反应的化学方程式为
的混合物,“500℃焙烧”时发生反应的化学方程式为(2)水浸前,先除去“500℃焙烧”时剩余的
 的原因是
的原因是(3)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入
 ,将温度升至90℃是为了提高沉淀反应速率和
,将温度升至90℃是为了提高沉淀反应速率和
a.静置,过滤 b.加热后,趁热过滤
c.蒸发浓缩、冷却结晶 d.蒸发结晶
(4)写出“850℃煅烧”时发生反应的化学方程式:
(5)取100mL滤液2,其中
 ,为使锂元素的回收率不低于70%,则至少应加入
,为使锂元素的回收率不低于70%,则至少应加入 固体的质量为
固体的质量为 ]。
]。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】碳元素可以形成数量丰富的化合物,如CO与 等氧化物,
等氧化物, 、
、 、
、 等无机弱酸及
等无机弱酸及 、
、 等无机盐。回答下列问题:
等无机盐。回答下列问题:
已知25℃时, 、
、 、
、 的电离平衡常数如下表。
的电离平衡常数如下表。
(1)25℃时,当 溶液中
溶液中 时,试求该溶液的
时,试求该溶液的
___________ ,由水电离出的
___________  。
。
(2)将少量 通入
通入 溶液中,发生反应的化学方程式为
溶液中,发生反应的化学方程式为___________ 。
(3)该同学认为在 溶液中存在三种可逆反应,分别是:
溶液中存在三种可逆反应,分别是:
①___________ 、 、
、 。
。
②经计算得出25℃时, 的
的 溶液呈碱性,请通过计算得出结论,写出过程:
溶液呈碱性,请通过计算得出结论,写出过程:___________ 。
③为继续探究溶液中存在 的电离:取
的电离:取 的
的 溶液
溶液 ,滴加6滴
,滴加6滴 溶液时(忽略溶液体积变化,
溶液时(忽略溶液体积变化, 大约是30滴)刚好出现白色沉淀,溶液中
大约是30滴)刚好出现白色沉淀,溶液中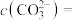
___________  (
( 的
的 ),继续滴加
),继续滴加 溶液沉淀增多同时有气体产生,写出反应的离子方程式
溶液沉淀增多同时有气体产生,写出反应的离子方程式___________ 。
(4)将 溶液与
溶液与 溶液等体积混合,则溶液中离子浓度由大到小的顺序为
溶液等体积混合,则溶液中离子浓度由大到小的顺序为___________ 。
 等氧化物,
等氧化物, 、
、 、
、 等无机弱酸及
等无机弱酸及 、
、 等无机盐。回答下列问题:
等无机盐。回答下列问题:已知25℃时,
 、
、 、
、 的电离平衡常数如下表。
的电离平衡常数如下表。 |  |  | |
 | 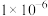 |  | 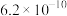 |
 | 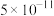 | 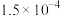 |
 溶液中
溶液中 时,试求该溶液的
时,试求该溶液的

 。
。(2)将少量
 通入
通入 溶液中,发生反应的化学方程式为
溶液中,发生反应的化学方程式为(3)该同学认为在
 溶液中存在三种可逆反应,分别是:
溶液中存在三种可逆反应,分别是:①
 、
、 。
。②经计算得出25℃时,
 的
的 溶液呈碱性,请通过计算得出结论,写出过程:
溶液呈碱性,请通过计算得出结论,写出过程:③为继续探究溶液中存在
 的电离:取
的电离:取 的
的 溶液
溶液 ,滴加6滴
,滴加6滴 溶液时(忽略溶液体积变化,
溶液时(忽略溶液体积变化, 大约是30滴)刚好出现白色沉淀,溶液中
大约是30滴)刚好出现白色沉淀,溶液中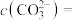
 (
( 的
的 ),继续滴加
),继续滴加 溶液沉淀增多同时有气体产生,写出反应的离子方程式
溶液沉淀增多同时有气体产生,写出反应的离子方程式(4)将
 溶液与
溶液与 溶液等体积混合,则溶液中离子浓度由大到小的顺序为
溶液等体积混合,则溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】水是一种很好的溶剂,也是物质发生化学反应的主要介质。大自然的馈赠——喀斯特地貌即是因化学反应经千万年而形成的。水中世界千千万,它与我们的生活、生产密切相关,请用所学知识,解决下列问题。
(1)常温下,有 的四种溶液:①
的四种溶液:① ②
② ③
③ ④
④
a.任选上述一种酸性溶液,用化学用语解释其呈酸性的原因___________ 。
b.溶液①中由水电离出的氢氧根离子浓度为___________  。
。
c.溶液①、③等体积混合后,溶液中
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)在某温度(T℃)的水溶液中, ,
, ,x与y关系如图所示。
,x与y关系如图所示。
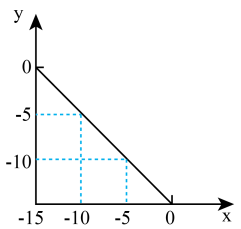
该温度下,水的离子积为___________ ,T℃___________ 25℃(填“>”“<”或“=”)。将此温度下 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的 约为
约为___________ (已知 )
)
(3)已知部分弱酸的电离常数如表:
则:① 溶液和
溶液和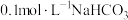 溶液中,
溶液中,
___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
②常温下, 相同的三种溶液:a.
相同的三种溶液:a. 、b.
、b. 、c.
、c. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是___________ (填序号)
③将少量 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是___________ 。
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有 和
和 ,欲常温时使
,欲常温时使 完全沉淀[c(Fe3+)≤4×10-5mol/L]而
完全沉淀[c(Fe3+)≤4×10-5mol/L]而 不沉淀,则需控制溶液
不沉淀,则需控制溶液 的范围为
的范围为___________ 。[已知: ;
; ]
]
(1)常温下,有
 的四种溶液:①
的四种溶液:① ②
② ③
③ ④
④
a.任选上述一种酸性溶液,用化学用语解释其呈酸性的原因
b.溶液①中由水电离出的氢氧根离子浓度为
 。
。c.溶液①、③等体积混合后,溶液中

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)在某温度(T℃)的水溶液中,
 ,
, ,x与y关系如图所示。
,x与y关系如图所示。
该温度下,水的离子积为
 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的 约为
约为 )
)(3)已知部分弱酸的电离常数如表:
| 弱酸 |  |  |  |
| 电离常数(25℃) |  | 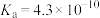 | 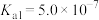  |
 溶液和
溶液和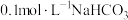 溶液中,
溶液中,
 (填“>”“<”或“=”)
(填“>”“<”或“=”)②常温下,
 相同的三种溶液:a.
相同的三种溶液:a. 、b.
、b. 、c.
、c. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是③将少量
 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有
 和
和 ,欲常温时使
,欲常温时使 完全沉淀[c(Fe3+)≤4×10-5mol/L]而
完全沉淀[c(Fe3+)≤4×10-5mol/L]而 不沉淀,则需控制溶液
不沉淀,则需控制溶液 的范围为
的范围为 ;
; ]
]
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】请回答下列问题:
(1)25℃时,pH=5的CH3COOH溶液中.加入少量NaOH固体,则溶液中
_______ (填“增大”、“减小”或“不变”)。
(2)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
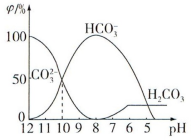
①在同一溶液中H2CO3、HCO3-、CO32-______ (填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________ 。溶液中各种离子的物质的量浓度大小关系为___________________________ 。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh值为
HCO3-+OH-的平衡常数Kh值为_________ 。
(3)生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
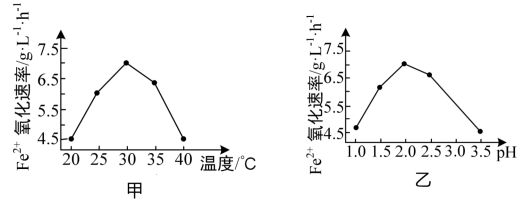
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是___________ 。
②由图甲和图乙判断使用硫杆菌的最佳条件为____________ 。在最佳条件下,该反应的加热
方式为_________ 。
(1)25℃时,pH=5的CH3COOH溶液中.加入少量NaOH固体,则溶液中

(2)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中H2CO3、HCO3-、CO32-
②当pH =7时,溶液中含碳元素的微粒主要为
③反应的CO32-+H2O
 HCO3-+OH-的平衡常数Kh值为
HCO3-+OH-的平衡常数Kh值为(3)生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4
 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是
②由图甲和图乙判断使用硫杆菌的最佳条件为
方式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种酸式盐,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成,D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答:

(1)X与B反应的离子方程式为_________________________ 。
(2)D溶液pH值大于7,原因是(用离子方程式表示)_______________ 。
(3)写出C与过量B反应(加热)的离子方程式__________________________ 。
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序_____________________ 。
(5)Y在同主族的同类物质中分子稳定性最强( ) ,也是沸点最高的( ) 。(判断正误填"是"或"否")
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1mol H2O时的反应热分别为△H1 ,△H2,△H3 ,则三者由大到小排序为:___________________ 。

(1)X与B反应的离子方程式为
(2)D溶液pH值大于7,原因是(用离子方程式表示)
(3)写出C与过量B反应(加热)的离子方程式
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序
(5)Y在同主族的同类物质中分子稳定性最强
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1mol H2O时的反应热分别为△H1 ,△H2,△H3 ,则三者由大到小排序为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】用化学知识填空:
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g)===CH4(g)+C2H2(g)+H2(g) ΔH1=+156.6 kJ·mol-1
②C3H6(g)===CH4(g)+C2H2(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)===C3H6(g)+H2(g)的ΔH=__________ kJ·mol-1。
(2)0.5mol甲烷燃烧时,生成液态水和二氧化碳,同时放出445kJ的热量,写出甲烷的燃烧热的热化学方程式_________________________________________________
(3)请写出NH4Cl溶液中各离子浓度的大小关系式:___________________________________
(4)常温下,Na2CO3溶液呈碱性,原因是_____________________ (用离子方程式表示)。
(5)①醋酸在水溶液中的电离方程式为______________________ 。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________ (填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g)===CH4(g)+C2H2(g)+H2(g) ΔH1=+156.6 kJ·mol-1
②C3H6(g)===CH4(g)+C2H2(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)===C3H6(g)+H2(g)的ΔH=
(2)0.5mol甲烷燃烧时,生成液态水和二氧化碳,同时放出445kJ的热量,写出甲烷的燃烧热的热化学方程式
(3)请写出NH4Cl溶液中各离子浓度的大小关系式:
(4)常温下,Na2CO3溶液呈碱性,原因是
(5)①醋酸在水溶液中的电离方程式为
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
您最近一年使用:0次



