为了解决能源的可再生及将 变废为宝等问题科学家借鉴自然界的光合作用原理通过“人工”光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如图甲所示。请回答:
变废为宝等问题科学家借鉴自然界的光合作用原理通过“人工”光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如图甲所示。请回答:
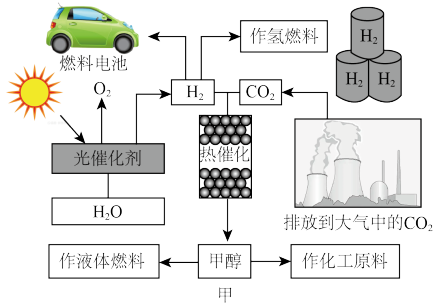
(1)联系自然界的光合作用原理,并结合图甲,写出“人工”光合作用的化学方程式:___________ ;在图示转化过程中,太阳能除了储存在甲醇中,还储存在___________ (填化学式)中。
(2)图中热催化过程的反应原理为 。已知:2H2 +O2 (g)= 2H2O(g) △H1= -483.6kJ/mol ;2CH3OH(g) + 3O2 (g)
。已知:2H2 +O2 (g)= 2H2O(g) △H1= -483.6kJ/mol ;2CH3OH(g) + 3O2 (g)  2CO2(g) + 4H2O(g) △H2= -1352.86kJ/mol,则可求得
2CO2(g) + 4H2O(g) △H2= -1352.86kJ/mol,则可求得
___________ 。
(3)已知H﹣H键能为436KJ/mol,H﹣N键能为391KJ/mol,根据化学方程式:N2(g)+3H2(g)=2NH3(g)△H=﹣92KJ/mol,则N≡N键的键能是___________ 。
(4)已知反应:HCl(g)= H2(g)+
H2(g)+  Cl2(g)△H=+92.3kJ•mol﹣1, 则反应H2(g)+Cl2(g)=2HCl(g)的△H为
Cl2(g)△H=+92.3kJ•mol﹣1, 则反应H2(g)+Cl2(g)=2HCl(g)的△H为___________ 。
 变废为宝等问题科学家借鉴自然界的光合作用原理通过“人工”光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如图甲所示。请回答:
变废为宝等问题科学家借鉴自然界的光合作用原理通过“人工”光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如图甲所示。请回答:
(1)联系自然界的光合作用原理,并结合图甲,写出“人工”光合作用的化学方程式:
(2)图中热催化过程的反应原理为
 。已知:2H2 +O2 (g)= 2H2O(g) △H1= -483.6kJ/mol ;2CH3OH(g) + 3O2 (g)
。已知:2H2 +O2 (g)= 2H2O(g) △H1= -483.6kJ/mol ;2CH3OH(g) + 3O2 (g)  2CO2(g) + 4H2O(g) △H2= -1352.86kJ/mol,则可求得
2CO2(g) + 4H2O(g) △H2= -1352.86kJ/mol,则可求得
(3)已知H﹣H键能为436KJ/mol,H﹣N键能为391KJ/mol,根据化学方程式:N2(g)+3H2(g)=2NH3(g)△H=﹣92KJ/mol,则N≡N键的键能是
(4)已知反应:HCl(g)=
 H2(g)+
H2(g)+  Cl2(g)△H=+92.3kJ•mol﹣1, 则反应H2(g)+Cl2(g)=2HCl(g)的△H为
Cl2(g)△H=+92.3kJ•mol﹣1, 则反应H2(g)+Cl2(g)=2HCl(g)的△H为
更新时间:2022-12-28 18:03:55
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】我国提出2030年实现“碳达峰”,2060年实现“碳中和”, 的再利用成为热门话题。回答下列问题:
的再利用成为热门话题。回答下列问题:
Ⅰ.光热化学循环分解 为CO和
为CO和 的反应为温室气体减排提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示。
的反应为温室气体减排提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示。
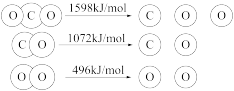
(1)已知: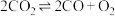 ,根据数据计算,分解
,根据数据计算,分解 需吸收
需吸收_______ kJ的能量。
Ⅱ.工业上可用 来生产燃料甲醇
来生产燃料甲醇 ,实验室模拟该过程,在体积为2L的密闭容器中,充入
,实验室模拟该过程,在体积为2L的密闭容器中,充入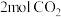 和
和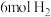 ,一定条件下发生反应:
,一定条件下发生反应: ,测得
,测得 和
和 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
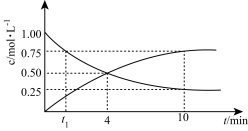
(2) 时刻,正、逆反应速率大小:v(正)
时刻,正、逆反应速率大小:v(正)_______ v(逆)(填“>”“=”或“<”),在0min到4min时间段,
_______  。
。
(3)下列措施能增大反应速率的是_______ (填字母)。
a.升高温度 b.扩大容器体积
c.充入一定量氦气 d.加入催化剂
(4)能说明上述反应达到平衡状态的是_______ (填字母)。
a.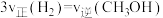
b. 的物质的量不再变化
的物质的量不再变化
c.容器内气体的总质量保持不变
d.单位时间内,每生成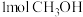 ,同时生成
,同时生成
e.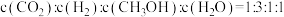
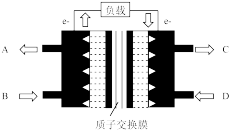
(5) 可以作燃料电池,工作原理如图。电池放电时,应从
可以作燃料电池,工作原理如图。电池放电时,应从_______ (填“B”或“D”)通入 ,该电极发生
,该电极发生_______ 反应(填“氧化”或“还原”),理论上每消耗 转移
转移_______ mol电子。
 的再利用成为热门话题。回答下列问题:
的再利用成为热门话题。回答下列问题:Ⅰ.光热化学循环分解
 为CO和
为CO和 的反应为温室气体减排提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示。
的反应为温室气体减排提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示。
(1)已知:
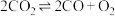 ,根据数据计算,分解
,根据数据计算,分解 需吸收
需吸收Ⅱ.工业上可用
 来生产燃料甲醇
来生产燃料甲醇 ,实验室模拟该过程,在体积为2L的密闭容器中,充入
,实验室模拟该过程,在体积为2L的密闭容器中,充入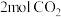 和
和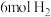 ,一定条件下发生反应:
,一定条件下发生反应: ,测得
,测得 和
和 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
(2)
 时刻,正、逆反应速率大小:v(正)
时刻,正、逆反应速率大小:v(正)
 。
。(3)下列措施能增大反应速率的是
a.升高温度 b.扩大容器体积
c.充入一定量氦气 d.加入催化剂
(4)能说明上述反应达到平衡状态的是
a.
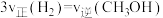
b.
 的物质的量不再变化
的物质的量不再变化c.容器内气体的总质量保持不变
d.单位时间内,每生成
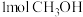 ,同时生成
,同时生成
e.
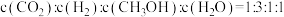
(5)
 可以作燃料电池,工作原理如图。电池放电时,应从
可以作燃料电池,工作原理如图。电池放电时,应从 ,该电极发生
,该电极发生 转移
转移
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】研究化学反应的能量变化和速率变化是研究化学反应的重要角度。
(1)化学反应中能量变化的主要原因是___________ 。
(2)由天然气和水反应制备氢气: ,该反应过程中能量变化如下图所示,则该反应为
,该反应过程中能量变化如下图所示,则该反应为___________ (填“吸热”或“放热”)反应。已知破坏1 mol化学键需要吸收的热量如表所示,则该反应吸收或放出的热量为___________ kJ(用含a、b、c、d的代数式表示)。
(3)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是___________。
(4)在容积不变的10 L密闭容器中进行如下反应: ,开始时A的物质的量为3 mol B的物质的量为5 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率
,开始时A的物质的量为3 mol B的物质的量为5 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率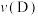 为0.02 mol/(L·min)。
为0.02 mol/(L·min)。
①5 min末A的物质的量浓度为___________ 。
②前5 min内用B表示的化学反应速率 为
为___________
③化学方程式中n的值为___________ 。
(1)化学反应中能量变化的主要原因是
(2)由天然气和水反应制备氢气:
 ,该反应过程中能量变化如下图所示,则该反应为
,该反应过程中能量变化如下图所示,则该反应为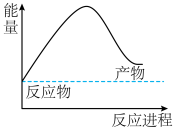
| 化学键 |  |  |  |  |
| 吸收热量(kJ/mol) | a | b | c | d |
(3)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是___________。
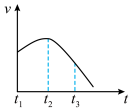
A.从 的原因是镁与酸的反应是放热反应,体系温度升高 的原因是镁与酸的反应是放热反应,体系温度升高 |
B.从 的原因水蒸发,致使酸的浓度升高 的原因水蒸发,致使酸的浓度升高 |
C.从 的原因是随着反应的进行镁条的质量下降 的原因是随着反应的进行镁条的质量下降 |
D.从 的原因是随着反应的进行, 的原因是随着反应的进行, 的浓度逐渐下降 的浓度逐渐下降 |
(4)在容积不变的10 L密闭容器中进行如下反应:
 ,开始时A的物质的量为3 mol B的物质的量为5 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率
,开始时A的物质的量为3 mol B的物质的量为5 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率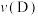 为0.02 mol/(L·min)。
为0.02 mol/(L·min)。①5 min末A的物质的量浓度为
②前5 min内用B表示的化学反应速率
 为
为③化学方程式中n的值为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】I.在研究化学反应中的能量变化时,我们通常做下面的实验:在一个小烧杯里,加入20g已经研磨成粉末的氢氧化钡晶体[ ],将小烧杯放在事先已滴有3-4滴水的木片上,然后向烧杯中加入约10g
],将小烧杯放在事先已滴有3-4滴水的木片上,然后向烧杯中加入约10g 晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:
晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:
(1)下图能正确表示该反应中能量变化的是_______ (填字母)。
A.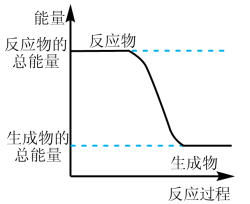 B.
B.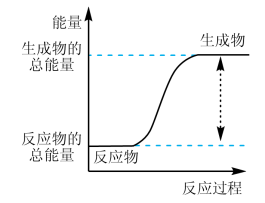
(2)写出发生反应的化学方程式_______ 。该反应的反应物化学键断裂吸收的能量_______ (填“高”或“低”)于生成物化学键形成放出的能量。
(3)实验中要立即用玻璃棒迅速搅拌的原因是_______ 。
Ⅱ.燃料电池在日常生活和科学研究中越来越得到广泛使用。通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置(其中电解质溶液为KOH溶液),被称为氢氧燃料电池。回答下列问题:

(4)该电池的正极是_______ (填a或b)。
(5)该电池的负极反应为_______
(6)电路中转移0.6mol电子,消耗 的体积为
的体积为_______ L(标准状况)。
 ],将小烧杯放在事先已滴有3-4滴水的木片上,然后向烧杯中加入约10g
],将小烧杯放在事先已滴有3-4滴水的木片上,然后向烧杯中加入约10g 晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:
晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:(1)下图能正确表示该反应中能量变化的是
A.
 B.
B.
(2)写出发生反应的化学方程式
(3)实验中要立即用玻璃棒迅速搅拌的原因是
Ⅱ.燃料电池在日常生活和科学研究中越来越得到广泛使用。通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置(其中电解质溶液为KOH溶液),被称为氢氧燃料电池。回答下列问题:

(4)该电池的正极是
(5)该电池的负极反应为
(6)电路中转移0.6mol电子,消耗
 的体积为
的体积为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性。已知:
反应Ⅰ:4NH3(g)+5O2(g)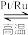 4NO(g)+6H2O(g) ΔH1=-905 kJ·mol-1
4NO(g)+6H2O(g) ΔH1=-905 kJ·mol-1
反应Ⅱ:4NH3(g)+3O2(g)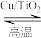 2N2(g)+6H2O(g) ΔH2=-1 266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH2=-1 266.6 kJ·mol-1
写出NO 分解生成N2与O2的热化学方程式______________________________________ 。
(2)N2O也可分解生成N2与O2。在四个恒容密闭容器中按下表相应量充入气体,发生2N2O(g) ⇌2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O平衡转化率如图所示。

①该反应的ΔH__________ 0(填“>”“=”或“<”);
②图中A、B、C 三点处容器内的总压强,由大到小的顺序是_____________________ ;
③容器Ⅳ在470 ℃进行反应时,起始速率:v(N2O)正______ v(N2O)逆(填“>”“=”或“<”)。
(3)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,在20 L密闭容器中充入1 mol NH3和2 mol O2,测得一定时间内有关物质的物质的量与温度的关系如图:
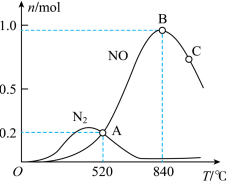
①该催化剂在低温时选择反应________ (填“Ⅰ”或“Ⅱ”)。
②C点比B点所产生的NO的物质的量少的原因可能是____________ 。
(1)催化剂常具有较强的选择性。已知:
反应Ⅰ:4NH3(g)+5O2(g)
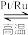 4NO(g)+6H2O(g) ΔH1=-905 kJ·mol-1
4NO(g)+6H2O(g) ΔH1=-905 kJ·mol-1反应Ⅱ:4NH3(g)+3O2(g)
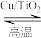 2N2(g)+6H2O(g) ΔH2=-1 266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH2=-1 266.6 kJ·mol-1写出NO 分解生成N2与O2的热化学方程式
(2)N2O也可分解生成N2与O2。在四个恒容密闭容器中按下表相应量充入气体,发生2N2O(g) ⇌2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O平衡转化率如图所示。
| 容器 | 容积/L | 起始物质的量/mol | ||
| N2O | N2 | O2 | ||
| Ⅰ | V1 | 0.1 | 0 | 0 |
| Ⅱ | 1.0 | 0.1 | 0 | 0 |
| Ⅲ | V2 | 0.1 | 0 | 0 |
| Ⅳ | 1.0 | 0.06 | 0.06 | 0.04 |

①该反应的ΔH
②图中A、B、C 三点处容器内的总压强,由大到小的顺序是
③容器Ⅳ在470 ℃进行反应时,起始速率:v(N2O)正
(3)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,在20 L密闭容器中充入1 mol NH3和2 mol O2,测得一定时间内有关物质的物质的量与温度的关系如图:

①该催化剂在低温时选择反应
②C点比B点所产生的NO的物质的量少的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g) =CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H3=+131.3kJ·mol-1
则反应CO(g)+H2(g)+O2(g)= H2O(g)+CO2(g)的△H=_______ kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移_____ mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-→3CO2+H2O;则该电池的正极反应式是:______________ 。
(3)密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=____________ ;此时在B点时容器的体积VB______ 10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA______ tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是_______________ 。
(1)已知:C(s)+O2(g) =CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H3=+131.3kJ·mol-1
则反应CO(g)+H2(g)+O2(g)= H2O(g)+CO2(g)的△H=
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-→3CO2+H2O;则该电池的正极反应式是:
(3)密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】最近,著名记者柴静的雾霾调查纪录片 穹顶之下
穹顶之下 ,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.
,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.

(1)上述流程中循环使用的物质有______ ,吸收池Ⅰ吸收的气体有 ______ .
(2)向吸收池Ⅳ得到的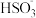 溶液中滴加
溶液中滴加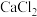 溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:
溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: ______ .
(3)电解池Ⅴ制得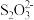 的原理如图1所示.
的原理如图1所示.
写出电解总反应的离子方程式______ .

(4) 和
和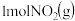 反应生成
反应生成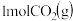 和
和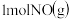 ,反应过程中的能量变化如图2,
,反应过程中的能量变化如图2,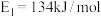 ,
,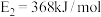 .
.
已知:①
②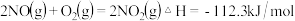
请写出NO与CO反应生成无污染气体的热化学方程式:______ .
(5)上述流程中每一步均恰好完全反应,若制得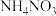 质量为xkg,电解池V制得
质量为xkg,电解池V制得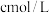 的
的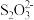 溶液
溶液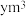 ,则氧化池Ⅵ中消耗的
,则氧化池Ⅵ中消耗的 在标准状况下的体积为
在标准状况下的体积为 ______  .
.
 穹顶之下
穹顶之下 ,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.
,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法. 
(1)上述流程中循环使用的物质有
(2)向吸收池Ⅳ得到的
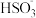 溶液中滴加
溶液中滴加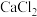 溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:
溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: (3)电解池Ⅴ制得
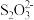 的原理如图1所示.
的原理如图1所示. 写出电解总反应的离子方程式

(4)
 和
和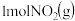 反应生成
反应生成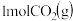 和
和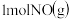 ,反应过程中的能量变化如图2,
,反应过程中的能量变化如图2,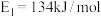 ,
,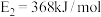 .
.已知:①

②
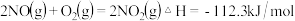
请写出NO与CO反应生成无污染气体的热化学方程式:
(5)上述流程中每一步均恰好完全反应,若制得
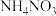 质量为xkg,电解池V制得
质量为xkg,电解池V制得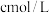 的
的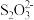 溶液
溶液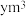 ,则氧化池Ⅵ中消耗的
,则氧化池Ⅵ中消耗的 在标准状况下的体积为
在标准状况下的体积为 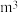 .
.
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____ (填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______ mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
①由上表判断,催化剂X____ Y(填“优于”或“劣于”),理由是_________________ 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________ 填标号)。

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
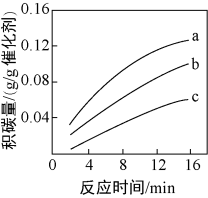
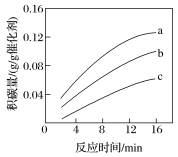
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________ 。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
| ΔH/(kJ·mol−1) | 75 | 172 | |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g)△H=+247kJ/mol;
①有利于提高CH4平衡转化率的条件是____
A.高温低压B.低温高压C.高温高压D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______ mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
①由上表判断,催化剂X____ Y(填“优于”或“劣于”),理由是_________________ 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________
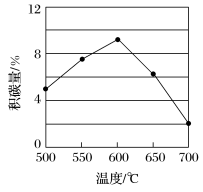
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数‘
②在一定温度下,测得某催化剂上沉积碳的生成速率方v=k·p(CH4)·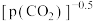 (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为
(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________ 。
(1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g)△H=+247kJ/mol;
①有利于提高CH4平衡转化率的条件是
A.高温低压B.低温高压C.高温高压D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
| 积碳反应CH4(g)= C(s)+2H2(g) | 消碳反应CO2(g)+ C(s)= 2CO(g) | ||
| ΔH/(kJ·mol−1) | 75 | 172 | |
| 活化能/(kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |
①由上表判断,催化剂X

A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数‘
②在一定温度下,测得某催化剂上沉积碳的生成速率方v=k·p(CH4)·
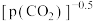 (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为
(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】乙烯、丙烯是极为重要的石油化工原料,中国石化集团于2021年11月17日宣布,我国已经实现“轻质原油裂解制乙烯、丙烯”工业化生产,此技术或大幅缩短生产流程、降低生产成本、减排二氧化碳。
(1)已知裂解过程存在两个反应:
ⅰ.
ⅱ.
则
_______ ;下列措施最有可能提高丙烯产率的是_______ (填标号)。
A.减小压强 B.分离出
C.升高温度 D.使用对丙烯高选择性的催化剂
(2)一定条件下,向某密闭容器中通入 的丁烷,控制适当条件使其发生如下反应:
的丁烷,控制适当条件使其发生如下反应: ,测得丁烷的平衡转化率随温度、压强的变化如下图所示:
,测得丁烷的平衡转化率随温度、压强的变化如下图所示:

①X表示_______ (填“温度”或“压强”),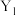
_______ 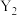 (填“>”或“<”),该反应为焓
(填“>”或“<”),该反应为焓_______ (填“增”或“减”)反应。
②A点对应的压强为 ,若反应从开始到恰好达到平衡状态所用时间为
,若反应从开始到恰好达到平衡状态所用时间为 ,则
,则
_______  ,此温度下平衡常数
,此温度下平衡常数
_______ ,A、B、C三点对应的平衡常数 的大小关系为
的大小关系为_______ 。( 为用分压表示的平衡常数,分压=总压×物质的量分数)
为用分压表示的平衡常数,分压=总压×物质的量分数)
(1)已知裂解过程存在两个反应:
ⅰ.

ⅱ.

则

A.减小压强 B.分离出

C.升高温度 D.使用对丙烯高选择性的催化剂
(2)一定条件下,向某密闭容器中通入
 的丁烷,控制适当条件使其发生如下反应:
的丁烷,控制适当条件使其发生如下反应: ,测得丁烷的平衡转化率随温度、压强的变化如下图所示:
,测得丁烷的平衡转化率随温度、压强的变化如下图所示:
①X表示
 (填“>”或“<”),该反应为焓
(填“>”或“<”),该反应为焓②A点对应的压强为
 ,若反应从开始到恰好达到平衡状态所用时间为
,若反应从开始到恰好达到平衡状态所用时间为 ,则
,则
 ,此温度下平衡常数
,此温度下平衡常数
 的大小关系为
的大小关系为 为用分压表示的平衡常数,分压=总压×物质的量分数)
为用分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
【推荐1】氮及其化合物在生活和生产中应用广泛。
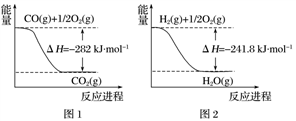
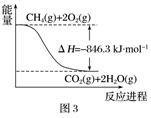
(1)合成氨用的H2可以CH4为原料制得。有关化学反应的能量变化如下图所示。则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为________________________________________________ 。
(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(
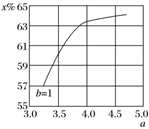
CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率( x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。
x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。_______ 。
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在175 ℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式:__________________ 。
(4)叠氮酸(HN3)是一种 一元弱酸,在水溶液中存在:HN
一元弱酸,在水溶液中存在:HN 3
3 H++N
H++N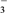 ,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=
,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=____________ (用含字母的代数式表示,忽略溶液体积变化)。
(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO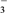 可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为
可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为_____________________________________________________________ 。
(1)合成氨用的H2可以CH4为原料制得。有关化学反应的能量变化如下图所示。则CH4(g) 与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为


(2)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率(
CO(NH2)2(l)+H2O(g)。下图为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]=1时二氧化碳转化率( x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。
x%)的曲线图。请画出在相同条件下,a=3.5~4.5范围内,b[n(H2O)/n(CO2)]=1.5时的二氧化碳转化率(x%)的曲线图。
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业生产NaN3主要是在175 ℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式:
(4)叠氮酸(HN3)是一种
 一元弱酸,在水溶液中存在:HN
一元弱酸,在水溶液中存在:HN 3
3 H++N
H++N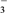 ,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=
,常温下将a mol NaN3加入到b L c mol·L-1的HN3溶液中,所得溶液呈中性,计算该温度下HN3的电离平衡常数Ka=(5)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO
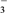 可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为
可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】丙烯腈是塑料、合成橡胶、合成纤维三大合成材料的重要原料,未来我国丙烯腈的出口量将进一步增加。合成丙烯腈的反应:
 。
。
(1)该反应中涉及的C、N、O三种元素原子的第一电离能由小到大的顺序是_______ 。
(2)一定条件下,在2L恒容密闭容器中;通入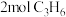 、
、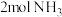 、15mol空气(
、15mol空气( 的体积分数为
的体积分数为 ),丙烯腈的产率与温度的关系如图所示。
),丙烯腈的产率与温度的关系如图所示。

①图中460℃前的产率_______ (填“是”或“否”)为平衡产率;理由是_______ 。
②若该反应达到A点所需的时间为t min,则理论上 的平均反应速率为
的平均反应速率为_______ 。
(3)工业上在催化剂作用下,合成丙烯腈时还有副反应:
 。
。
①其它条件不变时,压缩容器体积,副反应的平衡移动方向为_______ 。
②某温度下,向密闭容器中通入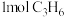 、
、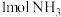 、7.5mol空气(
、7.5mol空气( 与
与 的体积比为1∶4),保持压强恒为99kPa,平衡时测得
的体积比为1∶4),保持压强恒为99kPa,平衡时测得 的转化率为90%,生成丙烯腈的选择性为
的转化率为90%,生成丙烯腈的选择性为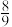 (选择性:生成丙烯腈的
(选择性:生成丙烯腈的 与共转化的
与共转化的 之比)。则生成丙烯腈的分压为
之比)。则生成丙烯腈的分压为_______ kPa,该温度下副反应的
_______ 。
(4)己二腈 是制造尼龙
是制造尼龙 的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
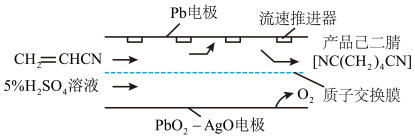
①阴极的电极反应式为_______ 。
②电解一段时间后,该装置产生的 在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
_______ %。(假设装置中阳极上没有电子损失,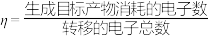 ×100%)
×100%)

 。
。(1)该反应中涉及的C、N、O三种元素原子的第一电离能由小到大的顺序是
(2)一定条件下,在2L恒容密闭容器中;通入
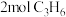 、
、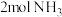 、15mol空气(
、15mol空气( 的体积分数为
的体积分数为 ),丙烯腈的产率与温度的关系如图所示。
),丙烯腈的产率与温度的关系如图所示。
①图中460℃前的产率
②若该反应达到A点所需的时间为t min,则理论上
 的平均反应速率为
的平均反应速率为(3)工业上在催化剂作用下,合成丙烯腈时还有副反应:

 。
。①其它条件不变时,压缩容器体积,副反应的平衡移动方向为
②某温度下,向密闭容器中通入
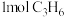 、
、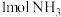 、7.5mol空气(
、7.5mol空气( 与
与 的体积比为1∶4),保持压强恒为99kPa,平衡时测得
的体积比为1∶4),保持压强恒为99kPa,平衡时测得 的转化率为90%,生成丙烯腈的选择性为
的转化率为90%,生成丙烯腈的选择性为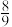 (选择性:生成丙烯腈的
(选择性:生成丙烯腈的 与共转化的
与共转化的 之比)。则生成丙烯腈的分压为
之比)。则生成丙烯腈的分压为
(4)己二腈
 是制造尼龙
是制造尼龙 的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
①阴极的电极反应式为
②电解一段时间后,该装置产生的
 在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
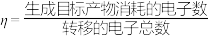 ×100%)
×100%)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】CO、NO、NO2、SO2都是大气污染物,减少这些氧化物排放对于环境保护具有重要的意义。
已知下列热化学方程式
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH2=+68kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221.0kJ·mol-1
(1)2NO2(g)+4CO(g)=4CO2(g)+N2(g)ΔH=__ kJ·mol-1。
①某温度下,在2L密闭容器中充入0.4molCO和0.6molNO2,此时容器的压强为2.0×105Pa,5s时,容器的压强变为原来的0.95倍,则从反应开始到5秒末NO2的平均反应速率v(NO2)=__ mol/(L·s)。
②下列能使该反应的反应速率增大,且平衡向正反应方向移动的是__ 。
A.适当升高温度
B.减小容器体积使体系压强增大
C.及时分离出CO2
D.向密闭容器中再充入0.4molNO2
(2)某温度下,下列反应的平衡常数如下:
a.2NO2(g)⇌N2(g)+2O2(g) K1=7.0×1016
b.2NO(g)⇌N2(g)+O2(g) K2=2.1×1030
反应2NO(g)+O2(g)⇌2NO2(g)的平衡常数K3=__ 。
(3)在催化剂作用下用CO还原NO2进行尾气处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量与时间变化如图a。活化能最小的是_ (用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。

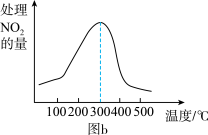
②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图b。图中曲线先增大后减小,请说明后减小的原因___ (假设该温度范围内催化效率相同)。
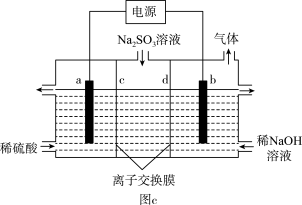
(4)煤燃烧产生的SO2用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如图c所示(电极材料为石墨)。a电极反应式为__ 。b为_ (阴、阳)极,d离子交换膜为__ (阴、阳)离子交换膜。
已知下列热化学方程式
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH2=+68kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221.0kJ·mol-1
(1)2NO2(g)+4CO(g)=4CO2(g)+N2(g)ΔH=
①某温度下,在2L密闭容器中充入0.4molCO和0.6molNO2,此时容器的压强为2.0×105Pa,5s时,容器的压强变为原来的0.95倍,则从反应开始到5秒末NO2的平均反应速率v(NO2)=
②下列能使该反应的反应速率增大,且平衡向正反应方向移动的是
A.适当升高温度
B.减小容器体积使体系压强增大
C.及时分离出CO2
D.向密闭容器中再充入0.4molNO2
(2)某温度下,下列反应的平衡常数如下:
a.2NO2(g)⇌N2(g)+2O2(g) K1=7.0×1016
b.2NO(g)⇌N2(g)+O2(g) K2=2.1×1030
反应2NO(g)+O2(g)⇌2NO2(g)的平衡常数K3=
(3)在催化剂作用下用CO还原NO2进行尾气处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量与时间变化如图a。活化能最小的是

②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图b。图中曲线先增大后减小,请说明后减小的原因

(4)煤燃烧产生的SO2用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如图c所示(电极材料为石墨)。a电极反应式为

您最近一年使用:0次



