CO2-H2催化重整可获得CH3OH。其主要反应为
反应I: CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H1=-53.7kJ·mol-1
反应II:CO2(g) + H2(g)= CO(g) + H2O(g) △H2=+41kJ·mol-1
若仅考虑上述反应,在5.0 MPa、n始(CO2): n始(H2)=1:3时,原料按一定流速通过反应器,CO2的转化率和CH3OH的选择性随温度变化如图所示。CH3OH的选择性=

下列说法正确的是
反应I: CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H1=-53.7kJ·mol-1
反应II:CO2(g) + H2(g)= CO(g) + H2O(g) △H2=+41kJ·mol-1
若仅考虑上述反应,在5.0 MPa、n始(CO2): n始(H2)=1:3时,原料按一定流速通过反应器,CO2的转化率和CH3OH的选择性随温度变化如图所示。CH3OH的选择性=


下列说法正确的是
| A.其他条件不变,升高温度,CO2的平衡转化率增大 |
| B.其他条件不变,T>236℃时,曲线下降的可能原因是反应1正反应程度减弱 |
| C.一定温度下,增大n始(CO2):n始(H2)可提高CO2平衡转化率 |
| D.研发高温高效催化剂可提高平衡时CH3OH的选择性 |
2023·江苏·一模 查看更多[6]
江苏省苏北四市(徐州、淮安、宿迁、连云港)2023届高三上学期第一次调研测试化学试题(已下线)专题14 化学反应速率和化学平衡湖南省长沙市雅礼中学2023届高三模拟考试(一)化学试题(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)湖南省永州市第一中学2024届高三上学期第一次月考化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
更新时间:2023-01-17 00:05:32
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0.得到如表中的两组数据:

下列说法不正确的是( )

下列说法不正确的是( )
| A.x=1.6,y=0.2,t<6 | B.T1、T2的关系:T1>T2 |
| C.K1、K2的关系:K2>K1 | D.实验1在前6 min的反应速率v (SO2)=0.2 mol•L﹣1•min﹣1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】一定条件下,CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1;向2 L恒容恒温密闭容器中充入1 mol CO2和2.8 mol H2反应,图中过程Ⅰ、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法中不正确的是( )
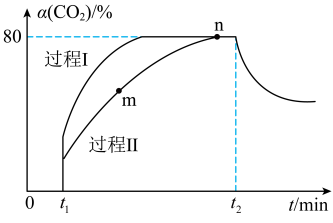

| A.m点:v正>v逆 |
| B.活化能:过程Ⅱ>过程Ⅰ |
| C.已知平衡时n点总压强为P ,该反应的压强平衡常数KP=200× P-2 |
| D.过程Ⅰ,t2时刻改变的反应条件可能是升高温度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】已知298K时,2SO2(g)+O2(g)⇌2SO3(g) △H=-197 kJ/mol,在相同温度和压强下,向密闭容器通入2 mol SO2和1 mol O2达平衡时,放出热量Q1;向另一相同体积的密闭容器中通入1 mol SO2和0.5 mol O2达平衡时,放出热量Q2,则下列关系式正确的是
| A.Q2=Q1/2 | B.2Q2<Q1<197 kJ | C.Q2=Q1<197 kJ | D.以上均不正确 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
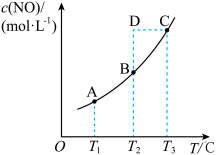
【推荐1】在容积一定的密闭容器中,置入一定量的 和足量碳,发生反应
和足量碳,发生反应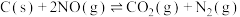 ,平衡状态时
,平衡状态时 的物质的量浓度
的物质的量浓度 与温度
与温度 的关系如图所示。则下列说法中正确的是
的关系如图所示。则下列说法中正确的是
 和足量碳,发生反应
和足量碳,发生反应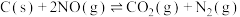 ,平衡状态时
,平衡状态时 的物质的量浓度
的物质的量浓度 与温度
与温度 的关系如图所示。则下列说法中正确的是
的关系如图所示。则下列说法中正确的是
A.若该反应在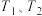 时的平衡常数分别为 时的平衡常数分别为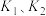 则 则 |
B.增加碳的量,可以增大 的转化率 的转化率 |
C.在 时,若反应体系处于状态 时,若反应体系处于状态 ,此时 ,此时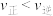 |
D.在 时,若混合气体的密度不再变化,则可以判断反应达到平衡状态 时,若混合气体的密度不再变化,则可以判断反应达到平衡状态 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】在其他条件不变时,只改变某一条件,化学反应aA(g)+bB(g)  cC(g)的平衡的变化图象如图(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
cC(g)的平衡的变化图象如图(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
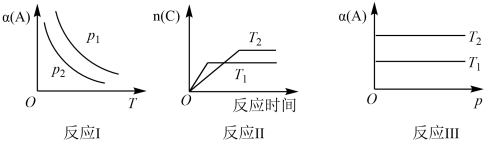
 cC(g)的平衡的变化图象如图(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
cC(g)的平衡的变化图象如图(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
| A.在图象反应I中,说明升高温度,K值增大 |
| B.在图象反应II中,说明该正反应为吸热反应 |
| C.在图象反应III中,若T1>T2,则该反应一定不能自发进行 |
| D.在图象反应I中,若p2>p1,则有a+b<c |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】工业上采用NH3作还原剂脱氮原理为:
NO(g) NO2(g)
NO2(g) 2NH3(g)
2NH3(g) 2N2(g)
2N2(g) 3H2O(g),
3H2O(g),
烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是
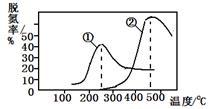
NO(g)
 NO2(g)
NO2(g) 2NH3(g)
2NH3(g) 2N2(g)
2N2(g) 3H2O(g),
3H2O(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是

| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450 ℃左右脱氮 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
| D.相同条件下,改变压强对脱氮率没有影响 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列事实中,不能用勒夏特列原理解释的是
A.氯水中存在平衡 ,当加入 ,当加入 溶液后溶液颜色变浅 溶液后溶液颜色变浅 |
B.反应 (正反应放热),升高温度可使平衡向逆反应方向移动 (正反应放热),升高温度可使平衡向逆反应方向移动 |
| C.在合成氨工业中,常通入过量的氮气以提高氢气的利用率 |
D.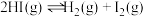 达到平衡后,缩小容器体积可使体系颜色变深 达到平衡后,缩小容器体积可使体系颜色变深 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列解释实验事实的方程式不正确的是
A.0.1mol/LCH3COOH溶液的 pH>1:CH3COOH CH3COO-+H+ CH3COO-+H+ |
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)  N2O4(g) △H<0 N2O4(g) △H<0 |
C.少量铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO =3Fe2++2NO↑+4H2O =3Fe2++2NO↑+4H2O |
D.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO +H2O +H2O HCO HCO +OH- +OH- |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】一定温度的密闭容器中,反应A(g)+B(g) 2C(g) △H>0达平衡,下列说法错误的是
2C(g) △H>0达平衡,下列说法错误的是
 2C(g) △H>0达平衡,下列说法错误的是
2C(g) △H>0达平衡,下列说法错误的是| A.相同时间内,存在关系△n(C)=2△n(A) |
| B.其他条件不变,增大压强或添加催化剂,c(A)不变 |
| C.反应正向的活化能一定大于逆反应的活化能 |
| D.升高温度,该反应的平衡常数增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】X、Y、Z为三种气体,把amolX和bmolY充入一密闭容器中,发生反应X+2Y 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为A. | B.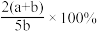 | C.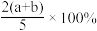 | D.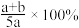 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】从烟道废气中回收硫的原理之一: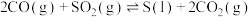
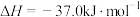 ,在恒压密闭容器中,平衡时SO2的转化率
,在恒压密闭容器中,平衡时SO2的转化率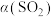 与起始充入的
与起始充入的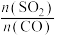 和温度(T)的关系如图所示。下列说法中正确的是
和温度(T)的关系如图所示。下列说法中正确的是
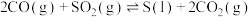
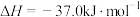 ,在恒压密闭容器中,平衡时SO2的转化率
,在恒压密闭容器中,平衡时SO2的转化率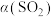 与起始充入的
与起始充入的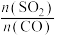 和温度(T)的关系如图所示。下列说法中正确的是
和温度(T)的关系如图所示。下列说法中正确的是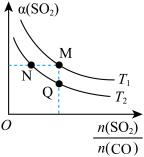
A.正反应的活化能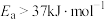 |
B.CO的转化率 :M>N :M>N |
C.正反应速率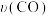 :M>Q :M>Q |
D.该反应的化学平衡常数表达式: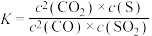 |
您最近一年使用:0次

 K=0.1。反应前CO的物质的量为10mol,平衡后CO的物质的量为8mol。下列说法正确的是
K=0.1。反应前CO的物质的量为10mol,平衡后CO的物质的量为8mol。下列说法正确的是

