HR是一元弱酸,向 的HR溶液中缓慢加入NaOH固体(溶液温度恒为25℃。不考虑溶液体积的变化),平衡后
的HR溶液中缓慢加入NaOH固体(溶液温度恒为25℃。不考虑溶液体积的变化),平衡后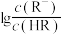 与溶液pH的关系如图所示(已知
与溶液pH的关系如图所示(已知 )。下列说法正确的是
)。下列说法正确的是

 的HR溶液中缓慢加入NaOH固体(溶液温度恒为25℃。不考虑溶液体积的变化),平衡后
的HR溶液中缓慢加入NaOH固体(溶液温度恒为25℃。不考虑溶液体积的变化),平衡后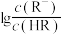 与溶液pH的关系如图所示(已知
与溶液pH的关系如图所示(已知 )。下列说法正确的是
)。下列说法正确的是
A.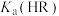 的数量级是 的数量级是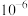 |
B. 的分布分数 的分布分数 等于 等于 时,溶液的pH=4.1 时,溶液的pH=4.1 |
| C.b点恰好有50%的HR与NaOH发生了反应 |
D.c点: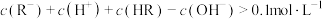 |
22-23高二上·湖北·期末 查看更多[3]
湖北省部分市州2022-2023学年高二上学期元月联合调研考试化学试题江西省丰城市第九中学2022-2023学年高一下学期期末考试化学试题(已下线)题型02 溶液中粒子浓度大小比较-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
更新时间:2023-02-07 15:55:53
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】已知草酸( )为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的
)为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的 溶液,溶液中
溶液,溶液中 、
、 、
、 三种微粒分别在三者中所占的物质的量分数
三种微粒分别在三者中所占的物质的量分数 与溶液
与溶液 的关系如图所示。下列说法中正确的是
的关系如图所示。下列说法中正确的是

 )为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的
)为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的 溶液,溶液中
溶液,溶液中 、
、 、
、 三种微粒分别在三者中所占的物质的量分数
三种微粒分别在三者中所占的物质的量分数 与溶液
与溶液 的关系如图所示。下列说法中正确的是
的关系如图所示。下列说法中正确的是
A.室温时, 的水解平衡常数 的水解平衡常数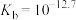 |
B.当溶液 时, 时,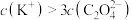 |
C.当溶液 时, 时,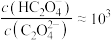 |
| D.A点溶液加水稀释,则水的电离程度减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列说法正确的是
| A.常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l |
| B.常温下pH =2的盐酸和pH =12的氨水等体积混合后c(Cl-)+c(H+)=c(NH4+)+c(OH-) |
| C.常温下0.1 mol·L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol·L-l |
D.常温下向10 mL0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,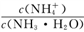 将减小 将减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
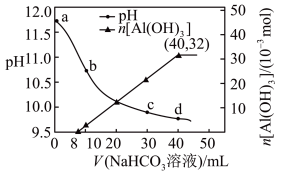
【推荐3】含 杂质的
杂质的 矿物,用
矿物,用 处理后,过滤,滤液里添加
处理后,过滤,滤液里添加 溶液,产生
溶液,产生 沉淀、溶液
沉淀、溶液 随
随 溶液体积关系如图所示,下列说法
溶液体积关系如图所示,下列说法不正确 的是
 杂质的
杂质的 矿物,用
矿物,用 处理后,过滤,滤液里添加
处理后,过滤,滤液里添加 溶液,产生
溶液,产生 沉淀、溶液
沉淀、溶液 随
随 溶液体积关系如图所示,下列说法
溶液体积关系如图所示,下列说法
A.一开始添加 溶液没有沉淀的原因是: 溶液没有沉淀的原因是: |
| B.b点水的电离程度大于d点水的电离程度 |
C.c点溶液中存在: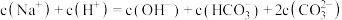 |
D.滤液中 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列各项关系中正确的是
| A.常温下,pH均为3的硫酸铝和醋酸两种溶液中,由水电离出的氢离子浓度之比为1:108 |
| B.常温下pH=a的稀H2SO4与pH=b的氨水等体积混合后恰好完全反应,则a+b<14 |
| C.25℃时0.1mol·L-1NH4Cl溶液的KW大于100℃时0.1mol•L-1NaCl溶液的KW |
| D.pH相同的三种溶液①NH4Cl ②(NH4)2SO4 ③NH4HSO4,c(NH4+)大小关系为:①>②>③ |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,用0.1000mol/L的盐酸滴定20.00mL未知浓度的一元碱BOH溶液。溶液中,pH、B+的分布系数δ随滴加盐酸体积VHCl的变化关系如图所示。[比如B+的分布系数:

下列叙述正确的是


下列叙述正确的是
| A.滴定时,可以选择酚酞作指示剂 |
| B.BOH的电离常数Kb=1.0×10−5 |
| C.滴定过程中,水的电离程度:n<m<p |
| D.p点溶液中,粒子浓度大小为c(Cl-)>c(B+)=c(BOH) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
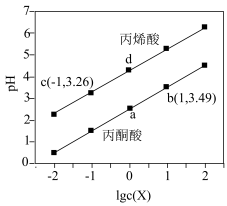
【推荐1】常温下,向体积均为 、浓度均为
、浓度均为 的丙烯酸(CH2=CHCOOH)、丙酮酸 (CH3COCOOH)溶液中分别滴加
的丙烯酸(CH2=CHCOOH)、丙酮酸 (CH3COCOOH)溶液中分别滴加 的
的 溶液,溶液的pH与
溶液,溶液的pH与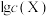 的关系如图所示[
的关系如图所示[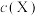 为
为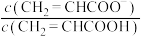 或
或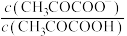 ]。下列说法正确的是
]。下列说法正确的是
 、浓度均为
、浓度均为 的丙烯酸(CH2=CHCOOH)、丙酮酸 (CH3COCOOH)溶液中分别滴加
的丙烯酸(CH2=CHCOOH)、丙酮酸 (CH3COCOOH)溶液中分别滴加 的
的 溶液,溶液的pH与
溶液,溶液的pH与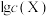 的关系如图所示[
的关系如图所示[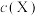 为
为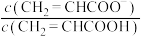 或
或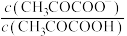 ]。下列说法正确的是
]。下列说法正确的是
| A.丙烯酸的酸性比丙酮酸的强 |
B.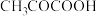 的 的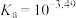 |
| C.向含相同浓度的丙烯酸钠和丙酮酸钠的混合溶液中滴加盐酸时,先生成丙烯酸 |
D.当加入 溶液时,两溶液的pH分别为4.26,2.49 溶液时,两溶液的pH分别为4.26,2.49 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】一种利用含钴废料(主要成分为 ,还含有少量
,还含有少量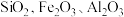 等杂质)制备
等杂质)制备 的工艺流程如下。
的工艺流程如下。 如下表:
如下表:
② 的
的 的
的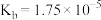 。
。
下列说法不正确的是
 ,还含有少量
,还含有少量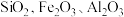 等杂质)制备
等杂质)制备 的工艺流程如下。
的工艺流程如下。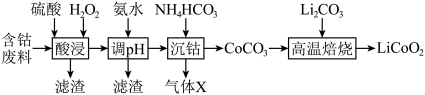
 如下表:
如下表:| 金属离子 |  |  |  |  |
开始沉淀的 | 8.5 | 2.2 | 3.4 | 7.8 |
完全沉淀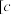 (金属离子) (金属离子)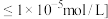 的的 的的 | 10.0 | 3.0 | 4.5 | 9.4 |
 的
的 的
的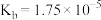 。
。下列说法不正确的是
A.由流程可知氧化性: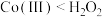 |
B.常温下加入的 溶液显碱性 溶液显碱性 |
C.气体 通入氨水至过量后所得溶液可循环利用 通入氨水至过量后所得溶液可循环利用 |
D.“高温焙烧”时的化学方程式: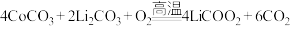 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】室温下,向H2C2O4溶液中滴加NaOH溶液,若pC=-lgc,则所得溶液中pC(H2C2O4)、pC(HC2O )、pC(C2O
)、pC(C2O )与溶液pH的关系如图所示。下列说法正确的是
)与溶液pH的关系如图所示。下列说法正确的是
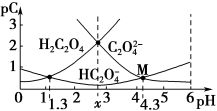
 )、pC(C2O
)、pC(C2O )与溶液pH的关系如图所示。下列说法正确的是
)与溶液pH的关系如图所示。下列说法正确的是
| A.常温下,Ka2(H2C2O4)=10-1.3 |
B.pH=x时,c(HC2O )<c(H2C2O4)=c(C2O )<c(H2C2O4)=c(C2O ) ) |
C.M点时,2c(HC2O )+c(C2O )+c(C2O )﹥c(Na+) )﹥c(Na+) |
D. 随pH的升高而减小 随pH的升高而减小 |
您最近一年使用:0次

 )
) 增大
增大

